解题方法
1 . 近日,科学家利用铁配合物催化氮气选择性转化成肼。铁配合物结构如图所示(Et为乙基:-CH2CH3)。

回答下列问题:
(1)基态 的价层电子排布式
的价层电子排布式___________ ,微粒半径Fe___________  。(填“大于”、“小于”或“等于”)
。(填“大于”、“小于”或“等于”)
(2) 所含元素中,电负性最大的元素是
所含元素中,电负性最大的元素是___________ 。P原子的杂化类型是___________ 。
(3) 和
和 的相对分子质量相同,但是常温常压下,
的相对分子质量相同,但是常温常压下, 呈液态,而
呈液态,而 呈气态,其主要原因是
呈气态,其主要原因是___________ 。
(4) 的VSEPR模型为
的VSEPR模型为___________ 。写出N2的一种等电子体___________ 。
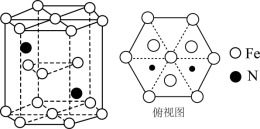
(5)某种磁性氮化铁的晶胞结构如图所示。已知: 为阿伏加德罗常数的值,六棱柱底边的边长为
为阿伏加德罗常数的值,六棱柱底边的边长为 ,高为
,高为 ,该晶体中Fe、N原子个数最简比为
,该晶体中Fe、N原子个数最简比为___________ 。该晶体的密度为___________  (只列计算式)。
(只列计算式)。

回答下列问题:
(1)基态
 的价层电子排布式
的价层电子排布式 。(填“大于”、“小于”或“等于”)
。(填“大于”、“小于”或“等于”)(2)
 所含元素中,电负性最大的元素是
所含元素中,电负性最大的元素是(3)
 和
和 的相对分子质量相同,但是常温常压下,
的相对分子质量相同,但是常温常压下, 呈液态,而
呈液态,而 呈气态,其主要原因是
呈气态,其主要原因是(4)
 的VSEPR模型为
的VSEPR模型为(5)某种磁性氮化铁的晶胞结构如图所示。已知:
 为阿伏加德罗常数的值,六棱柱底边的边长为
为阿伏加德罗常数的值,六棱柱底边的边长为 ,高为
,高为 ,该晶体中Fe、N原子个数最简比为
,该晶体中Fe、N原子个数最简比为 (只列计算式)。
(只列计算式)。
您最近一年使用:0次
名校
解题方法
2 . 比较 与
与 、
、 与
与 的键角大小,下列排序正确的是
的键角大小,下列排序正确的是
 与
与 、
、 与
与 的键角大小,下列排序正确的是
的键角大小,下列排序正确的是A. , , | B. , , |
C. , , | D. , , |
您最近一年使用:0次
3 . 请回答下列问题:
(1)I 离子的立体构型是
离子的立体构型是___________ 。
(2)下列氟元素的不同微粒,用光谱仪可捕捉到发射光谱的是___________。
(3)第四周期主族元素中,第一电离能介于Ga、As之间的元素有___________ 种。
(4)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是___________ 。
(5)氧是地壳中含量最多的元素。H+可与H2O形成H3O+,H3O+中H-O-H键角比H2O中H-O-H键角大,原因为___________ 。
(1)I
 离子的立体构型是
离子的立体构型是(2)下列氟元素的不同微粒,用光谱仪可捕捉到发射光谱的是___________。
| A.1s22s22p43s1 | B.1s22s22p43d2 | C.1s22s22p5 | D.1s22s22p6 |
(3)第四周期主族元素中,第一电离能介于Ga、As之间的元素有
(4)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
| 元素 | Mn | Fe | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(5)氧是地壳中含量最多的元素。H+可与H2O形成H3O+,H3O+中H-O-H键角比H2O中H-O-H键角大,原因为
您最近一年使用:0次
名校
解题方法
4 . 由H、C、O、N、S、Al、Fe、Ti等元素能形成多种物质。这些物质有许多用途。请回答下列问题:
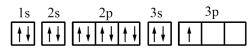
(1)某同学写出了铝原子的4种不同状态的电子排布图:
 .
.
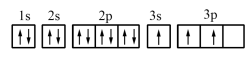
 .
.
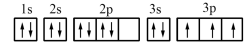
 .
.
 .
.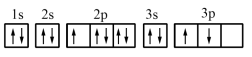
其中能量最低的是_______ (填字母)。
(2)C、O、N 原子的第一电离能由大到小的顺序为_______ ;H2S的键角比H2O的键角_______ (填“大”或“小”)
(3)铁能与三氮唑(结构见图甲)形成多种配合物。
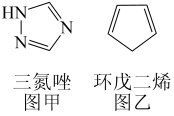
①l mol三氮唑中所含σ键的数目为_______ mol; 碳原子杂化方式是_______ ;
②三氮唑的沸点为260℃,与之结构相似且相对分子质量接近的环戊二烯(结构见图乙)的沸点为42.5℃,前者沸点较高的原因是_______ 。
(4)近年来,钙钛矿太阳能电池是光电材料领域的研究热门,其晶胞结构如下图所示:
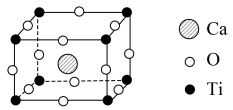
钙钛矿的化学式为_______ ,该晶胞中Ca2+与O2-的最短距离是_______ cm(已知晶胞参数为anm)。
(1)某同学写出了铝原子的4种不同状态的电子排布图:
 .
.
 .
.
 .
.
 .
.
其中能量最低的是
(2)C、O、N 原子的第一电离能由大到小的顺序为
(3)铁能与三氮唑(结构见图甲)形成多种配合物。

①l mol三氮唑中所含σ键的数目为
②三氮唑的沸点为260℃,与之结构相似且相对分子质量接近的环戊二烯(结构见图乙)的沸点为42.5℃,前者沸点较高的原因是
(4)近年来,钙钛矿太阳能电池是光电材料领域的研究热门,其晶胞结构如下图所示:

钙钛矿的化学式为
您最近一年使用:0次
2023-08-27更新
|
71次组卷
|
2卷引用:陕西省汉中中学2024届高三上学期8月质量检测化学试题
解题方法
5 . 钛被称为继铁、铝之后的“第三金属”,其单质及化合物在航天、军事、航海、医疗等领域都有着重要的应用。回答下列问题:
(1)基态钛原子的价电子排布式为_______ 。
(2)硫酸氧钛( )中
)中 的空间结构为
的空间结构为_______ , 中心原子的轨道杂化类型为
中心原子的轨道杂化类型为_______ 。
(3)几种卤化钛晶体熔点如下表所示:
 的熔点明显高于
的熔点明显高于 ,原因是
,原因是_______ 。 、
、 、
、 的点依次升高的原因是
的点依次升高的原因是_______ 。
(4)钛的配合物有多种。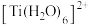 、
、 、
、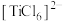 的配体中所含原子电负性由大到小的顺序是
的配体中所含原子电负性由大到小的顺序是_______ ,其中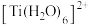 中
中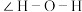
_______ (填“大于”、“小于”或“等于”)单个水分子中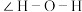 。
。
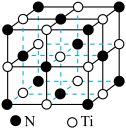
(5)硼钛二元化合物是一种高熔点、高硬度、抗氧化的新型陶瓷材料,属于六方晶系,其晶体结构如图,该硼钛二元化合物的化学式为_______ 。

(6)氮化钛具有典型的 型晶体结构,晶胞结构如图所示,若该晶胞的密度为
型晶体结构,晶胞结构如图所示,若该晶胞的密度为 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 ,则晶胞中Ti原子与Ti原子的最近距离为
,则晶胞中Ti原子与Ti原子的最近距离为_______ pm(用含 、
、 的代数式表示)。
的代数式表示)。
(1)基态钛原子的价电子排布式为
(2)硫酸氧钛(
 )中
)中 的空间结构为
的空间结构为 中心原子的轨道杂化类型为
中心原子的轨道杂化类型为(3)几种卤化钛晶体熔点如下表所示:
| 卤化钛 |  |  |  |  |
| 熔点/℃ | 1200 |  | 39 | 150 |
 的熔点明显高于
的熔点明显高于 ,原因是
,原因是 、
、 、
、 的点依次升高的原因是
的点依次升高的原因是(4)钛的配合物有多种。
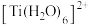 、
、 、
、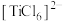 的配体中所含原子电负性由大到小的顺序是
的配体中所含原子电负性由大到小的顺序是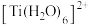 中
中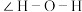
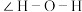 。
。(5)硼钛二元化合物是一种高熔点、高硬度、抗氧化的新型陶瓷材料,属于六方晶系,其晶体结构如图,该硼钛二元化合物的化学式为

(6)氮化钛具有典型的
 型晶体结构,晶胞结构如图所示,若该晶胞的密度为
型晶体结构,晶胞结构如图所示,若该晶胞的密度为 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 ,则晶胞中Ti原子与Ti原子的最近距离为
,则晶胞中Ti原子与Ti原子的最近距离为 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
6 . 回答下列问题:
(1)基态硫原子电子占据的最高能层符号为_______ ,核外有_______ 种能量不同的电子,硫原子核外电子有_______ 种空间运动状态。与S同主族的第4种元素的符号是_______ ,其价电子排布式为_______ 。
(2)已知有下列转化:
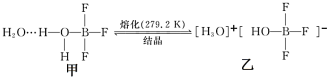
H3O+的VSEPR模型为_______ 。化学物乙中微粒间不存在的作用力有_______ (填序号)。
A.离子键 B.共价键 C.配位键 D.σ键 E.金属键
(3)向 CuSO4溶液中加入过量氨水可生成[Cu(NH3)4]2+,不考虑空间构型,该配离子的结构示意图为_______ 。1mol[Cu(NH3)4]2+中σ键的数目为_______ 。
(4)已知胆矾的结构式如下,则胆矾的化学式用配合物的形式表示为_______ 。

(1)基态硫原子电子占据的最高能层符号为
(2)已知有下列转化:

H3O+的VSEPR模型为
A.离子键 B.共价键 C.配位键 D.σ键 E.金属键
(3)向 CuSO4溶液中加入过量氨水可生成[Cu(NH3)4]2+,不考虑空间构型,该配离子的结构示意图为
(4)已知胆矾的结构式如下,则胆矾的化学式用配合物的形式表示为

您最近一年使用:0次
解题方法
7 . 请按要求回答下列问题:
(1)符号“3px”没有给出的信息是___________。
(2)某元素基态原子4s轨道上有1个电子,则该元素基态原子价电子排布不可能是___________。
(3)X元素的原子最外层电子排布式为(n+1)sn(n+1)pn+1,则X的氢化物的化学式是___________。
(4)下列比较正确的是___________ 。
A.酸性:H3PO4<H3AsO4 B.键角:H2O<NH3 C.离子半径:r(Al3+)>r(O2-)
(5)下列实验事实不能用氢键来解释的是___________。
(1)符号“3px”没有给出的信息是___________。
| A.能层 | B.能级 | C.电子云在空间的伸展方向 | D.电子的自旋方向 |
| A.4s1 | B.3p64s1 | C.3d54s1 | D.3d104s1 |
| A.HX | B.H2X | C.XH3 | D.XH4 |
A.酸性:H3PO4<H3AsO4 B.键角:H2O<NH3 C.离子半径:r(Al3+)>r(O2-)
(5)下列实验事实不能用氢键来解释的是___________。
| A.CH4比SiH4稳定 |
| B.乙醇能与水以任意比互溶 |
| C.邻羟基苯甲醛的沸点低于对羟基苯甲醛 |
| D.接近沸点的水蒸气的相对分子质量测量值大于18 |
您最近一年使用:0次
解题方法
8 . 下列分子中,杂化类型相同,空间结构也相同的是
| A.H2O、SO2 | B.H2O、NH3 | C.NH3、CH4 | D.HCN、CO2 |
您最近一年使用:0次
2023-05-04更新
|
173次组卷
|
2卷引用:陕西省宝鸡市渭滨区2022-2023学年高二下学期期末检测化学试题
名校
9 . 铁在史前就为人们所用。在人类文明发展过程中,铁所起的作用是其他任何元素都不能比拟的。请回答下列问题:
(1)基态铁原子中,价电子电子云的伸展方向有_______ 种。
(2)五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有_________ ( 填序号);
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是___________________ 。
(3)绿矾(FeSO4·7H2O)结构如图。

①H2O分别与Fe2+、 的相互作用分别为
的相互作用分别为_______________ 、_____________ 。
②比较 中的键角∠O−S−O
中的键角∠O−S−O________ H2O中的键角∠H−O−H。 (填“<” “>”或“=”)
(4)铁的化合物种类众多,其中FeF3的熔点高于1000°C,而FeBr3的熔点只有200°C,原因是___________ 。
(5)铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为_____________________ 。

(6)一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm=____________ cm3·mol−1 (已知阿伏加德罗常数为NA,晶体的摩尔体积是指单位物质的量晶体所占的体积)。
(1)基态铁原子中,价电子电子云的伸展方向有
(2)五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是
(3)绿矾(FeSO4·7H2O)结构如图。

①H2O分别与Fe2+、
 的相互作用分别为
的相互作用分别为②比较
 中的键角∠O−S−O
中的键角∠O−S−O(4)铁的化合物种类众多,其中FeF3的熔点高于1000°C,而FeBr3的熔点只有200°C,原因是
(5)铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为

(6)一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm=
您最近一年使用:0次
2023-04-14更新
|
495次组卷
|
3卷引用:陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题
陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题广东省深圳市龙华中学2022-2023学年高二下学期5月期中考试化学试题(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
解题方法
10 . 下表中各粒子对应的空间结构及解释均正确的是
| 选项 | 粒子 | 空间结构 | 解释 |
| A | 氨基负离子( ) ) | 直线形 | N原子采取 杂化 杂化 |
| B | 二氧化硫( ) ) | V形 | S原子采取 杂化 杂化 |
| C | 碳酸根离子( ) ) | 三角锥形 | C原子采取 杂化 杂化 |
| D | 乙炔( ) ) | 直线形 | C原子采取 杂化且C原子的价电子均参与成键 杂化且C原子的价电子均参与成键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-07更新
|
295次组卷
|
27卷引用:陕西省武功县普集高级中学2022-2023学年高二下学期第一次月考化学试题
陕西省武功县普集高级中学2022-2023学年高二下学期第一次月考化学试题陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题天津市耀华中学2022-2023学年高二上学期期末考试化学试题广东省阳山县南阳中学2022-2023学年高二下学期第一次月考化学试题广东省深圳龙岗四校2022--2023学年高二下学期期中考试化学试题安徽省颍上第一中学2022-2023学年高二下学期5月月考化学试题黑龙江省大庆市肇州县第二中学2023-2024学年高二上学期12月月考化学试题四川省绵阳市东辰学校2023-2024学年高二上学期第四次月考化学试题 2015-2016学年江苏省泰州中学高二下期中化学试卷四川省新津中学2019-2020学年高二下学期4月月考(入学)化学试题四川省成都外国语学校2019-2020学年高二下学期期中考试化学试题四川绵阳南山中学双语学校2020-2021学年高二上学期10月月考化学试题湖南师范大学附属中学2020-2021学年高二上学期第三次大练习化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 B素养拓展区河南省名校联盟2020-2021学年高二下学期开学考试化学试题(已下线)2.2 分子的空间结构(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)山东省泰安市宁阳一中2020-2021学年高二下学期3月月考化学试题(已下线)作业04 分子的空间结构-2021年高二化学暑假作业(人教版2019)(已下线)2.2.2 杂化轨道理论(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)第2.2.2讲 杂化轨道理论-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)(已下线)第2章 章末综合测评B-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)专题4 分子空间结构与物质性质 专题强化练5 分子(离子)的空间结构与杂化轨道类型的判断第二节 分子的空间结构 第2课时 杂化轨道理论湖南省邵阳市新邵县2021-2022学年高二上学期期末考试化学试题福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(1卷)试题湖南省岳阳市岳阳县第一中学2023-2024学年高二下学期开学化学试题四川省内江市威远县威远中学校2023-2024学年高二下学期第一次月考化学试卷



