名校
解题方法
1 . 根据要求回答以下问题。
(1)下列铍粒子失去1个电子吸收能量最少的是_____(填标号)。
(2)苯分子中含有大 键,可记为
键,可记为 (右下角
(右下角 表示6个原子,右上角“6"表示6个共用电子)。已知某化合物的结构简式为
表示6个原子,右上角“6"表示6个共用电子)。已知某化合物的结构简式为  ,不能使溴的四氯化碳溶液褪色,该分子中的大
,不能使溴的四氯化碳溶液褪色,该分子中的大 键,可表示为
键,可表示为_______ , 的杂化方式为
的杂化方式为_______ 。
(3)硫酸铜溶于水后形成的水合铜离子的结构式为_______ (写清楚配位键),向硫酸铜溶液中逐滴加入氨水直至过量,观察到的现象为______ 。
(4)FeCl3的沸点(319℃,易升华)高于AsCl3的沸点(130.2℃),原因是_______ 。
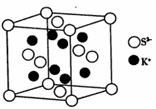
(5)PCl5是一种白色晶体,其晶胞如图所示。该晶体熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。

①写出PCl5熔融时的电离方程式_______ 。
②若晶胞参数为anm,则晶体的密度为_______  (列出计算式)。
(列出计算式)。
(1)下列铍粒子失去1个电子吸收能量最少的是_____(填标号)。
A. | B. | C.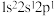 | D. |
(2)苯分子中含有大
 键,可记为
键,可记为 (右下角
(右下角 表示6个原子,右上角“6"表示6个共用电子)。已知某化合物的结构简式为
表示6个原子,右上角“6"表示6个共用电子)。已知某化合物的结构简式为  ,不能使溴的四氯化碳溶液褪色,该分子中的大
,不能使溴的四氯化碳溶液褪色,该分子中的大 键,可表示为
键,可表示为 的杂化方式为
的杂化方式为(3)硫酸铜溶于水后形成的水合铜离子的结构式为
(4)FeCl3的沸点(319℃,易升华)高于AsCl3的沸点(130.2℃),原因是
(5)PCl5是一种白色晶体,其晶胞如图所示。该晶体熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。

①写出PCl5熔融时的电离方程式
②若晶胞参数为anm,则晶体的密度为
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
解题方法
2 . 下表为长式周期表的一部分其中的编号代表对应的元素。
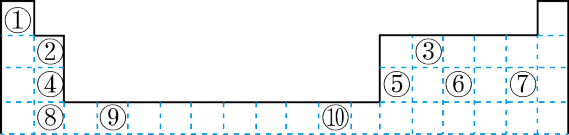
请回答下列问题:
(1)表中属于 ds 区的元素是___________ (填元素符号)它的基态原子的价电子排布式为___________ 。
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为___________ ,其中元素③的基态原子的电子排布图为_______ ;①和⑥形成的一种常见四原子分子的化学式为_______ ,该分子的立体构型为______ 。
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为___________ ;该元素与元素①形成的最简单分子 X 的电子式为___________ 。
(4)元素⑤的电负性___________ ④元素的电负性(选填>、=、<下同);元素⑥的第一电离能___________ 原子序数为 16 的元素的第一电离能。
(5)用电子式表示元素④和⑦组成的化合物的形成过程___________ 。

请回答下列问题:
(1)表中属于 ds 区的元素是
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为
(4)元素⑤的电负性
(5)用电子式表示元素④和⑦组成的化合物的形成过程
您最近一年使用:0次
解题方法
3 . 形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理”的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,基态Cr原子的价电子排布式为______ ,CrO2Cl2是_____ 分子(选填“极性”或“非极性”)。
(2)HC≡CNa(乙炔钠)广泛用于有机合成,乙炔钠中C原子的杂化类型为______ ;乙炔钠中存在________ (填字母序号)。
A.金属键 B.σ键 C.π键 D.氢键 E.配位键 F.离子键 G.范德华力
(3)分子式为[Pt(NH3)2Cl4]的配合物有两种不同的颜色,其中橙黄色较不稳定,在水中的溶解度大;呈亮黄色的物质在水中的溶解度小,如图所示的结构示意图中呈亮黄色的是_____ (填“A”或“B”)。

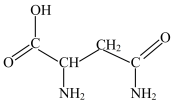
(4)芦笋中的天冬酰胺具有提高身体免疫力的功效,结构如图所示。其组成元素第一电离能由大到小的顺序为_______ (用元素符号表示)。
(5)某离子晶体的晶胞结构如图所示:
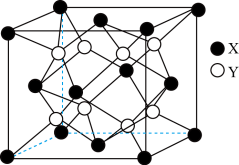
①晶体中在每个X周围与它最近且距离相等的X共有____ 个。
②设该晶体的摩尔质量为Mg·mol–1,晶胞的密度为ρ g·cm–3,阿伏加 德罗常数为NA,则晶体中两个最近的X间的距离为_______ pm。
(1)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,基态Cr原子的价电子排布式为
(2)HC≡CNa(乙炔钠)广泛用于有机合成,乙炔钠中C原子的杂化类型为
A.金属键 B.σ键 C.π键 D.氢键 E.配位键 F.离子键 G.范德华力
(3)分子式为[Pt(NH3)2Cl4]的配合物有两种不同的颜色,其中橙黄色较不稳定,在水中的溶解度大;呈亮黄色的物质在水中的溶解度小,如图所示的结构示意图中呈亮黄色的是

(4)芦笋中的天冬酰胺具有提高身体免疫力的功效,结构如图所示。其组成元素第一电离能由大到小的顺序为

(5)某离子晶体的晶胞结构如图所示:

①晶体中在每个X周围与它最近且距离相等的X共有
②设该晶体的摩尔质量为Mg·mol–1,晶胞的密度为ρ g·cm–3,阿伏加 德罗常数为NA,则晶体中两个最近的X间的距离为
您最近一年使用:0次
解题方法
4 . 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)COCl2的空间构型为______________ ,溴的基态原子价电子排布式为_____________ 。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____________ (填字母)式发生。
A.CsICl2====CsCl+ICl B.CsICl2====CsI+Cl2
(3)根据表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是____ 。
(4)下列分子既不存在“s-p”σ键,也不存在“p-p”π键的是__________ (填字母)。
A.HCl B.HF C.SO2 D.SCl2
(5)已知ClO2-为“V”形,中心氯原子周围有4对价层电子。ClO2-中心氯原子的杂化轨道类型为______________ ,写出一个与CN—互为等电子体的物质的分子式:______________ 。
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示,由此可判断钙的氧化物的化学式为__________ 。已知该氧化物的密度是ρg·cm-3,则晶胞内离得最近的两个钙离子的间距为_________ cm(只要求列算式,不必计算出数值,阿伏加 德罗常数的值为NA)。

(1)COCl2的空间构型为
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列
A.CsICl2====CsCl+ICl B.CsICl2====CsI+Cl2
(3)根据表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是
| 元素 | 氟 | 氯 | 溴 | 碘 |
| 第一电离能/ (kJ·mol-1) | 1681 | 1251 | 1140 | 1008 |
(4)下列分子既不存在“s-p”σ键,也不存在“p-p”π键的是
A.HCl B.HF C.SO2 D.SCl2
(5)已知ClO2-为“V”形,中心氯原子周围有4对价层电子。ClO2-中心氯原子的杂化轨道类型为
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示,由此可判断钙的氧化物的化学式为

您最近一年使用:0次
名校
解题方法
5 . 党的十八大以来,我国在科技创新和重大工程建设方面取得了丰硕成果,在新时代更需要新科技创新世界。2018年3月5日,《自然》连刊两文报道石墨烯超导重大发现,第一作者均为中国科大10级少年班现年仅21岁的曹原。曹原团队在双层石墨烯中发现新的电子态,可以简单实现绝缘体到超导体的转变。石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。


(1)图乙中1号C与相邻C有无形成π键__________ (填“有”、或“无”)。
(2)图甲中1号C的杂化方式________ 。该C与相邻C形成的键角______ (填“>”、“<”或“=”)1200。
(3)我国制墨工艺是将50 nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定,其原因是____________________ 。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为______________ ,该材料的化学式为_______________ 。
(5)金刚石与石墨都是碳的同素异形体。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为___________ (用含π的代数式表示)。
(6)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。

①“可燃冰”中分子间存在的2种作用力是_________ ;
②有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586 nm,结合图表从物质结构及性质的角度分析,该设想能否实现:________ (填“能”、或“否”)。
可燃冰与二氧化碳替换的水合物的熔点较高的是_________ 。


(1)图乙中1号C与相邻C有无形成π键
(2)图甲中1号C的杂化方式
(3)我国制墨工艺是将50 nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定,其原因是
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为
(5)金刚石与石墨都是碳的同素异形体。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为
(6)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。

①“可燃冰”中分子间存在的2种作用力是
②有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586 nm,结合图表从物质结构及性质的角度分析,该设想能否实现:
可燃冰与二氧化碳替换的水合物的熔点较高的是
| 参数 分子 | 分子直径/nm | 分子与H2O的结合能E/(kJ·mol-1) |
| CH4 | 0.436 | 16.40 |
| CO2 | 0.512 | 29.91 |
您最近一年使用:0次
2020-01-21更新
|
369次组卷
|
5卷引用:湖北省荆州中学、宜昌一中等“荆、荆、襄、宜四地七校2020届高三上学期期末考试理综化学试题
湖北省荆州中学、宜昌一中等“荆、荆、襄、宜四地七校2020届高三上学期期末考试理综化学试题山西省临汾市2020届高三第一次模拟理综化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编(已下线)专题6.4 物质结构与性质(选考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)2020届高三《新题速递·化学》2月第01期(考点13-14)
名校
解题方法
6 . 周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)e的基态原子电子排布式为_______ 。
(2)b、c、d的第一电离能由大到小的顺序是_________ (填元素符号)
(3)a和其他元素形成的二元共价化合物中,分子中既含有极性共价键、又含有非极性共价键的化合物是________ (填化学式)。
(4)d与c可以形成两种分子,低价态分子中心原子的杂化方式为_______ 该分子的空间构型为______________
(5)e和c形成的一种离子化合物的晶体结构如图,则该离子化合物的化学式为__________ 。(填元素符号)
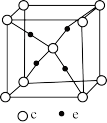
(1)e的基态原子电子排布式为
(2)b、c、d的第一电离能由大到小的顺序是
(3)a和其他元素形成的二元共价化合物中,分子中既含有极性共价键、又含有非极性共价键的化合物是
(4)d与c可以形成两种分子,低价态分子中心原子的杂化方式为
(5)e和c形成的一种离子化合物的晶体结构如图,则该离子化合物的化学式为

您最近一年使用:0次
2019-01-30更新
|
126次组卷
|
2卷引用:湖北省沙市第五中学2020-2021学年高二下学期3月月考化学试题
名校
7 . 2017年4月26日,海军成立68周年时,我国第一艘国产航母成功下水。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+最高能级电子的运动状态有_________ 种,铬元素在周期表中_____ 区。
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如下图所示),其中C原子杂化方式为__________ 杂化。

(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是__________ (填元素符号)
②根据价层电子对互斥理论,预测ClO3-的空间构型为__________ 形,写出一个C1O3-的等电子体的化学符号__________________ 。
③已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_________ HIO4(填“>”“<”或“= ”)
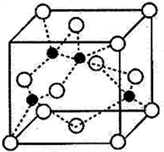
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶体结构如图所示(黑球表示Zn2+,白球表示S2-)。则该晶体中与Zn2+等距且最近的S2-形成的立体图形为______________________ 。已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,该晶体中Zn2+和S2-原子之间的最短距离为体对角线的1/4,则该晶体中S2-和Zn2+之间的最短距离为__________________ pm。(写出计算式即可)
(1)镍铬钢抗腐蚀性能强,Ni2+最高能级电子的运动状态有
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如下图所示),其中C原子杂化方式为

(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
③已知高碘酸有两种形式,化学式分别为H5IO6(
 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶体结构如图所示(黑球表示Zn2+,白球表示S2-)。则该晶体中与Zn2+等距且最近的S2-形成的立体图形为

您最近一年使用:0次
2018-05-01更新
|
362次组卷
|
2卷引用:【全国百强校】湖北省荆州中学2018届高三全真模拟考试(一)理综化学试题
名校
解题方法
8 . 黑火药是我国古代的四大发明之一。黑火药爆炸时发生的反应为:2KNO3+S+3C=K2S+N2↑+3CO2↑。回答下列问题:
(1)基态钾原子的核外电子排布式为____________ ,第一电离能:K______ (填“>”或“<”)Na。
(2)NO3-的空间构型为_____________ 。
(3)固态硫易溶于CS2,熔点为112℃,沸点为444.8℃。其分子结构为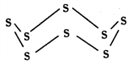 ,S8中硫原子的杂化轨道类型是
,S8中硫原子的杂化轨道类型是____________ ,S8分子中至多有________ 个硫原子处于同一平面。
(4)N2分子中σ键与π键的个数比为________ ,N2的沸点比CO的沸点____ (填“高”或“低”)。
(5)K2S的晶胞结构如图所示。其中K+的配位数为_______ ,S2-的配位数为____ ;若晶胞中距离最近的两个S2-核间距为a cm,则K2S晶体的密度为____ g·cm-3(列出计算式,不必计算出结果)。
(1)基态钾原子的核外电子排布式为
(2)NO3-的空间构型为
(3)固态硫易溶于CS2,熔点为112℃,沸点为444.8℃。其分子结构为
 ,S8中硫原子的杂化轨道类型是
,S8中硫原子的杂化轨道类型是(4)N2分子中σ键与π键的个数比为
(5)K2S的晶胞结构如图所示。其中K+的配位数为

您最近一年使用:0次
2017-08-28更新
|
273次组卷
|
3卷引用:湖北省荆州中学2018届高三第二次月考化学试题
名校
解题方法
9 . 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
试回答下列问题:
⑴写出元素g的基态原子电子排布式______________________ 。
⑵f在空气中燃烧产物的分子构型为____________ ,中心原子的杂化形式为____________ ,该分子是___________ (选填“极性”、“非极性”)分子。
⑶由a原子跟e原子以1 : 1相互交替结合而形成的晶体,晶型与晶体e相同。两者相比熔点更高的是_____________ (填化学式),试从结构角度加以解释______________________ 。
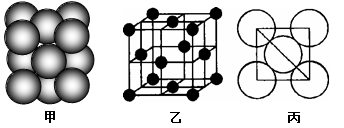
⑷c单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
若已知c的原子半径为d厘米,NA代表阿伏伽德罗常数,c的相对原子质量为M,请回答:
①晶胞中c原子的配位数为_____ ,表示原子空间占有率的代数式为_____________ 。
②该晶体的密度为_____________ g/cm3(用含有关字母的代数式表示),b、h中,与c单质晶体中原子的堆积方式相同的是__________ (填元素符号)。
| a | |||||||||||||||||
| b | c | e | f | ||||||||||||||
| g | h | ||||||||||||||||

试回答下列问题:
⑴写出元素g的基态原子电子排布式
⑵f在空气中燃烧产物的分子构型为
⑶由a原子跟e原子以1 : 1相互交替结合而形成的晶体,晶型与晶体e相同。两者相比熔点更高的是
⑷c单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
若已知c的原子半径为d厘米,NA代表阿伏伽德罗常数,c的相对原子质量为M,请回答:
①晶胞中c原子的配位数为
②该晶体的密度为
您最近一年使用:0次
解题方法
10 . 原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:

(1)W+的电子排布式为_________ ,Y2X2分子中 键与π键数之比为
键与π键数之比为_________ 。
(2)化合物ZX3比YX4易液化,主要原因是______________________ 。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物分子的结构式是_________________ 。
(4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是________________ ;如果该晶体的密度为d g·cm--3,阿伏伽德罗常数为NA,则晶体中两个距离最近的氯离子中心间的距离为_______ cm。
(5)ZX3的VSEPR构型为___________ ,ZF3分子的空间构型为________ ;ZX3容易与W2+形成配离子,但ZF3不易与W2+形成配离子,其原因是______________ 。

(1)W+的电子排布式为
 键与π键数之比为
键与π键数之比为(2)化合物ZX3比YX4易液化,主要原因是
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物分子的结构式是
(4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是
(5)ZX3的VSEPR构型为
您最近一年使用:0次



