解题方法
1 . 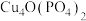 是锂——磷酸氧铜电池正极的活性物质,Fe、Co、Ni性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
是锂——磷酸氧铜电池正极的活性物质,Fe、Co、Ni性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
(1)写出基态Cu的电子排布式:_______ , 的空间结构是
的空间结构是_______ ,P、S、N元素第一电离能由大到小的顺序为_______ 。
(2)天冬酰胺分子结构 ,其中碳原子的杂化方式为
,其中碳原子的杂化方式为_______ ,存在_______ 个手性碳原子,一个分子中含有_______ 个 键,某同学画出基态碳原子的核外电子排布图:
键,某同学画出基态碳原子的核外电子排布图: ,该电子排布图违背了
,该电子排布图违背了_______ 。
(3)Ni在元素周期表中的位置_______ ,基态Ni原子核外能量最高的电子位于_______ 能级,同周期元素中,基态原子未成对电子数与Ni相同的元素名称为_______ 。
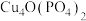 是锂——磷酸氧铜电池正极的活性物质,Fe、Co、Ni性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
是锂——磷酸氧铜电池正极的活性物质,Fe、Co、Ni性质相似,称为铁系元素,主要用于制造合金。回答下列问题:(1)写出基态Cu的电子排布式:
 的空间结构是
的空间结构是(2)天冬酰胺分子结构
 ,其中碳原子的杂化方式为
,其中碳原子的杂化方式为 键,某同学画出基态碳原子的核外电子排布图:
键,某同学画出基态碳原子的核外电子排布图: ,该电子排布图违背了
,该电子排布图违背了(3)Ni在元素周期表中的位置
您最近一年使用:0次
解题方法
2 . 甲醇(CH3OH)是一种用途广泛的基础有机原料和优质燃料。
(1)甲醇可以在铜作催化剂的条件下直接氧化成甲醛(HCHO)
①基态Cu原子的价层电子的轨道表达式为_______ ,其核外电子共占据_______ 个能级。
②甲醇和甲醛中碳原子的杂化方式分别为_______ ,其组成元素的电负性由小到大的顺序为_______ 。
(2)在一定条件下,甲醇(沸点64.7 ℃)可转化为乙酸甲酯(CH3COOCH3,沸点57.1 ℃)。
①乙酸甲酯分子σ键和π的个数之比为_______ 。
②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,工业上用蒸馏的方法分离二者时常先加适量水,理由为_______ 。
(1)甲醇可以在铜作催化剂的条件下直接氧化成甲醛(HCHO)
①基态Cu原子的价层电子的轨道表达式为
②甲醇和甲醛中碳原子的杂化方式分别为
(2)在一定条件下,甲醇(沸点64.7 ℃)可转化为乙酸甲酯(CH3COOCH3,沸点57.1 ℃)。
①乙酸甲酯分子σ键和π的个数之比为
②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,工业上用蒸馏的方法分离二者时常先加适量水,理由为
您最近一年使用:0次
解题方法
3 . 我国政府承诺要在2030年前实现碳达峰, 相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
(1) 催化加氢制取汽油时,
催化加氢制取汽油时, 的转化过程如图1:
的转化过程如图1:
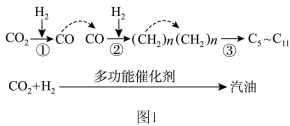
下列对该反应过程的说法正确的是_______ (填标号)。
A.整个反应过程中,有非极性键和极性键的断裂和形成
B. 中C原子的杂化类型为sp
中C原子的杂化类型为sp
C.汽油为纯净物
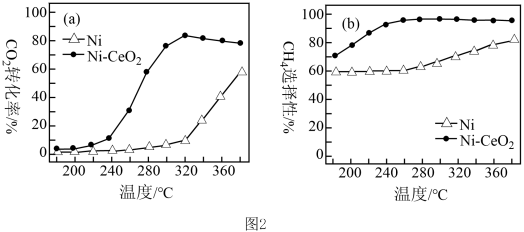
(2)已知 甲烷化技术的反应原理为
甲烷化技术的反应原理为
 ,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得
,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得 转化率和
转化率和 选择性随温度变化的曲线如图2所示。
选择性随温度变化的曲线如图2所示。
①四羰基镍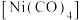 是镍的一种配合物,该配合物中中心原子的配位数为
是镍的一种配合物,该配合物中中心原子的配位数为_______ 。
②以Ni为催化剂,高于320℃后,单位时间内 转化率上升的原因是
转化率上升的原因是_______ ;工业上应选择的催化剂是_______ 。
(3)以 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
Ⅰ.

Ⅱ.

①反应

_______ 。(用含 和
和 的代数式表示)
的代数式表示)
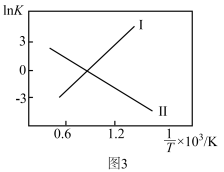
②反应Ⅰ、Ⅱ的 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中
(温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中 的含量将
的含量将_______ (填“增大”、“减小”或“不变”,下同),CO的含量将_______ 。
③某温度下往恒容密闭容器中充入1 mol 和3 mol
和3 mol  ,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的
,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的 ,该反应的压强平衡常数
,该反应的压强平衡常数
_______ (用平衡分压代替平衡浓度,分压=总压 物质的量分数)。
物质的量分数)。
 相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
相关转化的研究对解决环境、能源问题意义重大。回答下列问题:(1)
 催化加氢制取汽油时,
催化加氢制取汽油时, 的转化过程如图1:
的转化过程如图1:
下列对该反应过程的说法正确的是
A.整个反应过程中,有非极性键和极性键的断裂和形成
B.
 中C原子的杂化类型为sp
中C原子的杂化类型为spC.汽油为纯净物
(2)已知
 甲烷化技术的反应原理为
甲烷化技术的反应原理为
 ,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得
,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得 转化率和
转化率和 选择性随温度变化的曲线如图2所示。
选择性随温度变化的曲线如图2所示。
①四羰基镍
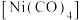 是镍的一种配合物,该配合物中中心原子的配位数为
是镍的一种配合物,该配合物中中心原子的配位数为②以Ni为催化剂,高于320℃后,单位时间内
 转化率上升的原因是
转化率上升的原因是(3)以
 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:Ⅰ.


Ⅱ.


①反应


 和
和 的代数式表示)
的代数式表示)②反应Ⅰ、Ⅱ的
 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中
(温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中 的含量将
的含量将
③某温度下往恒容密闭容器中充入1 mol
 和3 mol
和3 mol  ,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的
,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的 ,该反应的压强平衡常数
,该反应的压强平衡常数
 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
2023-01-02更新
|
366次组卷
|
3卷引用:湖北省十堰市2023届高三元月调研考试化学试题
解题方法
4 . 已知和氮元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y的原子的最外层电子数比内层电子总数少3,它们形成的化合物的分子式是 。试回答:
。试回答:
(1)X元素的基态原子的核外电子排布式为_________ ,Y元素原子价电子排布图(也叫轨道表示式)为_________ 。
(2)X、Y两元素之间形成的化学键为_________ (填“共价键”或“离子键”)。
(3) 的空间结构为
的空间结构为_________ 形,中心原子采取_________ 杂化,分子为_________ (填“极性分子”或“非极性分子”)。
(4) 的沸点与
的沸点与 比较:
比较:_________ (填化学式)的高,原因_________ 。
 。试回答:
。试回答:(1)X元素的基态原子的核外电子排布式为
(2)X、Y两元素之间形成的化学键为
(3)
 的空间结构为
的空间结构为(4)
 的沸点与
的沸点与 比较:
比较:
您最近一年使用:0次
名校
解题方法
5 . 氮化铬常用于薄膜涂层,是一种良好的耐磨材料,同时在超级电容器领域有良好的应用前景。工业上以铬铁矿( )为原料,经过一系列反应,制备氮化铬和铬单质的工艺流程如图:
)为原料,经过一系列反应,制备氮化铬和铬单质的工艺流程如图:
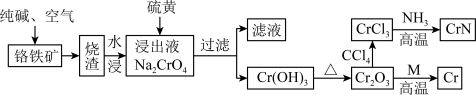
(1)基态铬原子核外有_______ 种能量不同的电子,其最外层电子的电子云轮廓图为_______ 。
(2)M是短周期金属元素,M的部分电离能数据如表所示:
则M是_______ (填元素符号)。
(3)制备 时,发生的主要反应为
时,发生的主要反应为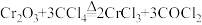 。
。
① 分子中碳原子的杂化方式为
分子中碳原子的杂化方式为_______ , 分子的空间结构是
分子的空间结构是_______ 。
② 溶于水得到配合物-------氯化二氯四水合铬(Ⅲ){
溶于水得到配合物-------氯化二氯四水合铬(Ⅲ){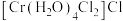 },其中提供电子对形成配位键的原子是
},其中提供电子对形成配位键的原子是_______ ,中心离子配位数为_______ 。
③ 的熔点(83℃)比
的熔点(83℃)比 的熔点(1100℃)低得多,这是由于
的熔点(1100℃)低得多,这是由于_______ 。
 )为原料,经过一系列反应,制备氮化铬和铬单质的工艺流程如图:
)为原料,经过一系列反应,制备氮化铬和铬单质的工艺流程如图:
(1)基态铬原子核外有
(2)M是短周期金属元素,M的部分电离能数据如表所示:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/(kJ/mol) | 578 | 1817 | 2745 | 11575 | 14830 |
(3)制备
 时,发生的主要反应为
时,发生的主要反应为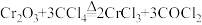 。
。①
 分子中碳原子的杂化方式为
分子中碳原子的杂化方式为 分子的空间结构是
分子的空间结构是②
 溶于水得到配合物-------氯化二氯四水合铬(Ⅲ){
溶于水得到配合物-------氯化二氯四水合铬(Ⅲ){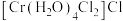 },其中提供电子对形成配位键的原子是
},其中提供电子对形成配位键的原子是③
 的熔点(83℃)比
的熔点(83℃)比 的熔点(1100℃)低得多,这是由于
的熔点(1100℃)低得多,这是由于
您最近一年使用:0次
2022-06-28更新
|
106次组卷
|
3卷引用:湖北省十堰市2021-2022学年高二下学期期末调研考试化学试题
名校
解题方法
6 . 2020年9月,中山大学张伟雄教授课题组光响应分子铁电体取得重要进展,某些晶体在一定的温度范围内可以自发极化,而且其自发极化方向可以因外电场方向的反向而反向,晶体的这种性质称为铁电性,具有铁电性的晶体称为铁电体。NaNO2、KH2PO4、BaTiO3晶体均属于铁电体。
(1)K元素处于周期表的_______ 区,NaNO2中阴离子的空间构型为_______ 。
(2)将TiO2与BaCO3加热熔融可制得BaTiO3,TiO2中Ti的离子结构示意图为_______ 。BaTiO3晶体灼烧时,钡元素的焰色是_______ 色。
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。EDTA(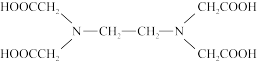 )与Ba2+形成的螯合物结构如图所示,该螯合物中采取sp3杂化的原子有
)与Ba2+形成的螯合物结构如图所示,该螯合物中采取sp3杂化的原子有_______ ,1 mol该螯合物中通过螯合作用形成的配位键数目为_______ 。
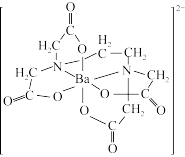
(4)KH2PO4的晶胞结构如图所示。
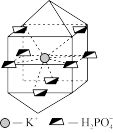
①KH2PO4中阴离子的配位数为_______ 。
②若该晶胞的体积为V nm3,则该KH2PO4晶体的密度为_______ g/cm3。(用含有NA的代数式表示)
(1)K元素处于周期表的
(2)将TiO2与BaCO3加热熔融可制得BaTiO3,TiO2中Ti的离子结构示意图为
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。EDTA(
 )与Ba2+形成的螯合物结构如图所示,该螯合物中采取sp3杂化的原子有
)与Ba2+形成的螯合物结构如图所示,该螯合物中采取sp3杂化的原子有
(4)KH2PO4的晶胞结构如图所示。

①KH2PO4中阴离子的配位数为
②若该晶胞的体积为V nm3,则该KH2PO4晶体的密度为
您最近一年使用:0次
解题方法
7 . 含Ni、As元素的物质在生产生活中有重要的用途。回答下列问题:
(1)基态Ni2+核外电子排布式为________ 。
(2)AsCl3分子的立体构型为________ 。
(3)某个Ni(Ⅱ)有机配合物的结构如图所示:
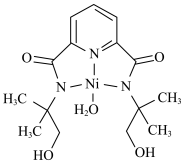
①该分子中N原子的杂化方式为________ 、________ 。
②请在图中用“→”标出Ni2+的配位键______ 。
(4)Ge,As,Se元素处于同一周期,三种元素原子的第一电离能由大到小的顺序为________ 。
(5) 的酸性强于
的酸性强于 的原因是
的原因是______ ,AsH3的键角小于NH3的原因是________ 。
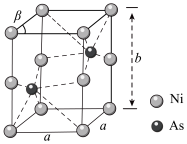
(6)如图为Ni和As形成的某种晶体的六方晶胞图,该化合物的化学式为________ ,已知晶胞参数分别为apm、apm、bpm和β=60°,则该晶胞的密度为________  (设阿伏加 德罗常数的值为NA)
(设阿伏加 德罗常数的值为NA)
(1)基态Ni2+核外电子排布式为
(2)AsCl3分子的立体构型为
(3)某个Ni(Ⅱ)有机配合物的结构如图所示:

①该分子中N原子的杂化方式为
②请在图中用“→”标出Ni2+的配位键
(4)Ge,As,Se元素处于同一周期,三种元素原子的第一电离能由大到小的顺序为
(5)
 的酸性强于
的酸性强于 的原因是
的原因是(6)如图为Ni和As形成的某种晶体的六方晶胞图,该化合物的化学式为
 (设阿伏加 德罗常数的值为NA)
(设阿伏加 德罗常数的值为NA)
您最近一年使用:0次
名校
解题方法
8 . 亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝) +3KCl,回答问题:
(1)写出基态Fe3+的核外电子排布式_________ 。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有______ 和________ 。含有12mol σ键的K4[Fe(CN)6的物质的量为________ mol。
(3)黄血盐中N原子的杂化方式为______ ;C、N、O的第一电离能由大到小的排序为_____ ,电负性由大到小的排序为________ 。
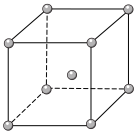
(4)Fe、Na、K的晶体结构如图所示:
① 钠的熔点比钾更高,原因是__________________________ 。
② Fe原子半径是r cm,阿伏加 德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______ g/cm3。
(1)写出基态Fe3+的核外电子排布式
(2)K4[Fe(CN)6]中的作用力除共价键外,还有
(3)黄血盐中N原子的杂化方式为
(4)Fe、Na、K的晶体结构如图所示:

① 钠的熔点比钾更高,原因是
② Fe原子半径是r cm,阿伏加 德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是
您最近一年使用:0次
2020-01-12更新
|
1072次组卷
|
6卷引用:湖北省竹溪一中、竹山一中、房县一中三校2019-2020学年高二下学期7月联考化学试题
名校
解题方法
9 . 2019年诺贝尔化学奖由来自美、英、日的三人分获,以表彰他们在锂离子电池研究方面做出的贡献,他们最早发明用LiCoO2作离子电池的正极,用聚乙炔作负极。回答下列问题:
(1)基态Co原子价电子排布图为______________ (轨道表达式)。第四电离能I4(Co)比I4(Fe)小,是因为_____________________ 。
(2)LiCl的熔点(605℃)比LiF的熔点(848℃)低,其原因是_________________________ .
(3)乙炔(C2H2)分子中δ键与π键的数目之比为_______________ 。
(4)锂离子电池的导电盐有LiBF4等,碳酸亚乙酯(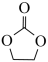 )是一种锂离子电池电解液的添加剂。
)是一种锂离子电池电解液的添加剂。
①LiBF4中阴离子的空间构型是___________ ;与该阴离子互为等电子体的分子有_____________ 。(列一种)
②碳酸亚乙酯分子中碳原子的杂化方式有_______________________ 。
(5)Li2S是目前正在开发的锂离子电池的新型固体电解质,其晶胞结构如图所示,已知晶胞参数a=588pm。
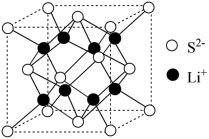
①S2-的配位数为______________ 。
②设NA为阿伏加 德罗常数的值,Li2S的晶胞密度为____________ (列出计算式) 。
。
(1)基态Co原子价电子排布图为
(2)LiCl的熔点(605℃)比LiF的熔点(848℃)低,其原因是
(3)乙炔(C2H2)分子中δ键与π键的数目之比为
(4)锂离子电池的导电盐有LiBF4等,碳酸亚乙酯(
 )是一种锂离子电池电解液的添加剂。
)是一种锂离子电池电解液的添加剂。①LiBF4中阴离子的空间构型是
②碳酸亚乙酯分子中碳原子的杂化方式有
(5)Li2S是目前正在开发的锂离子电池的新型固体电解质,其晶胞结构如图所示,已知晶胞参数a=588pm。

①S2-的配位数为
②设NA为阿伏加 德罗常数的值,Li2S的晶胞密度为
 。
。
您最近一年使用:0次
2020-01-09更新
|
588次组卷
|
6卷引用:2019年湖北省十堰市高三元月调研考试理综化学试题
2019年湖北省十堰市高三元月调研考试理综化学试题云南省昆明市第一中学2020届高三上学期12月月考理综试卷化学试题河北省邢台市2020届高三上学期第四次月考化学试题河南省驻马店市2020届高三上学期期末统一考试化学试题海南省2020届高三下学期新高考线上诊断性测试化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编
名校
解题方法
10 . 钒和镍及其化合物是重要合金材料和催化剂,其储氨合金可作为一种新型锌离子电池的负极材料,该电池以Zn(Cl3SO3)2为电解质,以有缺陷的阳离子型ZnMn2O4为电极,成功获得了稳定的大功率电流。
(1)基态钒原子的核外电子排布式为___________ ,其排布时能量最高电子所占据能级的原子轨道有___ 个伸展方向。
(2)VO2+可与多种物质形成配合物,与氧同周期且第一电离能比氧大的主族元素有__________ (写元素符号)。
(3)镍形成的配离子[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子的空间构型为_________________ ,与CN-互为等电体的一种分子的化学式为_____________________ 。
(4)三氟甲磺酸(CF3SO3H)是一种有机强酸,结构式如图1所示,通常以CS2、IF3、H2O2等为主要原料来制取。
①H2O2分子中O原子的杂化方式为___________________________ 。
②三氟甲磺酸能与碘苯反应生成三氟甲磺酸苯酯和碘化氢。1个三氟甲磺酸苯酯分子中含有σ键的数目为____________________ 。
(5)硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图2所示,该晶胞中S2-的配位数为__ 。



(6)镧镍合金是重要储氢材料,其储氢后的晶胞如图3所示。
①储氢前该镧镍合金的化学式为_______________ 。
②该镧镍合金储氢后氢气的密度为_______ (用NA表示阿伏伽德罗常数的数值)g·cm-3。
(1)基态钒原子的核外电子排布式为
(2)VO2+可与多种物质形成配合物,与氧同周期且第一电离能比氧大的主族元素有
(3)镍形成的配离子[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子的空间构型为
(4)三氟甲磺酸(CF3SO3H)是一种有机强酸,结构式如图1所示,通常以CS2、IF3、H2O2等为主要原料来制取。
①H2O2分子中O原子的杂化方式为
②三氟甲磺酸能与碘苯反应生成三氟甲磺酸苯酯和碘化氢。1个三氟甲磺酸苯酯分子中含有σ键的数目为
(5)硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图2所示,该晶胞中S2-的配位数为



(6)镧镍合金是重要储氢材料,其储氢后的晶胞如图3所示。
①储氢前该镧镍合金的化学式为
②该镧镍合金储氢后氢气的密度为
您最近一年使用:0次
2018-02-05更新
|
620次组卷
|
5卷引用:湖北省十堰市2018届高三元月调研考试理综化学试题



