名校
1 . 《化学世界》刊载了我国科学家的研究成果:在钴锰氧化物 的催化作用下,偶氮桥联二呋咱高能炸药也可作固体火箭推进剂,M是合成该推进剂的中间体,M的结构简式如图所示。回答下列问题:
的催化作用下,偶氮桥联二呋咱高能炸药也可作固体火箭推进剂,M是合成该推进剂的中间体,M的结构简式如图所示。回答下列问题:

(1)中间体M分子中,碳原子的杂化类型是___________ 。
(2)Co和Ni都属于第Ⅷ族元素,均能与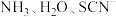 等配体组成配合物。
等配体组成配合物。
①一种Ni2+配离子的结构如图所示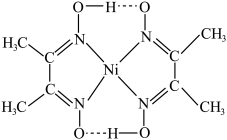 ,该配离子中存在的化学键类型有
,该配离子中存在的化学键类型有___________ (填标号)。
A.离子键B.σ键C.π键D.氢键E.配位键
②SCN-与金属离子形成的配合物中配位原子一般是S而不是N,其原因是___________ 。
(3)比较熔点大小:CoO___________ MnO(填“<”,“=”或“>”)
(4)KMnF3晶体有钻钛矿型的立方结构,晶胞结构如图1所示。
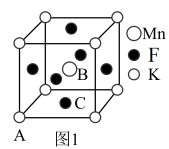
①若原子坐标参数A为(0,0,0);B为(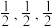 ),则C原子的坐标参数为
),则C原子的坐标参数为___________ 。
②若阿伏加德罗常数的值为NA,晶胞参数为anm,则晶体密度为___________ g∙cm-3。
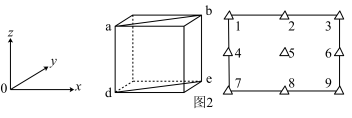
③在KMnF3晶胞结构的另一种表示中,Mn处于各顶角位置。该晶胞结构中,沿立方格子对角面取得的截图如图2所示。F在晶胞中的位置为___________ (填阿拉伯数字序号)。
 的催化作用下,偶氮桥联二呋咱高能炸药也可作固体火箭推进剂,M是合成该推进剂的中间体,M的结构简式如图所示。回答下列问题:
的催化作用下,偶氮桥联二呋咱高能炸药也可作固体火箭推进剂,M是合成该推进剂的中间体,M的结构简式如图所示。回答下列问题:
(1)中间体M分子中,碳原子的杂化类型是
(2)Co和Ni都属于第Ⅷ族元素,均能与
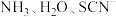 等配体组成配合物。
等配体组成配合物。①一种Ni2+配离子的结构如图所示
 ,该配离子中存在的化学键类型有
,该配离子中存在的化学键类型有A.离子键B.σ键C.π键D.氢键E.配位键
②SCN-与金属离子形成的配合物中配位原子一般是S而不是N,其原因是
(3)比较熔点大小:CoO
(4)KMnF3晶体有钻钛矿型的立方结构,晶胞结构如图1所示。

①若原子坐标参数A为(0,0,0);B为(
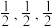 ),则C原子的坐标参数为
),则C原子的坐标参数为②若阿伏加德罗常数的值为NA,晶胞参数为anm,则晶体密度为
③在KMnF3晶胞结构的另一种表示中,Mn处于各顶角位置。该晶胞结构中,沿立方格子对角面取得的截图如图2所示。F在晶胞中的位置为

您最近一年使用:0次
2 . 据报道,我国化学研究人员用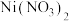 和
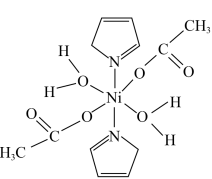
和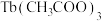 等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。
等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。
请回答下列问题:
(1)基态 原子的价电子排布式为
原子的价电子排布式为_______ , 在元素周期表中的位置是
在元素周期表中的位置是_______ 。
(2)C、N、O三种元素第一电离能最大的是_______ (填元素符号)。
(3)镍的一维链状配位聚合物中,碳原子的杂化方式为_______ 。已知: 的沸点为117.9℃,
的沸点为117.9℃,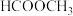 的沸点为32℃。
的沸点为32℃。 的沸点高于
的沸点高于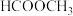 的沸点的主要原因是
的沸点的主要原因是_______ 。
(4)氧化镍的晶胞结构如图所示。若 为阿伏加德罗常数的值,晶胞中最近的
为阿伏加德罗常数的值,晶胞中最近的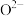 之间的距离为anm,则氧化镍的密度为
之间的距离为anm,则氧化镍的密度为_______ 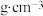 。
。

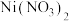 和
和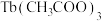 等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。
等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。
请回答下列问题:
(1)基态
 原子的价电子排布式为
原子的价电子排布式为 在元素周期表中的位置是
在元素周期表中的位置是(2)C、N、O三种元素第一电离能最大的是
(3)镍的一维链状配位聚合物中,碳原子的杂化方式为
 的沸点为117.9℃,
的沸点为117.9℃,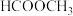 的沸点为32℃。
的沸点为32℃。 的沸点高于
的沸点高于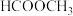 的沸点的主要原因是
的沸点的主要原因是(4)氧化镍的晶胞结构如图所示。若
 为阿伏加德罗常数的值,晶胞中最近的
为阿伏加德罗常数的值,晶胞中最近的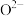 之间的距离为anm,则氧化镍的密度为
之间的距离为anm,则氧化镍的密度为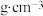 。
。
您最近一年使用:0次
3 . 金属钛(Ti)被誉为“21世纪金属”,具有良好的生物相容性,它兼具铁的高强度和铝的低密度。其单质和化合物具有广泛的应用价值。氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2(如图)。

图中的M是短周期金属元素,M的部分电离能如下表所示:
请回答下列问题:
(1)Ti的基态原子外围电子排布式为___________ 。
(2)纳米TiO2是一种应用广泛的催化剂,用纳米TiO2催化的反应实例如图所示。化合物甲的分子中采取sp2方式杂化的碳原子有___________ 个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为___________ 。

(3)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为___________ g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。该晶体中与N原子距离相等且最近的N原子有___________ 个。
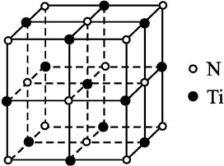

图中的M是短周期金属元素,M的部分电离能如下表所示:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/(kJ·mol-1) | 738 | 1451 | 7733 | 10540 | 13630 |
(1)Ti的基态原子外围电子排布式为
(2)纳米TiO2是一种应用广泛的催化剂,用纳米TiO2催化的反应实例如图所示。化合物甲的分子中采取sp2方式杂化的碳原子有

(3)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为

您最近一年使用:0次
名校
4 . 结合所学知识回答问题:
(1)碳和硅及其化合物具有广泛的用途
①下列碳原子最外层电子排布图表示的状态中,能量最低的是____ ;
A.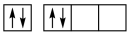 B.
B.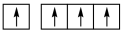 C.
C.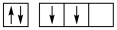 D.
D.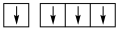
②60克SiO2晶体中含有的Si-O键数目为____ (用NA表示);
③有机物M(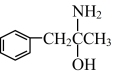 )中碳的杂化类型有
)中碳的杂化类型有____ 杂化。
(2)某一元素的逐级电离能(kJ/mol)数据如下:
该元素原子最外层电子数是____ 。
(3)氮元素能能形成多种化合物。
①肼( )分子中孤电子对数与σ键的数目之比为
)分子中孤电子对数与σ键的数目之比为____
②正硝酸钠( )为白色晶体,是一种重要的化工原料,其中
)为白色晶体,是一种重要的化工原料,其中 离子的空间构型为
离子的空间构型为_____ ,写出一种与其互为等电子体的分子____ (填化学式)。
③铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,其化学式为____ 。若两个最近的 原子间的距离为
原子间的距离为 ,则该晶体的密度是
,则该晶体的密度是___  (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 )。
)。
(1)碳和硅及其化合物具有广泛的用途
①下列碳原子最外层电子排布图表示的状态中,能量最低的是
A.
 B.
B. C.
C. D.
D.
②60克SiO2晶体中含有的Si-O键数目为
③有机物M(
 )中碳的杂化类型有
)中碳的杂化类型有(2)某一元素的逐级电离能(kJ/mol)数据如下:
| 第一电离能 | 第二电离能 | 第三电离能 | 第四电离能 | 第五电离能 |
800 6 6 | 2427.1 | 3659.7 | 25025.8 | 32826.7 |
该元素原子最外层电子数是
(3)氮元素能能形成多种化合物。
①肼(
 )分子中孤电子对数与σ键的数目之比为
)分子中孤电子对数与σ键的数目之比为②正硝酸钠(
 )为白色晶体,是一种重要的化工原料,其中
)为白色晶体,是一种重要的化工原料,其中 离子的空间构型为
离子的空间构型为③铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,其化学式为
 原子间的距离为
原子间的距离为 ,则该晶体的密度是
,则该晶体的密度是 (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
解题方法
5 . 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________ 。
②Fe的基态原子共有________ 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是____________________ (用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为________ ,中心原子的杂化方式为________ 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO________ (填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
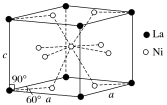
①该晶体的化学式为________________ 。
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511pm,c=397pm;标准状况下氢气的密度为8.98×10-5g·cm-3;储氢能力= 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为________ 。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为
②Fe的基态原子共有
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511pm,c=397pm;标准状况下氢气的密度为8.98×10-5g·cm-3;储氢能力=
 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
您最近一年使用:0次
2020-11-12更新
|
346次组卷
|
13卷引用:2016届湖北省襄阳五中高三5月模拟三理综化学试卷
2016届湖北省襄阳五中高三5月模拟三理综化学试卷2016届河北省晋州一中高三上学期期末理综化学试卷2016届安徽省安庆一中高三热身考试理综化学试卷2017届安徽省黄山市屯溪一中高三上月考二化学卷四川省内江市2017届高三第五次模拟考试理综化学试题陕西省师范大学附属中学2017届高三下学期第十一次模考理综化学试题苏教版2017届高三单元精练检测十一化学试题湖北省孝感市八校2018届高三上学期期末考试理综化学试题(已下线)2018年6月1日 押高考化学第35题(2)——《每日一题》2018年高三化学四轮复习(已下线)解密21 物质的结构与性质(教师版)——备战2018年高考化学之高频考点解密(已下线)2019年5月31日《每日一题》四轮复习—— 押高考化学第35题(2)四川省成都附属实验中学2021届高三上学期11月月考理科综合化学试题(已下线)第三单元 物质的聚集状态性质与物质性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)
名校
解题方法
6 . 第四周期元素Q位于ds区,最外层电子半充满;短周期元素W、X、Y、Z第一电离能与原子序数的关系如图所示,请回答下列问题(用Q、W、X、Y、Z所对应的元素符号作答):

(1)X、W组成的一种二元化合物常用作火箭燃料,该化合物中X原子的杂化方式为___________ 。
(2)X2Y曾被用作麻醉剂,根据“等电子体原理”预测X2Y的空间构型为______________ 。
(3)Q与X形成的一种二元化合物的立方晶胞结构如图所示:

Q原子周围距其距离最近的Q原子的数目为_______ (阿拉伯数字表示)。
(4)已知单质Q晶体的堆积方式为面心立方最密堆积,则单质Q晶体的晶胞中原子的空间利用率为_________________ (用含π的式子表示)。

(1)X、W组成的一种二元化合物常用作火箭燃料,该化合物中X原子的杂化方式为
(2)X2Y曾被用作麻醉剂,根据“等电子体原理”预测X2Y的空间构型为
(3)Q与X形成的一种二元化合物的立方晶胞结构如图所示:

Q原子周围距其距离最近的Q原子的数目为
(4)已知单质Q晶体的堆积方式为面心立方最密堆积,则单质Q晶体的晶胞中原子的空间利用率为
您最近一年使用:0次
名校
解题方法
7 . 氟及其化合物用途十分广泛,回答下列问题:
(1)氟化物OF2、NF3、SiF4、PF5、SF6中,中心原子采取sp3杂化的是__ 。
(2)[H2F]+[SbF6]-(氟锑酸)是一种超强酸。锑的价电子排布式为__ 。阳离子[H2F]+的空间构型为__ ,写出[H2F]+的等电子体__ (分子和离子各举一例)。
(3)SF6被广泛用于高压电器设备的绝缘介质。根据__ 理论,可判断出其空间构型为正八面体。SF6的键能可通过类似Born-Haber循环能量构建能量图(图甲)计算键能,则S-F的键能为___ kJ•mol-1。

(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3[AlF6]降低Al2O3的熔点。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Na3[AlF6]+3CO2↑+9H2O。
①测定气态HF的摩尔质量时,往往得不到20g•mol-1的数据,原因是__ 。
②冰晶石的晶体不导电,但熔融时能导电,则在冰晶石晶体中存在__ (填序号)。
a.离子键 b.极性键 c.配位键 d.范德华力
③反应物中元素(氢除外)的第一电离能从大到小的顺序为__ (用元素符号表示)。
④工业上不用电解熔点更低的AlCl3制取铝的原因为__ 。
⑤冰晶石由两种微粒构成,冰晶石的晶胞结构如图乙所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是__ (填具体的微粒符号)。

(1)氟化物OF2、NF3、SiF4、PF5、SF6中,中心原子采取sp3杂化的是
(2)[H2F]+[SbF6]-(氟锑酸)是一种超强酸。锑的价电子排布式为
(3)SF6被广泛用于高压电器设备的绝缘介质。根据

(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3[AlF6]降低Al2O3的熔点。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Na3[AlF6]+3CO2↑+9H2O。
①测定气态HF的摩尔质量时,往往得不到20g•mol-1的数据,原因是
②冰晶石的晶体不导电,但熔融时能导电,则在冰晶石晶体中存在
a.离子键 b.极性键 c.配位键 d.范德华力
③反应物中元素(氢除外)的第一电离能从大到小的顺序为
④工业上不用电解熔点更低的AlCl3制取铝的原因为
⑤冰晶石由两种微粒构成,冰晶石的晶胞结构如图乙所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是

您最近一年使用:0次
解题方法
8 . 氟及其化合物用途十分广泛,回答下列问题
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序的独特晶体,可通过_____ 方法区分晶体、准晶体和非晶体。
(2)基态铜原子价电子排布的轨道式为_____ 。
(3)[H2F] + [SbF6] -(氟锑酸)是一种超强酸,其阳离子的空间构型为_____ ,与[H2F] +具有相同空间构型和键合形式的分子和阴离子分别是 ____ 。(各举一例)
(4)SF6中含____ 个σ键,根据____ 理论,可判断出其空间构型为正八面体,其中S的杂化方式为_____ 。
(5)SF6被广泛用于高压电器设备的绝缘介质。其键能可通过类似于Born-Haber循环能量构建能量图a计算键能。则F-F键的键能为_____ kJ·mol-1。


(6)CuCl 熔点为 426℃,熔化时几乎不导电;CuF 的熔点是 908℃,密度为 7.1g·cm-3。
①CuF的熔点比CuCl高的原因是_____ 。
②已知NA为阿伏加 德罗常数的值,立方CuF晶胞结构如图b,则CuF的晶胞参数a=____ nm。(列出计算式即可)
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序的独特晶体,可通过
(2)基态铜原子价电子排布的轨道式为
(3)[H2F] + [SbF6] -(氟锑酸)是一种超强酸,其阳离子的空间构型为
(4)SF6中含
(5)SF6被广泛用于高压电器设备的绝缘介质。其键能可通过类似于Born-Haber循环能量构建能量图a计算键能。则F-F键的键能为


(6)CuCl 熔点为 426℃,熔化时几乎不导电;CuF 的熔点是 908℃,密度为 7.1g·cm-3。
①CuF的熔点比CuCl高的原因是
②已知NA为阿伏加 德罗常数的值,立方CuF晶胞结构如图b,则CuF的晶胞参数a=
您最近一年使用:0次
名校
解题方法
9 . 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于第四周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,C位于s区且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且位于同一族原子序数相差为2。
(1)六种元素中第一电离能最小的是__________ (填元素符号,下同),电负性最大的是__________ 。
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式__________ ,1 mol AB+中含有π键的数目为____________ ,黄血盐晶体中各种微粒间的作用力不涉及__________ (填序号)。
a.离子键 b.共价键 c.配位键
d.金属键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为____________ ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③ 、④HCHO。其中碳原子采取sp2杂化的分子有
、④HCHO。其中碳原子采取sp2杂化的分子有____________ (填物质序号),HCHO分子的立体结构为____________ ,它与氢气的加成产物熔、沸点比CH4的熔、沸点高,其主要原因是______________________________________ (须指明加成产物是何物质)。
(1)六种元素中第一电离能最小的是
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式
a.离子键 b.共价键 c.配位键
d.金属键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为
 、④HCHO。其中碳原子采取sp2杂化的分子有
、④HCHO。其中碳原子采取sp2杂化的分子有
您最近一年使用:0次
10 . 四川含有丰富的矿产资源,钒矿、硫铁矿、铜矿等七种矿产储量位居全国前列。回答下列问题:
(1)钒在元素周期表中的位置为_________ ,V3+的价电子排布图为_____________ 。
(2)钒的某种氧化物的晶胞结构如图1所示,其晶体的化学式为_____
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中键角______ 120°(填“>”、“<”或“=”); SO3的三聚体环状结构如图2所示,该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为__ (填图2中字母),该分子中含有__ 个σ键。
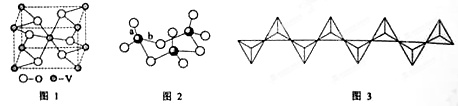
(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为___ ,例举与VO43-空间构型相同的一种阳离子和一种阴离子___________ (填化学式);也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为___ 。
(5)硫能形成很多种含氧酸,如H2SO3、H2SO4。硫的某种含氧酸分子式为H2S2O7,属于二元酸,已知其结构中所有原子都达到稳定结构,且不存在非极性键,试写出其结构式________ (配位键须注明)。
(6)利用铜萃取剂M,通过如下反应实现铜离子的富集:
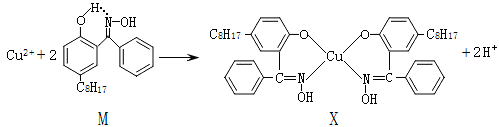
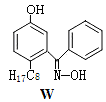
M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是____
(1)钒在元素周期表中的位置为
(2)钒的某种氧化物的晶胞结构如图1所示,其晶体的化学式为
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中键角

(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为
(5)硫能形成很多种含氧酸,如H2SO3、H2SO4。硫的某种含氧酸分子式为H2S2O7,属于二元酸,已知其结构中所有原子都达到稳定结构,且不存在非极性键,试写出其结构式
(6)利用铜萃取剂M,通过如下反应实现铜离子的富集:


M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是
您最近一年使用:0次



