1 . 铁及其化合物有着广泛的用途,氧化铁可用作颜料,氮化铁用于硬磁和软磁性材料、信息记录材料、磁性密封液等。
(1)氮化铁晶体的晶胞结构如图所示。该晶体中铁、氮的微粒个数之比为_______ 。

(2)氧化亚铁晶体的晶胞如图所示。氧化亚铁晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____ 。

(1)氮化铁晶体的晶胞结构如图所示。该晶体中铁、氮的微粒个数之比为

(2)氧化亚铁晶体的晶胞如图所示。氧化亚铁晶胞中,与Fe2+紧邻且等距离的Fe2+数目为

您最近一年使用:0次
2 . 碳族元素中的碳、硅、锗、铅及其化合物在诸多领域有重要用途。下列说法正确的是
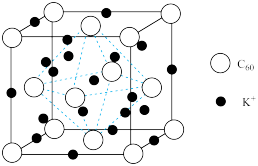

| A.一种超导体晶胞如图所示,1个晶胞中含有240个C原子 |
| B.硅是重要的半导体材料,可制成二极管、三极管和光导纤维 |
C.基态锗(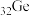 )原子外围电子排布式为 )原子外围电子排布式为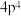 |
D.铅蓄电池放电时的负极反应为: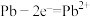 |
您最近一年使用:0次
解题方法
3 . 氮元素与氢元素能形成多种化合物,在工业、农业和国防等方面用途非常广泛,例如:氨气、肼(N2H4)、叠氮酸(HN3)……等,请回答下列问题:
(1)N位于周期表中____ 区,基态N原子的价电子排布式为____ 。
(2)N2H4分子的电子式为____ ,其中N采取____ 杂化。
(3)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N 。请写出一种与N
。请写出一种与N 互为等电子体的分子的化学式
互为等电子体的分子的化学式____ ;叠氮化物易与过渡金属元素形成配合物,如:[Fe(N3)(NH3)5]SO4,在该配合物中Fe的配位数为____ ,SO 的立体构型为
的立体构型为____ 。
(4)已知Zn2+能与氨分子形成配离子[Zn(NH3)4]2+,1mol该离子含有σ键的数目为____ 。
(5)氮与铝形成的某种晶体的晶胞如图所示。
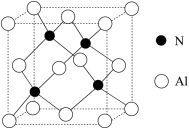
①该晶体的化学式为____ 。
②已知该晶体的密度为dg·cm−3,N和Al的半径分别为apm和bpm,阿伏加德罗常数值为NA。用含a、b、d和NA的式子表示该晶体中原子的空间利用率____ (用含a、b、d和NA的式子表示)。
(1)N位于周期表中
(2)N2H4分子的电子式为
(3)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N
 。请写出一种与N
。请写出一种与N 互为等电子体的分子的化学式
互为等电子体的分子的化学式 的立体构型为
的立体构型为(4)已知Zn2+能与氨分子形成配离子[Zn(NH3)4]2+,1mol该离子含有σ键的数目为
(5)氮与铝形成的某种晶体的晶胞如图所示。

①该晶体的化学式为
②已知该晶体的密度为dg·cm−3,N和Al的半径分别为apm和bpm,阿伏加德罗常数值为NA。用含a、b、d和NA的式子表示该晶体中原子的空间利用率
您最近一年使用:0次
名校
解题方法
4 . 铜及其化合物在科学研究和工业生产中具有许多用途。回答下列问题:
(1) 中阳离子的基态核外电子排布式为
中阳离子的基态核外电子排布式为___________ ;Cu和Ni在元素周期表中的位置相邻,Ni在元素周期表中的位置是___________ 。
(2)将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体 。乙醇分子中C原子的杂化轨道类型为
。乙醇分子中C原子的杂化轨道类型为___________ ; 能与
能与 以配位键形成
以配位键形成 ,则
,则 的空间构型是
的空间构型是___________ 。 中存在的化学键除了极性共价键外,还有
中存在的化学键除了极性共价键外,还有___________ 。 极易溶于水的原因主要有两个,一是
极易溶于水的原因主要有两个,一是___________ ,二是___________ 。
(3) 溶液中加入过量KCN溶液能生成配离子
溶液中加入过量KCN溶液能生成配离子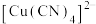 ,1mol
,1mol  中含有的
中含有的 键数目为
键数目为___________ ,与 互为等电子体的离子有
互为等电子体的离子有___________ 写出一种即可。
(4)已知ZnS的晶胞如图所示, 的配位数为
的配位数为___________ 。若晶体密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞参数为
,则晶胞参数为___________ (用含 、
、 的代数式表示)nm。
的代数式表示)nm。

(1)
 中阳离子的基态核外电子排布式为
中阳离子的基态核外电子排布式为(2)将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体
 。乙醇分子中C原子的杂化轨道类型为
。乙醇分子中C原子的杂化轨道类型为 能与
能与 以配位键形成
以配位键形成 ,则
,则 的空间构型是
的空间构型是 中存在的化学键除了极性共价键外,还有
中存在的化学键除了极性共价键外,还有 极易溶于水的原因主要有两个,一是
极易溶于水的原因主要有两个,一是(3)
 溶液中加入过量KCN溶液能生成配离子
溶液中加入过量KCN溶液能生成配离子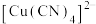 ,1mol
,1mol  中含有的
中含有的 键数目为
键数目为 互为等电子体的离子有
互为等电子体的离子有(4)已知ZnS的晶胞如图所示,
 的配位数为
的配位数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞参数为
,则晶胞参数为 、
、 的代数式表示)nm。
的代数式表示)nm。
您最近一年使用:0次
名校
解题方法
5 . 锡、铬、钴、铜等金属及其化合物在工业上有重要用途。
(1)锡合金具有优异的抗蚀性能,可以用来生产制作各种精美合金饰品。
①基态Sn原子价层电子排布为_______
②Co元素在元素周期表中的位置是_______
③Cu元素位于元素周期表的_______ 区
(2)制备CrO2Cl2的反应为K2Cr2O7 + 3CCl4 = 2KCl + 2CrO2Cl2 + 3COCl2↑
①上述方程式中非金属元素电负性由小到大的顺序为_______ (用元素符号表示)。
②COCl2分子中π键和σ键的个数比为_______ ,中心原子的杂化方式为_______ ,COCl2属于_______ 分子(填“极性”或“非极性”)。
(3)Cu−Mn−Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:
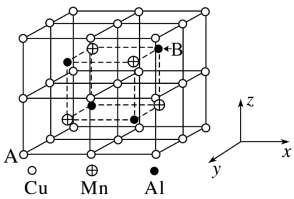
①合金的化学式为_______ 。
②A原子坐标参数为(0,1,0),则B原子坐标参数为_______ 。
③已知该合金晶体密度为ρg·cm-3,则两个Al原子间的最近距离为_______ nm (阿伏加德罗常数用NA表示,只列计算式)。
(1)锡合金具有优异的抗蚀性能,可以用来生产制作各种精美合金饰品。
①基态Sn原子价层电子排布为
②Co元素在元素周期表中的位置是
③Cu元素位于元素周期表的
(2)制备CrO2Cl2的反应为K2Cr2O7 + 3CCl4 = 2KCl + 2CrO2Cl2 + 3COCl2↑
①上述方程式中非金属元素电负性由小到大的顺序为
②COCl2分子中π键和σ键的个数比为
(3)Cu−Mn−Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:

①合金的化学式为
②A原子坐标参数为(0,1,0),则B原子坐标参数为
③已知该合金晶体密度为ρg·cm-3,则两个Al原子间的最近距离为
您最近一年使用:0次
2022-05-16更新
|
132次组卷
|
2卷引用:甘肃省兰州第一中学2021-2022学年高二下学期期中考试化学试题
6 . 回答下列问题:
(1)N和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为_______ 。

(2)S和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的S与Cu的微粒个数比为_______ 。

(3)价电子排布式为3d54s2的原子,其原子结构示意图为_______ 。
(4)CuaSnbSc中Cu元素有+1和+2两种价态,从结构上分析基态Cu+、Cu2+中_______ 更稳定,原因是_______ 。
(5)GaN、GaP、GaAs熔融状态均不导电,据此判断它们是_______ (填“共价”或“离子”)化合物。它们的晶体结构与金刚石相似,其熔点如表所示,试分析GaN、GaP、GaAs熔点依次降低的原因_______ 。
(6)已知配合物的品种超过数百万种,是一个庞大的化合物家族。在配合物[Cd(NH3)4](OH)2中,中心离子是_______ ,提供孤电子对的成键原子是_______ ,配位体是_______ ,配位数是_______ 。
(7)铬、铁、镍、铜等金属及其化合物在工业上有重要用途,基态铬原子的电子排布式为_______ 。
(1)N和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为

(2)S和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的S与Cu的微粒个数比为

(3)价电子排布式为3d54s2的原子,其原子结构示意图为
(4)CuaSnbSc中Cu元素有+1和+2两种价态,从结构上分析基态Cu+、Cu2+中
(5)GaN、GaP、GaAs熔融状态均不导电,据此判断它们是
| 物质 | GaN | GaP | GaAs |
| 熔点/℃ | 1700 | 1480 | 1238 |
(7)铬、铁、镍、铜等金属及其化合物在工业上有重要用途,基态铬原子的电子排布式为
您最近一年使用:0次
名校
解题方法
7 . 氮(N)、磷(P)、砷(As)等第VA族元素的化合物在研究和生产中有重要用途,请回答下列问题:
(1)第三周期元素的原子中,第一电离能大于磷原子的有_______ 种。
(2)氮族元素氯化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质可能有_______ (填序号)。
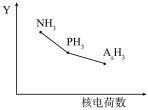
A.稳定性 B.沸点 C.R−H键之间的键角 D.分子间作用力 E.还原性
(3)经测定发现,某种N2O5固体由NO 和
和 两种离子组成,阳离子中N原子的杂化方式是
两种离子组成,阳离子中N原子的杂化方式是_______ 杂化,阴离子的空间构型为_______ 。
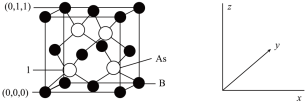
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如下图所示,则1号砷原子的坐标为_______ 。已知阿伏加德罗常数的值为NA,若晶胞参数为apm,则该晶体的密度为_______ g·cm−3(列出含a、NA的计算式即可)。
(1)第三周期元素的原子中,第一电离能大于磷原子的有
(2)氮族元素氯化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质可能有

A.稳定性 B.沸点 C.R−H键之间的键角 D.分子间作用力 E.还原性
(3)经测定发现,某种N2O5固体由NO
 和
和 两种离子组成,阳离子中N原子的杂化方式是
两种离子组成,阳离子中N原子的杂化方式是(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如下图所示,则1号砷原子的坐标为

您最近一年使用:0次
名校
解题方法
8 . 铜及其化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1)①将氨水逐滴加入硫酸铜溶液中,先生成蓝色沉淀,继续滴加氨水,沉淀溶解并得到深蓝色溶液,写出沉淀溶解的离子方程式:_______ 。
②向深蓝色溶液中继续加入乙醇,会析出深蓝色的晶体 。该晶体中含有的化学键类型为
。该晶体中含有的化学键类型为_______ 。在该晶体中 含有
含有 键的数目为
键的数目为_______ 。
③ 中各元素电负性由大到小的顺序为
中各元素电负性由大到小的顺序为_______ ,其中N原子的杂化轨道类型为_______ 。
④ 中
中 的键角比独立存在的
的键角比独立存在的 分子结构中的键角
分子结构中的键角_______ 。(填“大”“小”或“相等”)
(2)Cu−Mn−Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示

①合金的化学式为_______ 。
②若A原子的坐标参数为(0,1,0),则B原子的坐标参数为_______ 。
③已知该合金晶体的密度为 ,则最近的两个Al原子间的距离为
,则最近的两个Al原子间的距离为_______ nm(阿伏加德罗常数的值用NA表示)。
(1)①将氨水逐滴加入硫酸铜溶液中,先生成蓝色沉淀,继续滴加氨水,沉淀溶解并得到深蓝色溶液,写出沉淀溶解的离子方程式:
②向深蓝色溶液中继续加入乙醇,会析出深蓝色的晶体
 。该晶体中含有的化学键类型为
。该晶体中含有的化学键类型为 含有
含有 键的数目为
键的数目为③
 中各元素电负性由大到小的顺序为
中各元素电负性由大到小的顺序为④
 中
中 的键角比独立存在的
的键角比独立存在的 分子结构中的键角
分子结构中的键角(2)Cu−Mn−Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示

①合金的化学式为
②若A原子的坐标参数为(0,1,0),则B原子的坐标参数为
③已知该合金晶体的密度为
 ,则最近的两个Al原子间的距离为
,则最近的两个Al原子间的距离为
您最近一年使用:0次
名校
解题方法
9 . 2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家,其研究的是两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂(LiFePO4)为正极的电池。请回答下列问题:
(1)Mn位于元素周期表的_______ 区(填“s”或“p”或“d”或“ds”或“f”),基态钴原子的未成对电子数为_______ ,1mol [CoCl (NH3)5] Cl2 中含σ键数目为_______ NA。
(2)磷元素的最高价氧化物的水化物H3PO4在工业上有诸多特殊的用途,其中PO 的空间构型是
的空间构型是_______ ,中心原子的杂化方式是_______ 。
(3)PH3是_______ 分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是_______ 。
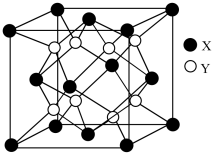
(4)硫化锂Li2S(摩尔质量M g∙mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ρ g·cm-3,则距离最近的两个S2-的距离是_______ cm。(用含ρ、M、NA的计算式表示)
(1)Mn位于元素周期表的
(2)磷元素的最高价氧化物的水化物H3PO4在工业上有诸多特殊的用途,其中PO
 的空间构型是
的空间构型是(3)PH3是
(4)硫化锂Li2S(摩尔质量M g∙mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ρ g·cm-3,则距离最近的两个S2-的距离是

您最近一年使用:0次
解题方法
10 . 氟及其化合物用途十分广泛,回答下列问题:
(1)基态氟原子核外电子运动状态有___________ 种;
(2) 的熔点为
的熔点为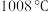 ,熔化呈液态时能导电;
,熔化呈液态时能导电; 的熔点为
的熔点为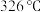 ,能升华,熔化呈液态时不导电。铜元素在元素周期表的位置
,能升华,熔化呈液态时不导电。铜元素在元素周期表的位置___________ ; 的基态价电子排布图为:
的基态价电子排布图为:___________ ;由信息可知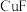 晶体类型是
晶体类型是___________ (填“离子晶体”、“共价晶体”或“分子晶体”)。
(3)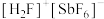 (氟锑酸)是一种超强酸,阳离子
(氟锑酸)是一种超强酸,阳离子 的杂化类型为
的杂化类型为___________ ,其离子空间构型为___________ 。
(4) 的晶胞如图所示,密度为
的晶胞如图所示,密度为 ,相邻的两个
,相邻的两个 的最近核间距为
的最近核间距为 ,则
,则 的摩尔质量为
的摩尔质量为___________  (列出代数式,设
(列出代数式,设 为阿伏加德罗常数的值,
为阿伏加德罗常数的值,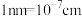 )。
)。

(1)基态氟原子核外电子运动状态有
(2)
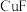 的熔点为
的熔点为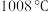 ,熔化呈液态时能导电;
,熔化呈液态时能导电; 的熔点为
的熔点为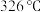 ,能升华,熔化呈液态时不导电。铜元素在元素周期表的位置
,能升华,熔化呈液态时不导电。铜元素在元素周期表的位置 的基态价电子排布图为:
的基态价电子排布图为: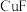 晶体类型是
晶体类型是(3)
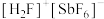 (氟锑酸)是一种超强酸,阳离子
(氟锑酸)是一种超强酸,阳离子 的杂化类型为
的杂化类型为(4)
 的晶胞如图所示,密度为
的晶胞如图所示,密度为 ,相邻的两个
,相邻的两个 的最近核间距为
的最近核间距为 ,则
,则 的摩尔质量为
的摩尔质量为 (列出代数式,设
(列出代数式,设 为阿伏加德罗常数的值,
为阿伏加德罗常数的值,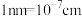 )。
)。
您最近一年使用:0次
2022-01-20更新
|
808次组卷
|
3卷引用:山东省菏泽市2021-2022学年高三上学期期末统考化学(B卷)试题



