1 . 二氟化氙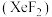 是一种选择性良好的氟化试剂,在室温下易升华,它的晶体属四方晶系,晶胞棱边夹角均为
是一种选择性良好的氟化试剂,在室温下易升华,它的晶体属四方晶系,晶胞棱边夹角均为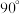 ,晶胞参数如图所示,其中原子
,晶胞参数如图所示,其中原子 的坐标为
的坐标为 ,下列说法不正确的是
,下列说法不正确的是
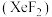 是一种选择性良好的氟化试剂,在室温下易升华,它的晶体属四方晶系,晶胞棱边夹角均为
是一种选择性良好的氟化试剂,在室温下易升华,它的晶体属四方晶系,晶胞棱边夹角均为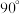 ,晶胞参数如图所示,其中原子
,晶胞参数如图所示,其中原子 的坐标为
的坐标为 ,下列说法不正确的是
,下列说法不正确的是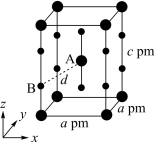
| A.Xe位于元素周期表p区 | B. 位于晶胞的顶点和中心 位于晶胞的顶点和中心 |
C.晶胞中A、B间距离 | D.该晶体属于分子晶体 |
您最近一年使用:0次
2024-03-13更新
|
671次组卷
|
5卷引用:广东省广州市第六十五中学2023-2024学年高三下学期期初综合训练化学试题
广东省广州市第六十五中学2023-2024学年高三下学期期初综合训练化学试题2024届广东省广州市黄埔区高三下学期二模化学试卷(已下线)第三章晶体结构与性质(A卷)(已下线)通关练07 原子、分子、晶体结构再归纳-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)提升练01 晶体结构及相关计算-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
2 . 随着新能源汽车的不断发展,从经济价值、环境保护等多重背景下考虑,废旧锂离子电池中的锂、镍、钴、锰金属的回收利用已经刻不容缓。某科研团队对废旧三元锂电池进行处理,工艺如图所示:
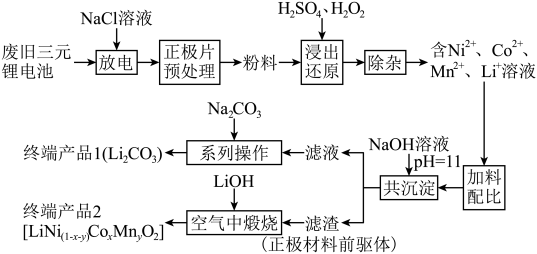
查阅资料显示:
a.正极片预处理后的粉料中主要成分与终端产品2相同,均为 ,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为
,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为 。
。
b.碳酸锂的溶解度随温度升高而减小。
(1)镍位于元素周期表第_______ 周期第_______ 族。
(2)写出粉料中的 通过“浸出还原”得到含
通过“浸出还原”得到含 、
、 、
、 、
、 溶液的化学反应方程式:
溶液的化学反应方程式:______________________________________________ 。
(3)温度、浸出时间对镍、钴、锰的浸出率的影响如下图所示。根据图中信息,应选择的温度为_______  ,浸出时间为
,浸出时间为_______  。除以上两因素外,任写一种对浸出率有影响的因素:
。除以上两因素外,任写一种对浸出率有影响的因素:_____________________ 。

(4)“浸出还原”后,可用低浓度的碳酸氢铵溶液除杂,写出反应的离子方程式_____________________ 。
(5)“共沉淀”后的滤液中含有大量 ,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:
,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:_______ 、_______ 、洗涤、干燥。
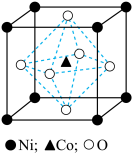
(6)一种钴镍氧化物的立方晶胞结构如图,该晶体的化学式为_______ ;已知晶胞参数为 ,晶胞密度为
,晶胞密度为 ,据此推断阿伏加德罗常数
,据此推断阿伏加德罗常数
_______  。(列出计算式)
。(列出计算式)

查阅资料显示:
a.正极片预处理后的粉料中主要成分与终端产品2相同,均为
 ,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为
,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为 。
。b.碳酸锂的溶解度随温度升高而减小。
(1)镍位于元素周期表第
(2)写出粉料中的
 通过“浸出还原”得到含
通过“浸出还原”得到含 、
、 、
、 、
、 溶液的化学反应方程式:
溶液的化学反应方程式:(3)温度、浸出时间对镍、钴、锰的浸出率的影响如下图所示。根据图中信息,应选择的温度为
 ,浸出时间为
,浸出时间为 。除以上两因素外,任写一种对浸出率有影响的因素:
。除以上两因素外,任写一种对浸出率有影响的因素:
(4)“浸出还原”后,可用低浓度的碳酸氢铵溶液除杂,写出反应的离子方程式
(5)“共沉淀”后的滤液中含有大量
 ,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:
,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:(6)一种钴镍氧化物的立方晶胞结构如图,该晶体的化学式为
 ,晶胞密度为
,晶胞密度为 ,据此推断阿伏加德罗常数
,据此推断阿伏加德罗常数
 。(列出计算式)
。(列出计算式)
您最近一年使用:0次
名校
3 . 利用超分子可分离C60和C70,将C60、C70混合物加入一种空腔大小适配C60的“杯酚”中进行分离的流程如图。下列说法正确的是

| A.杯酚与C60形成氢键 |
| B.C60与C70晶体类型不同 |
| C.该分离过程利用的是超分子的分子识别特征 |
| D.一个C60晶胞中含有8个C60分子 |
您最近一年使用:0次
2024-01-11更新
|
499次组卷
|
5卷引用:广东省广州大学附属中学2023-2024学年高二下学期开学测化学试题
4 . 材料是入类进步的基石,深入认识物质的结构有助于进一步开发新的材料。回答下列问题。
(1)B和Ni均为新材料的主角。
①按照杂化轨道理论,基态B原子的价电子先激发,再杂化成键形成 。杂化前,处于激发态的B原子的价电子轨道表示式为
。杂化前,处于激发态的B原子的价电子轨道表示式为___________ (填编号)。
A.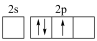 B.
B.  C.
C.  D.
D.
② 常温下呈液态,其分子空间构型为正四面体形。其易溶
常温下呈液态,其分子空间构型为正四面体形。其易溶 、苯等有机溶剂的原因是
、苯等有机溶剂的原因是___________ 。
(2)亚铁氰化钾具有防止食盐结块、保持食盐松散等作用,其化学式为 ,所含元素电负性由大到小的顺序为
,所含元素电负性由大到小的顺序为___________ ,1mol  含有σ键的物质的量为
含有σ键的物质的量为___________ 。
(3)铀氮化合物是核燃料循环系统中的重要物质。已知 。反应所得的气态产物中属于非极性分子的有
。反应所得的气态产物中属于非极性分子的有___________ (填化学式);反应中断裂的化学键有___________ 。(填编号)。
a.氢键 b.极性键 c.非极性键 d.离子键 e.配位键
(4)某锂电池的负极材料是锂原子嵌入石墨烯层间,其晶胞结构(底边为平行四边形)如图所示。

该晶体的化学式为___________ 。
(1)B和Ni均为新材料的主角。
①按照杂化轨道理论,基态B原子的价电子先激发,再杂化成键形成
 。杂化前,处于激发态的B原子的价电子轨道表示式为
。杂化前,处于激发态的B原子的价电子轨道表示式为A.
 B.
B.  C.
C.  D.
D.
②
 常温下呈液态,其分子空间构型为正四面体形。其易溶
常温下呈液态,其分子空间构型为正四面体形。其易溶 、苯等有机溶剂的原因是
、苯等有机溶剂的原因是(2)亚铁氰化钾具有防止食盐结块、保持食盐松散等作用,其化学式为
 ,所含元素电负性由大到小的顺序为
,所含元素电负性由大到小的顺序为 含有σ键的物质的量为
含有σ键的物质的量为(3)铀氮化合物是核燃料循环系统中的重要物质。已知
 。反应所得的气态产物中属于非极性分子的有
。反应所得的气态产物中属于非极性分子的有a.氢键 b.极性键 c.非极性键 d.离子键 e.配位键
(4)某锂电池的负极材料是锂原子嵌入石墨烯层间,其晶胞结构(底边为平行四边形)如图所示。

该晶体的化学式为
您最近一年使用:0次
2023-10-04更新
|
283次组卷
|
2卷引用:广东省广州大学附属中学2023-2024学年高二下学期开学测化学试题
解题方法
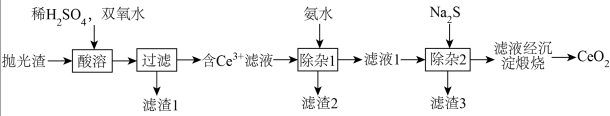
5 . 稀土抛光粉 有优良抛光性能。某抛光后产生的抛光渣(含
有优良抛光性能。某抛光后产生的抛光渣(含 、
、 、
、 、
、 、
、 、
、 等的化合物)进行提纯的工艺如下:
等的化合物)进行提纯的工艺如下:
已知:25℃时, ,
,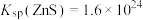 ,
, 。一定条件下,一些金属氢氧化物沉淀时的
。一定条件下,一些金属氢氧化物沉淀时的 如下表:
如下表:
(1)“酸溶”时,需控制80℃水浴加热,若温度过高浸出率降低的原因是_____ 。 发生反应的离子方程式为
发生反应的离子方程式为_____ 。
(2)“滤渣1”的主要成分为_____ 。
(3)“除杂1”中,加入氨水控制 范围为
范围为_____ ,溶液中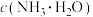
_____  (填“>”“=”或“<”)。“除杂2”中,主要除去的金属元素为
(填“>”“=”或“<”)。“除杂2”中,主要除去的金属元素为_____ 。
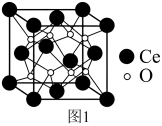
(4) 的晶胞结构如图1所示,晶胞参数为
的晶胞结构如图1所示,晶胞参数为 ,
, 原子处于
原子处于 形成的四面体间隙中。则
形成的四面体间隙中。则 原子的配位数为
原子的配位数为_____ ,晶胞密度为_____  。(列出计算式,
。(列出计算式, 的式量为
的式量为 ,阿伏加德罗常数为
,阿伏加德罗常数为 )
)
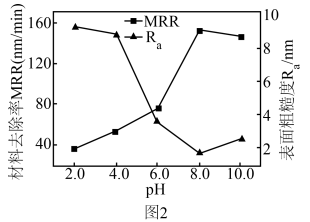
(5)纳米 分散液用于光学玻璃抛光时,
分散液用于光学玻璃抛光时, 值对抛光效果(材料抛光去除速率及抛光后表面粗糙度)的影响如图所示,已知抛光液中,
值对抛光效果(材料抛光去除速率及抛光后表面粗糙度)的影响如图所示,已知抛光液中, 纳米颗粒表面吸附了负电荷相互排斥而稳定。从图2中可看出,最佳
纳米颗粒表面吸附了负电荷相互排斥而稳定。从图2中可看出,最佳 值为
值为_____ ,在较低 值,抛光效果不理想的原因为
值,抛光效果不理想的原因为_____ 。
 有优良抛光性能。某抛光后产生的抛光渣(含
有优良抛光性能。某抛光后产生的抛光渣(含 、
、 、
、 、
、 、
、 、
、 等的化合物)进行提纯的工艺如下:
等的化合物)进行提纯的工艺如下:
已知:25℃时,
 ,
,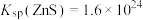 ,
, 。一定条件下,一些金属氢氧化物沉淀时的
。一定条件下,一些金属氢氧化物沉淀时的 如下表:
如下表:| 金属氢氧化物 |  |  |  | 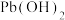 |  |
开始沉淀的 | 2.3 | 3.5 | 6.4 | 7.2 | 6.2 |
完全沉淀的 | 3.2 | 4.6 | 9.0 | 9.1 | 8.2 |
 发生反应的离子方程式为
发生反应的离子方程式为(2)“滤渣1”的主要成分为
(3)“除杂1”中,加入氨水控制
 范围为
范围为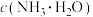
 (填“>”“=”或“<”)。“除杂2”中,主要除去的金属元素为
(填“>”“=”或“<”)。“除杂2”中,主要除去的金属元素为(4)
 的晶胞结构如图1所示,晶胞参数为
的晶胞结构如图1所示,晶胞参数为 ,
, 原子处于
原子处于 形成的四面体间隙中。则
形成的四面体间隙中。则 原子的配位数为
原子的配位数为 。(列出计算式,
。(列出计算式, 的式量为
的式量为 ,阿伏加德罗常数为
,阿伏加德罗常数为 )
) 
(5)纳米
 分散液用于光学玻璃抛光时,
分散液用于光学玻璃抛光时, 值对抛光效果(材料抛光去除速率及抛光后表面粗糙度)的影响如图所示,已知抛光液中,
值对抛光效果(材料抛光去除速率及抛光后表面粗糙度)的影响如图所示,已知抛光液中, 纳米颗粒表面吸附了负电荷相互排斥而稳定。从图2中可看出,最佳
纳米颗粒表面吸附了负电荷相互排斥而稳定。从图2中可看出,最佳 值为
值为 值,抛光效果不理想的原因为
值,抛光效果不理想的原因为
您最近一年使用:0次
名校
6 . 22号元素钛(Ti)的单质被誉为未来金属。工业冶炼Ti后的废渣中有SiO2和含Ti、Ca、Fe、Cu、Mg的化合物,从该废渣中回收Ti,并获得高附加值化工产品(MgF2、活性CaCO3、K2FeO4、X)的一种生产工艺如图所示:

已知:生产条件下MgF2的溶度积为9.0×10-9;NH4+时存在时,不易生成MgCO3沉淀,固体2中有CaCO3、Cu2(OH)2CO3和某含铁化合物。
(1)写出基态Ti原子的价电子排布式:_______ 。
(2)工艺设计要准确分析物质成分,科学加入试剂,准确把握用量,离子物质的量浓度≤1.0×10-5mol/L时,一般认为该离子沉淀完全。
①选择向固体1中加入盐酸而不加入硫酸的原因是_______ 。
②“析晶”过程是向深蓝色溶液3中先加入适量70%的H2SO4中和过量的氨水,再加入适量乙醇,得到深蓝色品体X,产品X的化学式是_______ 。
③“再溶”过程中加入强碱Y的稀溶液,溶液4中加入适量强碱Y的固体,强碱Y的化学式是_______ ;写出固体3“再溶”过程的离子方程式:________ 。
④测得溶液2中c(Mg2+)=0.030mol/L,要确保Mg2+沉淀完全,1L溶液2至少需加入NaF的物质的量为_______ mol(忽略溶液体积变化)。
(3)以上生产工艺中可循环利用的物质有NH3和_______ (填化学式)。
(4)活性碳酸钙晶胞为正方体结构,晶胞结构如图所示,黑点代表Ca2+,白色小圈代表CO ,晶胞边长为anm。
,晶胞边长为anm。

①活性碳酸钙晶体中一个CO 周围与其最近且等距的Ca2+的个数为
周围与其最近且等距的Ca2+的个数为_______ 。
②最近两个Ca2+之间的距离为_______ nm(用含a的代数式表示)。

已知:生产条件下MgF2的溶度积为9.0×10-9;NH4+时存在时,不易生成MgCO3沉淀,固体2中有CaCO3、Cu2(OH)2CO3和某含铁化合物。
(1)写出基态Ti原子的价电子排布式:
(2)工艺设计要准确分析物质成分,科学加入试剂,准确把握用量,离子物质的量浓度≤1.0×10-5mol/L时,一般认为该离子沉淀完全。
①选择向固体1中加入盐酸而不加入硫酸的原因是
②“析晶”过程是向深蓝色溶液3中先加入适量70%的H2SO4中和过量的氨水,再加入适量乙醇,得到深蓝色品体X,产品X的化学式是
③“再溶”过程中加入强碱Y的稀溶液,溶液4中加入适量强碱Y的固体,强碱Y的化学式是
④测得溶液2中c(Mg2+)=0.030mol/L,要确保Mg2+沉淀完全,1L溶液2至少需加入NaF的物质的量为
(3)以上生产工艺中可循环利用的物质有NH3和
(4)活性碳酸钙晶胞为正方体结构,晶胞结构如图所示,黑点代表Ca2+,白色小圈代表CO
 ,晶胞边长为anm。
,晶胞边长为anm。
①活性碳酸钙晶体中一个CO
 周围与其最近且等距的Ca2+的个数为
周围与其最近且等距的Ca2+的个数为②最近两个Ca2+之间的距离为
您最近一年使用:0次
名校
解题方法
7 . 铁及其化合物在生产、生活中有重要的应用。回答下列问题:
(1)基态Fe原子的价电子排布图为________ ,Fe2+核外电子有_________ 种空间运动状态。
(2)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。

①血红素中Fe2+的配位数为___________ ,碳原子的杂化方式有___________ 种。
②血红素中4种非金属元素的电负性由小到大的顺序为__________ 。
(3)FeCl3是常用的净水剂,FeCl3的熔点(306℃)显著低于FeF3的熔点(1000℃),其原因是___________ 。
(4)磷青铜是一种具有高耐腐蚀性、耐磨损性的合金材料,广泛用于机械零件制造。磷青铜的晶体结构如下图所示。
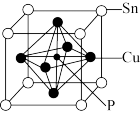
①该晶体的化学式为___________ 。
②若该晶胞的边长为apm,阿伏伽德罗常数为NA,则该晶体的密度为________ g/cm3(列出计算式)。
(1)基态Fe原子的价电子排布图为
(2)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。

①血红素中Fe2+的配位数为
②血红素中4种非金属元素的电负性由小到大的顺序为
(3)FeCl3是常用的净水剂,FeCl3的熔点(306℃)显著低于FeF3的熔点(1000℃),其原因是
(4)磷青铜是一种具有高耐腐蚀性、耐磨损性的合金材料,广泛用于机械零件制造。磷青铜的晶体结构如下图所示。

①该晶体的化学式为
②若该晶胞的边长为apm,阿伏伽德罗常数为NA,则该晶体的密度为
您最近一年使用:0次
2023-08-01更新
|
316次组卷
|
2卷引用:广东省广州市执信中学2023-2024学年高三上学期开学考试化学试题
8 . 分铜液净化渣主要含铜、碲( )、锑(
)、锑( )、砷(
)、砷( )等元素的化合物,一种回收工艺流程如图所示:
)等元素的化合物,一种回收工艺流程如图所示:

已知:i.“碱浸”时,铜、锑转化为难溶氢氧化物或氧化物,碱浸液含有 。
。
ii.“酸浸”时,锑元素反应生成难溶的 浸渣。
浸渣。
回答下列问题:
(1)As位于第四周期VA族,基态 的价层电子排布式为
的价层电子排布式为___________ 。
(2)“碱浸”时, 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
(3)向碱浸液加入盐酸调节 ,有
,有 析出,分离出
析出,分离出 的操作是
的操作是___________ 。滤液中 元素最主要的存在形式为
元素最主要的存在形式为___________ (常温下, 的各级电离常数为:
的各级电离常数为: 、
、 、
、 )。
)。
A. B.
B.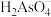 C.
C. D.
D.
(4)“氯盐酸浸”时,通入 的目的是
的目的是___________ 。
(5)“水解”时,生成 的化学方程式为
的化学方程式为___________ 。
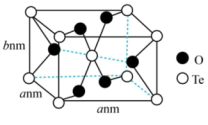
(6) 晶胞是长方体结构(如图所示),Te的配位数为
晶胞是长方体结构(如图所示),Te的配位数为___________ 。已知 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为___________  (列出计算表达式)
(列出计算表达式)
 )、锑(
)、锑( )、砷(
)、砷( )等元素的化合物,一种回收工艺流程如图所示:
)等元素的化合物,一种回收工艺流程如图所示:
已知:i.“碱浸”时,铜、锑转化为难溶氢氧化物或氧化物,碱浸液含有
 。
。ii.“酸浸”时,锑元素反应生成难溶的
 浸渣。
浸渣。回答下列问题:
(1)As位于第四周期VA族,基态
 的价层电子排布式为
的价层电子排布式为(2)“碱浸”时,
 与
与 反应的离子方程式为
反应的离子方程式为(3)向碱浸液加入盐酸调节
 ,有
,有 析出,分离出
析出,分离出 的操作是
的操作是 元素最主要的存在形式为
元素最主要的存在形式为 的各级电离常数为:
的各级电离常数为: 、
、 、
、 )。
)。A.
 B.
B.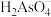 C.
C. D.
D.
(4)“氯盐酸浸”时,通入
 的目的是
的目的是(5)“水解”时,生成
 的化学方程式为
的化学方程式为(6)
 晶胞是长方体结构(如图所示),Te的配位数为
晶胞是长方体结构(如图所示),Te的配位数为 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 (列出计算表达式)
(列出计算表达式)
您最近一年使用:0次
2023-05-30更新
|
369次组卷
|
2卷引用:广东省深圳市福田区福田中学2023-2024学年高三下学期开学考试化学试题
名校
解题方法
9 . 制备 的实验操作如下:向盛有硫酸铜水溶液的试管中加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。回答以下问题:
的实验操作如下:向盛有硫酸铜水溶液的试管中加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。回答以下问题:
(1)基态 价层电子排布式为
价层电子排布式为_______ 。
(2)N、O、S三种元素的第一电离能由大到小的顺序为_______ 。
(3)沸点: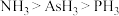 ,原因为
,原因为_______ 。
(4)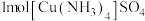 含有σ键的数目为
含有σ键的数目为_______ 。
(5)S与 形成的某化合物晶体的晶胞(实心点表示
形成的某化合物晶体的晶胞(实心点表示 ,空心点表示S)如图所示:
,空心点表示S)如图所示:

①该化合物的化学式为_______ 。
②已知该晶胞的晶胞参数为 ,阿伏加德罗常数为NA,则该晶胞的密度为
,阿伏加德罗常数为NA,则该晶胞的密度为_______  。
。
 的实验操作如下:向盛有硫酸铜水溶液的试管中加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。回答以下问题:
的实验操作如下:向盛有硫酸铜水溶液的试管中加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。回答以下问题:(1)基态
 价层电子排布式为
价层电子排布式为(2)N、O、S三种元素的第一电离能由大到小的顺序为
(3)沸点:
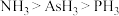 ,原因为
,原因为(4)
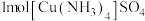 含有σ键的数目为
含有σ键的数目为(5)S与
 形成的某化合物晶体的晶胞(实心点表示
形成的某化合物晶体的晶胞(实心点表示 ,空心点表示S)如图所示:
,空心点表示S)如图所示:
①该化合物的化学式为
②已知该晶胞的晶胞参数为
 ,阿伏加德罗常数为NA,则该晶胞的密度为
,阿伏加德罗常数为NA,则该晶胞的密度为 。
。
您最近一年使用:0次
10 . 镍电池的电极活性材料为多组分合金(主要成分为镍、钴,还含有铝、铁等),可重新回收利用。利用废镍电池资源化生产醋酸钴晶体 的工艺流程如下。
的工艺流程如下。
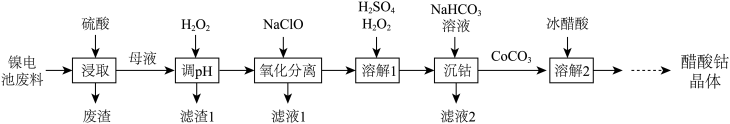
已知:①浸取母液中除铝元素外,其他金属元素的化合价均为 价。
价。
②部分金属阳离子沉淀的 如下表。
如下表。
请回答下列问题:
(1)“浸取”时可以提高浸取率的操作有_______ (任写1条)。
(2)“调 ”时溶液的
”时溶液的 范围是
范围是_______ ,所得滤渣1的主要成分为_______ (填化学式)。
(3)“氧化分离”操作控制溶液 ,加入
,加入 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(4)“溶解1”操作中加入 的作用为
的作用为_______ ,“沉钴”操作过程中发生反应的离子方程式为_______ 。
(5)“溶解2”操作后得到醋酸钴晶体,要使该醋酸钴晶体的纯度更高,所采取的实验操作名称应为_______ 。
(6)碱金属可以插入石墨层中,钾 的石墨插层化合物具有超导性,其中K层平行于石墨层。图1为其晶胞图,垂直于石墨层方向的原子投影如图2所示。
的石墨插层化合物具有超导性,其中K层平行于石墨层。图1为其晶胞图,垂直于石墨层方向的原子投影如图2所示。

C—C键的键长为 ,则K层中m与n两个K原子之间的距离为
,则K层中m与n两个K原子之间的距离为_______  ,设
,设 为阿伏加德罗常数的值,若晶胞参数分别为
为阿伏加德罗常数的值,若晶胞参数分别为 、
、 、
、 ,则该石墨插层化合物的晶胞密度为
,则该石墨插层化合物的晶胞密度为_______  (用含x、y、z、
(用含x、y、z、 的代数式表示)。
的代数式表示)。
 的工艺流程如下。
的工艺流程如下。
已知:①浸取母液中除铝元素外,其他金属元素的化合价均为
 价。
价。②部分金属阳离子沉淀的
 如下表。
如下表。| 沉淀物 |  |  |  |  |  |  |
开始沉淀 | 2.2 | 7.4 | 7.6 | 0.1 | 4.0 | 7.6 |
完全沉淀 | 3.2 | 8.9 | 9.2 | 1.1 | 5.2 | 9.2 |
(1)“浸取”时可以提高浸取率的操作有
(2)“调
 ”时溶液的
”时溶液的 范围是
范围是(3)“氧化分离”操作控制溶液
 ,加入
,加入 发生反应的离子方程式为
发生反应的离子方程式为(4)“溶解1”操作中加入
 的作用为
的作用为(5)“溶解2”操作后得到醋酸钴晶体,要使该醋酸钴晶体的纯度更高,所采取的实验操作名称应为
(6)碱金属可以插入石墨层中,钾
 的石墨插层化合物具有超导性,其中K层平行于石墨层。图1为其晶胞图,垂直于石墨层方向的原子投影如图2所示。
的石墨插层化合物具有超导性,其中K层平行于石墨层。图1为其晶胞图,垂直于石墨层方向的原子投影如图2所示。
C—C键的键长为
 ,则K层中m与n两个K原子之间的距离为
,则K层中m与n两个K原子之间的距离为 ,设
,设 为阿伏加德罗常数的值,若晶胞参数分别为
为阿伏加德罗常数的值,若晶胞参数分别为 、
、 、
、 ,则该石墨插层化合物的晶胞密度为
,则该石墨插层化合物的晶胞密度为 (用含x、y、z、
(用含x、y、z、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2023-02-18更新
|
992次组卷
|
4卷引用:广东省广州市等5地广州百师信息科技有限公司等2校2022-2023学年高三下学期开学考试化学试题
广东省广州市等5地广州百师信息科技有限公司等2校2022-2023学年高三下学期开学考试化学试题湖南省百校2023届高三开年摸底联考化学试题(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(工业流程题)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试平行卷



