名校
1 . 一节1号干电池可以让1平方米土地上的庄稼颗粒无收,回收电池既可以防止污染又可以变废为宝。废旧锌锰干电池内部的黑色物质A主要含有 、
、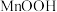 、
、 、
、 、碳单质、少量有机物(有机物易燃烧生成
、碳单质、少量有机物(有机物易燃烧生成 和
和 ),用黑色物质A制备高纯
),用黑色物质A制备高纯 的流程如图:
的流程如图:________ (填化学式)。
(2)第I步后在空气中灼烧的目的有两个,一个是将MnOOH转化为 ,另一个是
,另一个是________ 。灼烧时,MnOOH与空气中的氧气反应的化学方程式为________________ 。
(3)第III步中为提高反应速率,可以采取的措施有________ (任写一条)。
(4)已知: 难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;
难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解; 在pH大于7.7时,开始转化为
在pH大于7.7时,开始转化为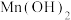 沉淀。第IV步中的多步操作可按如图步骤进行:
沉淀。第IV步中的多步操作可按如图步骤进行: 溶液调节溶液pH的过程中有
溶液调节溶液pH的过程中有 产生,则
产生,则 溶液与
溶液与 溶液反应的离子方程式为
溶液反应的离子方程式为________________ ;
②操作VI中需要的玻璃仪器有________ ;
③你认为操作VII中检测的方法及现象是________ 时可继续进行操作VIII;
④操作VIII中用无水乙醇洗涤的目的是________ 。
 、
、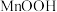 、
、 、
、 、碳单质、少量有机物(有机物易燃烧生成
、碳单质、少量有机物(有机物易燃烧生成 和
和 ),用黑色物质A制备高纯
),用黑色物质A制备高纯 的流程如图:
的流程如图:
(2)第I步后在空气中灼烧的目的有两个,一个是将MnOOH转化为
 ,另一个是
,另一个是(3)第III步中为提高反应速率,可以采取的措施有
(4)已知:
 难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;
难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解; 在pH大于7.7时,开始转化为
在pH大于7.7时,开始转化为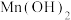 沉淀。第IV步中的多步操作可按如图步骤进行:
沉淀。第IV步中的多步操作可按如图步骤进行: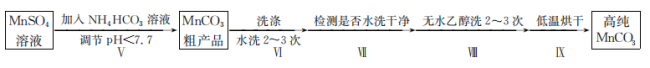
 溶液调节溶液pH的过程中有
溶液调节溶液pH的过程中有 产生,则
产生,则 溶液与
溶液与 溶液反应的离子方程式为
溶液反应的离子方程式为②操作VI中需要的玻璃仪器有
③你认为操作VII中检测的方法及现象是
④操作VIII中用无水乙醇洗涤的目的是
您最近一年使用:0次
解题方法
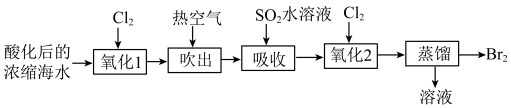
2 . 工业上可利用“吹出法”提溴。“吹出法”提溴的流程如图所示: 等离子。下列说法正确的是
等离子。下列说法正确的是
 等离子。下列说法正确的是
等离子。下列说法正确的是| A.取“吹出”后的溶液滴加到淀粉碘化钾试纸上,若试纸变蓝,则说明溶液中含Cl2 |
| B.“氧化1”中,Cl2过量会增大“吸收”时SO2水溶液的用量 |
C.“吸收”时,溶液中发生反应的离子方程式为Br2+SO2+2H2O=2HBr+2H++SO |
D.蒸馏后溶液中主要存在的离子:Na+、Mg2+、Cl-和SO |
您最近一年使用:0次
解题方法
3 . 铝和铝合金是一类重要的金属材料。回答下列问题:
(1)除去镁粉中混有少量铝粉,应加入的试剂为_______ ,发生反应的离子方程式为_______ ,然后经过滤、洗涤、干燥。
(2)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得 在同温同压下的体积之比是
在同温同压下的体积之比是_______ 。
(3)氢氧化亚铁在空气中会逐渐被氧化为氢氧化铁,其化学方程式为_______ 。
(4)某同学在实验室用铝土矿(含有 和
和 ,不考虑其他杂质)制取金属铝的流程如下:
,不考虑其他杂质)制取金属铝的流程如下:_______ 。
② 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为_______ 。
③滤液II中溶质的用途之一是_______ 。
(1)除去镁粉中混有少量铝粉,应加入的试剂为
(2)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得
 在同温同压下的体积之比是
在同温同压下的体积之比是(3)氢氧化亚铁在空气中会逐渐被氧化为氢氧化铁,其化学方程式为
(4)某同学在实验室用铝土矿(含有
 和
和 ,不考虑其他杂质)制取金属铝的流程如下:
,不考虑其他杂质)制取金属铝的流程如下:
②
 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为③滤液II中溶质的用途之一是
您最近一年使用:0次
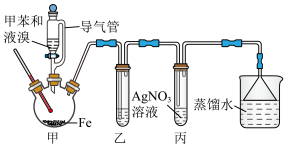
4 . 对溴甲苯( )是一种有机合成原料,广泛应用于医药合成。实验室中对溴甲苯可由甲苯和溴反应制得,装置如图所示。
)是一种有机合成原料,广泛应用于医药合成。实验室中对溴甲苯可由甲苯和溴反应制得,装置如图所示。
| 甲苯 | 溴 | 对溴甲苯 | |
| 沸点/℃ | 110 | 59 | 184 |
| 水溶性 | 难溶 | 微溶 | 难溶 |
(1)装置甲中导气管的作用为
(2)装置甲中的反应需控制在一定温度下进行,最适宜的温度范围为
a.>184℃ b.110℃~184℃ c.59℃~110℃ d.<59℃
(3)装置甲中主要发生反应的化学方程式为
(4)装置乙中需盛放的试剂名称为
(5)取装置甲中反应后的混合物,经过下列操作可获得纯净的对溴甲苯。
步骤1:水洗,分液;
步骤2:用NaOH稀溶液洗涤,除去
步骤3:水洗,分液;
步骤4:加入无水CaCl2粉末干燥,过滤;
步骤5:通过
a.过滤 b.蒸馏 c.蒸发
(6)关于该实验,下列说法正确的是
a.可以用溴水代替液溴
b.装置丙中的导管可以插入溶液中
c.装置丙中有淡黄色沉淀生成时,说明该反应为取代反应
您最近一年使用:0次
5 . 从某工业废水中(含 、
、 、
、 、
、 、
、 )回收利用Al和
)回收利用Al和 的工艺流程如图所示。下列说法错误的是
的工艺流程如图所示。下列说法错误的是
 、
、 、
、 、
、 、
、 )回收利用Al和
)回收利用Al和 的工艺流程如图所示。下列说法错误的是
的工艺流程如图所示。下列说法错误的是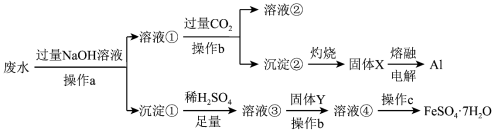
| A.操作a、b均是过滤,c蒸发浓缩、冷却结晶 |
B.溶液①中不止一种物质与 发生反应 发生反应 |
| C.溶液②的溶质主要是NaCl和Na2CO3 |
| D.固体Y可以是铁粉 |
您最近一年使用:0次
名校
6 . I.以黄铁矿(主要成分 )为原料生产硫酸及尾气处理的一种流程如下图所示。回答下列问题:
)为原料生产硫酸及尾气处理的一种流程如下图所示。回答下列问题:_______ ,其煅烧的化学反应方程式为_______ 。
(2)焦亚硫酸钠( )是常用的食品抗氧化剂,在空气中容易被氧化而变质,若检验焦亚硫酸钠是否变质,具体的实验操作为
)是常用的食品抗氧化剂,在空气中容易被氧化而变质,若检验焦亚硫酸钠是否变质,具体的实验操作为_______ 。
Ⅱ.聚合硫酸铝铁(PFAS)是一种新型高效水处理剂。以粉煤灰(主要成分为 、
、 、FeO等)为铝源,利用硫铁矿烧渣(主要成分为
、FeO等)为铝源,利用硫铁矿烧渣(主要成分为 、FeO、
、FeO、 等)为铁源,制备PFAS的工艺流程如下:
等)为铁源,制备PFAS的工艺流程如下:_______ 。
(4)“酸溶Ⅱ时,将硫铁矿烧渣粉碎的目的是_______ ,所得滤渣Ⅱ的主要成分为_______ (填化学式)。
(5)“氧化”时应控制温度在50~57℃,其原因是_______ ;“氧化”时反应的离子方程式为_______ 。
 )为原料生产硫酸及尾气处理的一种流程如下图所示。回答下列问题:
)为原料生产硫酸及尾气处理的一种流程如下图所示。回答下列问题:
(2)焦亚硫酸钠(
 )是常用的食品抗氧化剂,在空气中容易被氧化而变质,若检验焦亚硫酸钠是否变质,具体的实验操作为
)是常用的食品抗氧化剂,在空气中容易被氧化而变质,若检验焦亚硫酸钠是否变质,具体的实验操作为Ⅱ.聚合硫酸铝铁(PFAS)是一种新型高效水处理剂。以粉煤灰(主要成分为
 、
、 、FeO等)为铝源,利用硫铁矿烧渣(主要成分为
、FeO等)为铝源,利用硫铁矿烧渣(主要成分为 、FeO、
、FeO、 等)为铁源,制备PFAS的工艺流程如下:
等)为铁源,制备PFAS的工艺流程如下: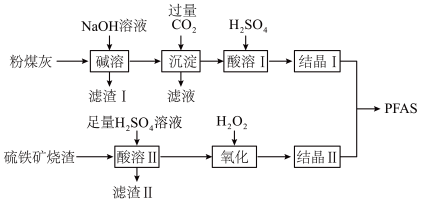
(4)“酸溶Ⅱ时,将硫铁矿烧渣粉碎的目的是
(5)“氧化”时应控制温度在50~57℃,其原因是
您最近一年使用:0次
名校
7 . 是中学重要的试剂。某小组以重晶石为原料制备氯化钡晶体。
实验(一)制备BaS并验证其气体产物(装置如图)。
主反应: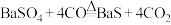
副反应:
(1)通入CO之前,先通入一段时间 ,这样操作的目的是
,这样操作的目的是_______ 。
(2)从a、b、c、d中选择合适的一组试剂:_______ (填标号)。
实验(二)制备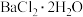 (装置如图)。
(装置如图)。_______ ,实验过程中观察到烧杯中产生黑色沉淀,写出相应的离子方程式为_______ 。
(4)实验完毕后,从 溶液中分离产品的操作是蒸发浓缩、
溶液中分离产品的操作是蒸发浓缩、_______ 、过滤、洗涤、低温干燥。
(5)实验室用11.65g (摩尔质量为233
(摩尔质量为233 )最终制得,9.76g
)最终制得,9.76g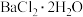 (摩尔质量为244
(摩尔质量为244 ),则该过程中Ba的损耗率为
),则该过程中Ba的损耗率为_______ 。
实验(一)制备BaS并验证其气体产物(装置如图)。

主反应:
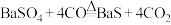
副反应:

(1)通入CO之前,先通入一段时间
 ,这样操作的目的是
,这样操作的目的是(2)从a、b、c、d中选择合适的一组试剂:
| B | C | D | E | |
| a | 品红溶液 | NaOH溶液 | 澄清石灰水 | 溴水 |
| b | 溴水 | 品红溶液 | 澄清石灰水 | 酸性高锰酸钾溶液 |
| c | 酸性高锰酸钾溶液 | 溴水 | NaOH溶液 | 品红溶液 |
| d | 品红溶液 | 溴水 | 品红溶液 | 澄清石灰水 |
实验(二)制备
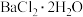 (装置如图)。
(装置如图)。
(4)实验完毕后,从
 溶液中分离产品的操作是蒸发浓缩、
溶液中分离产品的操作是蒸发浓缩、(5)实验室用11.65g
 (摩尔质量为233
(摩尔质量为233 )最终制得,9.76g
)最终制得,9.76g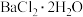 (摩尔质量为244
(摩尔质量为244 ),则该过程中Ba的损耗率为
),则该过程中Ba的损耗率为
您最近一年使用:0次
解题方法
8 . 丰富多彩的氯家族
18世纪70年代,瑞典化学家舍勒将软锰矿主要成分是MnO2与浓盐酸混合加热。产生了氯气。氯气是一种重要的化工原料,工业上大量用于制造盐酸、次氯酸盐、有机溶剂、农药、染料和药品等,从而形成了品种繁多、功能各异的氯家族。工业上通过电解饱和食盐水的方法制取率气,称为氯碱工业,氯碱工业的产品除应用于化学工业本身之外,还广泛应用于冶金、造纸、农药、有机合成等工业。食盐水在电解前需要精制,主要是为了除去混在氯化钠中的杂质。1.下列物质不能通过单质间的化合反应得到的是________。
| A.FeCl2 | B.FeCl3 | C.CuCl2 | D.HCl |
3.将一瓶新制的氯水长期放置后,溶液中离子取分子浓度不会减少的是________。
| A.Cl2 | B.Cl- | C.H2O | D.HClO |

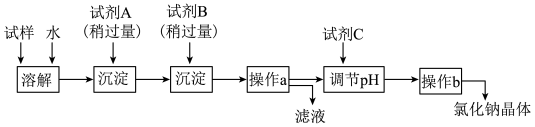
②试剂B是
③试剂C是
④操作b的名称是
您最近一年使用:0次
解题方法
9 . 工业上用FeCl3溶液做印刷电路铜板的腐蚀液。化学小组设计如下流程对腐蚀废液(阳离子主要有H+、Fe3+、Fe2+和Cu2+)进行处理,实现FeCl3溶液再生并回收Cu。___________ ;
(2)步骤Ⅰ的目的是将Fe2+转化为Fe3+,发生反应的离子方程式为___________ ,
(3)步骤Ⅱ中发生反应的离子方程式为___________ ;
(4)调节pH时可选用下列哪些试剂___________。
(5)溶液C中的溶质为___________ (填化学式);
(6)步骤Ⅲ中发生反应的化学方程式为___________ 。
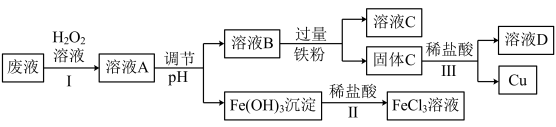
(2)步骤Ⅰ的目的是将Fe2+转化为Fe3+,发生反应的离子方程式为
(3)步骤Ⅱ中发生反应的离子方程式为
(4)调节pH时可选用下列哪些试剂___________。
| A.NaOH | B.Cu(OH)2 | C.Fe | D.CuO |
(5)溶液C中的溶质为
(6)步骤Ⅲ中发生反应的化学方程式为
您最近一年使用:0次
10 . 硝酸镍、硝酸钠在陶瓷、玻璃工业应用广泛。以废弃镍板(含有少量的氧化铝杂质)生产硝酸镍、硝酸钠工艺流程如下:
(1)工业生产普通玻璃的主要原料有石英砂、__________ 、__________ 。
(2)“反应器”中需控制反应温度50~60℃,若温度太低,可能导致的后果是__________ ;若温度太高,可能导致的后果是__________ 。
(3)假如Ni与浓硝酸反应产生的混合气体中 ,该反应的离子方程式为
,该反应的离子方程式为__________ 。
(4)向“浸取液”中加入 调节pH至5~6,能除去浸取液中的
调节pH至5~6,能除去浸取液中的 ,相应原理为
,相应原理为_______ 。__________ 。
(6)向“转化器”中加入稀硝酸的目的是__________ 。
(7)已知:①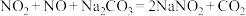 ;
;
②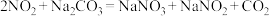 。
。
若将一定体积的 、NO混合气体,通入
、NO混合气体,通入 溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为__________ 。

(1)工业生产普通玻璃的主要原料有石英砂、
(2)“反应器”中需控制反应温度50~60℃,若温度太低,可能导致的后果是
(3)假如Ni与浓硝酸反应产生的混合气体中
 ,该反应的离子方程式为
,该反应的离子方程式为(4)向“浸取液”中加入
 调节pH至5~6,能除去浸取液中的
调节pH至5~6,能除去浸取液中的 ,相应原理为
,相应原理为__________+
 +
+ __________
__________ +
+ _________+
_________+
 。
。
(6)向“转化器”中加入稀硝酸的目的是
(7)已知:①
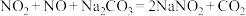 ;
;②
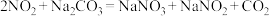 。
。若将一定体积的
 、NO混合气体,通入
、NO混合气体,通入 溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
您最近一年使用:0次



