名校
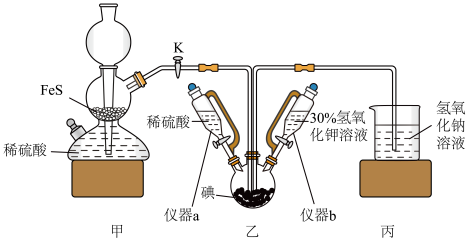
1 . 碘化钾用作制有机化合物及制药原料,医疗上用于防治甲状腺肿和甲状腺机能亢进的手术前准备,也可用作祛痰药。某实验室通过碘酸钾和硫化氢反应制备碘化钾。实验装置如图所示(夹持及加热装置已省略)回答下列问题:___________ ,实验中先关闭K,打开仪器___________ (填“a”、“b”或“ab”)制备碘酸钾,其反应的离子方程式为___________ 。某同学认为可以将甲装置中的 更换为粉末状
更换为粉末状 固体,你认为是否合理?
固体,你认为是否合理?___________ (填“合理”、“不合理”或“无法判断”)。
(2)乙装置中加入稀 的主要作用是
的主要作用是___________ 。
(3)如果乙装置最终生成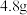 黄色沉淀,理论上可制得碘化钾的质量为
黄色沉淀,理论上可制得碘化钾的质量为___________ g。
(4)本实验尾气中的硫化氢可以用 溶液吸收,也可以用
溶液吸收,也可以用 溶液吸收。向
溶液吸收。向 溶液中通尾气直至饱和(
溶液中通尾气直至饱和( )时,溶液中刚好有
)时,溶液中刚好有 沉淀生成,此时溶液中
沉淀生成,此时溶液中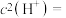
___________  (结果保留四位有效数字)。(已知
(结果保留四位有效数字)。(已知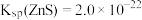 ,
, 的
的 ,
,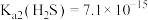 。)
。)
 更换为粉末状
更换为粉末状 固体,你认为是否合理?
固体,你认为是否合理?(2)乙装置中加入稀
 的主要作用是
的主要作用是(3)如果乙装置最终生成
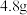 黄色沉淀,理论上可制得碘化钾的质量为
黄色沉淀,理论上可制得碘化钾的质量为(4)本实验尾气中的硫化氢可以用
 溶液吸收,也可以用
溶液吸收,也可以用 溶液吸收。向
溶液吸收。向 溶液中通尾气直至饱和(
溶液中通尾气直至饱和( )时,溶液中刚好有
)时,溶液中刚好有 沉淀生成,此时溶液中
沉淀生成,此时溶液中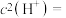
 (结果保留四位有效数字)。(已知
(结果保留四位有效数字)。(已知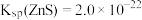 ,
, 的
的 ,
,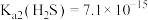 。)
。)
您最近一年使用:0次
2024-05-12更新
|
118次组卷
|
2卷引用:安徽师范大学附属中学2024届高三下学期5月测试化学试卷
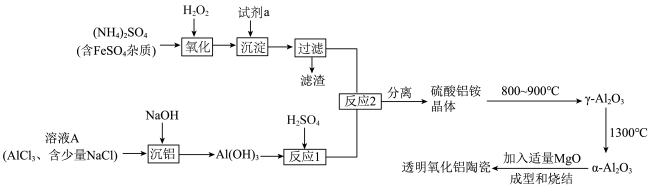
2 . 透明氧化铝陶瓷被认为是最具潜力的材料之一,制备透明氧化铝陶瓷的一种方法的流程如图所示:
(1)试剂a应选用___________ (填名称), 的电子式为
的电子式为___________ 。
(2)“反应1”的离子方程式为___________ 。
(3)检验上述流程中“过滤”后杂质已除尽的方法是___________ 。
(4)“沉铝”时,欲使 恰好完全转化为
恰好完全转化为 沉淀,应控制pH的范围是
沉淀,应控制pH的范围是___________ {已知:溶液中 、
、 浓度小于
浓度小于 认为
认为 沉淀完全,
沉淀完全,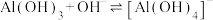 ,
,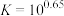 ,
,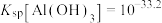 }。
}。
(5)硫酸铝铵晶体[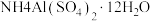 ]是一种重要的分析试剂,向硫酸铝铵溶液中加入同浓度的
]是一种重要的分析试剂,向硫酸铝铵溶液中加入同浓度的 溶液,沉淀质量最大时,反应的总离子方程式为
溶液,沉淀质量最大时,反应的总离子方程式为___________ 。
(6)硫酸铝铵晶体加热到800~900℃得到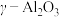 ,加热过程中固体质量随温度的变化如图所示。则633℃时剩余固体成分的化学式为
,加热过程中固体质量随温度的变化如图所示。则633℃时剩余固体成分的化学式为___________ 。___________ 特性;用它制造刚玉球磨机,是利用它的___________ 特性。
(1)试剂a应选用
 的电子式为
的电子式为(2)“反应1”的离子方程式为
(3)检验上述流程中“过滤”后杂质已除尽的方法是
(4)“沉铝”时,欲使
 恰好完全转化为
恰好完全转化为 沉淀,应控制pH的范围是
沉淀,应控制pH的范围是 、
、 浓度小于
浓度小于 认为
认为 沉淀完全,
沉淀完全,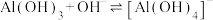 ,
,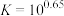 ,
,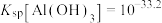 }。
}。(5)硫酸铝铵晶体[
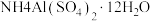 ]是一种重要的分析试剂,向硫酸铝铵溶液中加入同浓度的
]是一种重要的分析试剂,向硫酸铝铵溶液中加入同浓度的 溶液,沉淀质量最大时,反应的总离子方程式为
溶液,沉淀质量最大时,反应的总离子方程式为(6)硫酸铝铵晶体加热到800~900℃得到
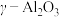 ,加热过程中固体质量随温度的变化如图所示。则633℃时剩余固体成分的化学式为
,加热过程中固体质量随温度的变化如图所示。则633℃时剩余固体成分的化学式为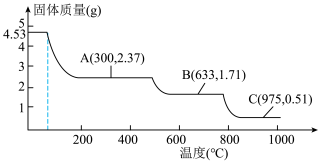
您最近一年使用:0次
2024-05-12更新
|
154次组卷
|
2卷引用:2024届河南省九师联盟2023-2024学年高三下学期4月联考理综试题-高中化学
名校
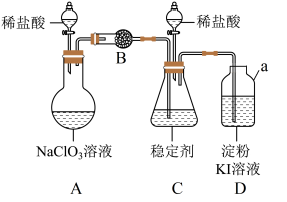
3 . 二氧化氯是一种生活中常用的消毒剂。实验室通过如下装置制备、研究二氧化氯。___________ 。
(2)常温下,装置A中生成两种气体产物,其一是 ,则装置A中发生反应的化学方程式为
,则装置A中发生反应的化学方程式为___________ 。
(3)为使 在装置C中被稳定剂充分吸收,装置A中滴加稀盐酸的速度宜
在装置C中被稳定剂充分吸收,装置A中滴加稀盐酸的速度宜___________ (填“较快”或“较慢”)。
(4) 在装置C中被完全吸收生成
在装置C中被完全吸收生成 ,此时装置D中溶液的颜色不变,则装置B的作用是
,此时装置D中溶液的颜色不变,则装置B的作用是___________ 。
(5)已知在酸性条件下 可发生反应生成
可发生反应生成 并释放出
并释放出 (不考虑其他副反应),
(不考虑其他副反应), 在装置C中完全吸收后,打开装置C中分液漏斗活塞,装置C中发生反应,则此时装置D的作用是
在装置C中完全吸收后,打开装置C中分液漏斗活塞,装置C中发生反应,则此时装置D的作用是___________ 。
(6)取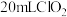 消毒过的自来水(密度为
消毒过的自来水(密度为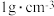 ,加稀硫酸酸化,加入
,加稀硫酸酸化,加入 过量
过量 溶液充分反应,再加2滴淀粉溶液,用
溶液充分反应,再加2滴淀粉溶液,用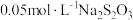 标准溶液滴定碘单质,达到滴定终点时消耗
标准溶液滴定碘单质,达到滴定终点时消耗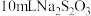 标准溶液(已知:
标准溶液(已知: )。
)。
①)该过程中 与
与 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
②达到滴定终点时现象是___________ ,原自来水中 的质量分数为
的质量分数为___________ 。
(2)常温下,装置A中生成两种气体产物,其一是
 ,则装置A中发生反应的化学方程式为
,则装置A中发生反应的化学方程式为(3)为使
 在装置C中被稳定剂充分吸收,装置A中滴加稀盐酸的速度宜
在装置C中被稳定剂充分吸收,装置A中滴加稀盐酸的速度宜(4)
 在装置C中被完全吸收生成
在装置C中被完全吸收生成 ,此时装置D中溶液的颜色不变,则装置B的作用是
,此时装置D中溶液的颜色不变,则装置B的作用是(5)已知在酸性条件下
 可发生反应生成
可发生反应生成 并释放出
并释放出 (不考虑其他副反应),
(不考虑其他副反应), 在装置C中完全吸收后,打开装置C中分液漏斗活塞,装置C中发生反应,则此时装置D的作用是
在装置C中完全吸收后,打开装置C中分液漏斗活塞,装置C中发生反应,则此时装置D的作用是(6)取
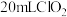 消毒过的自来水(密度为
消毒过的自来水(密度为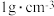 ,加稀硫酸酸化,加入
,加稀硫酸酸化,加入 过量
过量 溶液充分反应,再加2滴淀粉溶液,用
溶液充分反应,再加2滴淀粉溶液,用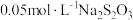 标准溶液滴定碘单质,达到滴定终点时消耗
标准溶液滴定碘单质,达到滴定终点时消耗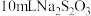 标准溶液(已知:
标准溶液(已知: )。
)。①)该过程中
 与
与 发生反应的离子方程式为
发生反应的离子方程式为②达到滴定终点时现象是
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
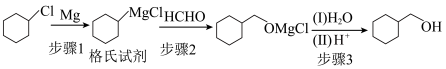
4 . 环己基甲醇是重要的有机合成中间体,其合成方法如下:
注意:①环已基甲醇120-140℃易发生脱水反应。
②涉及格氏试剂的反应需要在无水的条件下进行。
具体步骤如下:
 .制备
.制备
步骤1:(格氏试剂的制备)将2.67g镁条及10mL正丁醚加入250mL三颈烧瓶中,于恒压滴液漏斗中加入12.1mL(0.1mol)氯代环己烷和45mL正丁醚。水浴条件下逐滴滴加混合液,冷凝回流直至反应完毕。
步骤2:分批量加入10g干燥的多聚甲醛,加热至100-110℃,搅拌、反应0.5h。
步骤3:冷却反应混合物,加入30g碎冰,搅拌至水解完全,加入稀硫酸,分液。
 .环已基甲醇的分离和提纯
.环已基甲醇的分离和提纯
步骤4:向有机相中加入饱和氯化钠溶液,分液。
步骤5:向有机层加入无水碳酸钾,过滤,___________,得到产品6.3g。
回答下列问题:
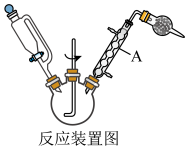
(1)反应装置中仪器A的名称为___________ ,实验中恒压滴液漏斗的作用是___________ 。
(2)环己基甲醇的沸点高于氯代环己烷主要原因是___________ 。
(3)制备过程中,步骤3水解反应(i)的方程式为___________ ,加入稀硫酸的作用为___________ 。
(4)分离提纯中,步骤 饱和氯化钠的作用
饱和氯化钠的作用___________ 。
(5)步骤5得到产品的操作为___________ 。
(6)产品的产率为___________ (用计算,精确至0.1%)。
| 物质 | 氯代环己烷 | 正丁醚 | 环己基甲醇 |
| 沸点 | 142℃ | 143℃ | 182℃(熔点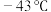 ) ) |
| 溶解性 | 难溶于水 | 难溶于水 | 难溶于水 |
| 密度 | 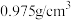 | 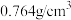 |  |
| 相对分子质量 | 118.5 | 139 | 114 |
②涉及格氏试剂的反应需要在无水的条件下进行。
具体步骤如下:
 .制备
.制备步骤1:(格氏试剂的制备)将2.67g镁条及10mL正丁醚加入250mL三颈烧瓶中,于恒压滴液漏斗中加入12.1mL(0.1mol)氯代环己烷和45mL正丁醚。水浴条件下逐滴滴加混合液,冷凝回流直至反应完毕。
步骤2:分批量加入10g干燥的多聚甲醛,加热至100-110℃,搅拌、反应0.5h。
步骤3:冷却反应混合物,加入30g碎冰,搅拌至水解完全,加入稀硫酸,分液。
 .环已基甲醇的分离和提纯
.环已基甲醇的分离和提纯步骤4:向有机相中加入饱和氯化钠溶液,分液。
步骤5:向有机层加入无水碳酸钾,过滤,___________,得到产品6.3g。
回答下列问题:
(1)反应装置中仪器A的名称为
(2)环己基甲醇的沸点高于氯代环己烷主要原因是
(3)制备过程中,步骤3水解反应(i)的方程式为
(4)分离提纯中,步骤
 饱和氯化钠的作用
饱和氯化钠的作用(5)步骤5得到产品的操作为
(6)产品的产率为
您最近一年使用:0次
5 . 镀锌钢板广泛运用于汽车行业。当镀层质量不合格时,先利用强酸将镀件表面的镀锌层清洗,再检测其中含有的 、
、 、
、 等离子的浓度。
等离子的浓度。
(1)测定原理:EDTA(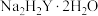 )可与
)可与 、
、 、
、 等多种金属离子形成络合物,如下表。其中
等多种金属离子形成络合物,如下表。其中 是乙二胺四乙酸根(
是乙二胺四乙酸根( )的简写。
)的简写。
①EDTA在水溶液中可看作“六元酸”的一种微粒可表示为___________ (用H、Y表示)。
②表中最稳定的金属络合物是___________ (填化学式)。
(2)测定过程:已知EDTA标准溶液滴定 的相关信息如下表:
的相关信息如下表:
可采用连续滴定法测定 、
、 、
、 的浓度,具体步骤如下:
的浓度,具体步骤如下:
I.先测定 (
( 、
、 不影响Fe3+的滴定):
不影响Fe3+的滴定):
请补充完整实验方案:
①按规定操作分别将0.01000 EDTA标准溶液和待测溶液[其中
EDTA标准溶液和待测溶液[其中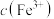 约为0.01
约为0.01 ]装入如图所示的滴定管中;
]装入如图所示的滴定管中;___________ 。(可选用的实验试剂有:磺基水杨酸、氨水溶液、盐酸溶液)
③实验测得 的浓度偏大,其原因可能是
的浓度偏大,其原因可能是___________ 。
II.再测定 :在
:在 的锥形瓶中继续加入适量过硫酸铵
的锥形瓶中继续加入适量过硫酸铵 ,轻微摇晃使
,轻微摇晃使 转化为
转化为 ,继续用EDTA标准溶液滴定到终点。写出
,继续用EDTA标准溶液滴定到终点。写出 转化为
转化为 的离子方程式:
的离子方程式:___________ 。
III.最后测定 :在
:在 的锥形瓶中继续加入一定量过量的EDTA标准溶液,调节溶液pH至5.0~6.0,再用
的锥形瓶中继续加入一定量过量的EDTA标准溶液,调节溶液pH至5.0~6.0,再用 标准溶液滴定到终点。
标准溶液滴定到终点。 不影响
不影响 滴定的原因是
滴定的原因是___________ 。
 、
、 、
、 等离子的浓度。
等离子的浓度。(1)测定原理:EDTA(
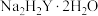 )可与
)可与 、
、 、
、 等多种金属离子形成络合物,如下表。其中
等多种金属离子形成络合物,如下表。其中 是乙二胺四乙酸根(
是乙二胺四乙酸根( )的简写。
)的简写。| 络合反应 | 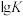 (K为平衡常数) |
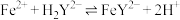 | 14.3 |
 | 16.5 |
 | 25.1 |
②表中最稳定的金属络合物是
(2)测定过程:已知EDTA标准溶液滴定
 的相关信息如下表:
的相关信息如下表:| 滴定对象 |  |
| 滴定时溶液pH范围 | 1.5~2.0 |
| 指示剂 | 磺基水杨酸 |
| 滴定终点现象 | 紫红色→亮黄色 |
 、
、 、
、 的浓度,具体步骤如下:
的浓度,具体步骤如下:I.先测定
 (
( 、
、 不影响Fe3+的滴定):
不影响Fe3+的滴定):请补充完整实验方案:
①按规定操作分别将0.01000
 EDTA标准溶液和待测溶液[其中
EDTA标准溶液和待测溶液[其中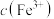 约为0.01
约为0.01 ]装入如图所示的滴定管中;
]装入如图所示的滴定管中;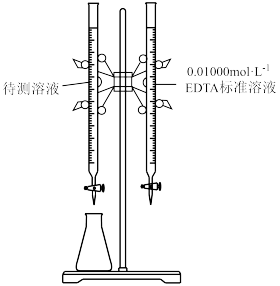
③实验测得
 的浓度偏大,其原因可能是
的浓度偏大,其原因可能是II.再测定
 :在
:在 的锥形瓶中继续加入适量过硫酸铵
的锥形瓶中继续加入适量过硫酸铵 ,轻微摇晃使
,轻微摇晃使 转化为
转化为 ,继续用EDTA标准溶液滴定到终点。写出
,继续用EDTA标准溶液滴定到终点。写出 转化为
转化为 的离子方程式:
的离子方程式:III.最后测定
 :在
:在 的锥形瓶中继续加入一定量过量的EDTA标准溶液,调节溶液pH至5.0~6.0,再用
的锥形瓶中继续加入一定量过量的EDTA标准溶液,调节溶液pH至5.0~6.0,再用 标准溶液滴定到终点。
标准溶液滴定到终点。 不影响
不影响 滴定的原因是
滴定的原因是
您最近一年使用:0次
6 . 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾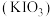 是常用的食盐加碘剂,可采用如下方法进行制备。
是常用的食盐加碘剂,可采用如下方法进行制备。
已知:① 为无色或白色颗粒或粉末状结晶,是一种较强的氧化剂,其水溶液呈中性。
为无色或白色颗粒或粉末状结晶,是一种较强的氧化剂,其水溶液呈中性。
② 加热至
加热至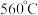 开始分解,不溶于乙醇。
开始分解,不溶于乙醇。
方法一:采用如图所示装置用氯气氧化碘化钾得到碘酸钾溶液,再经一系列操作得到碘酸钾产品。
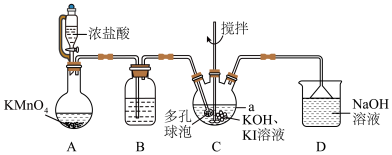
(1)装置B中盛装的试剂为________ ,仪器 的名称为
的名称为_______ 。
(2)装置C中多孔球泡的作用是________ ;C中反应生成碘酸钾的总化学方程式为_______ 。
(3)一系列操作包括蒸发浓缩、冷却结晶、抽滤、洗涤、干燥等多步操作。下列说法正确的是______(填序号)。
方法二:采用如图实验流程,用碘单质制取碘酸钾产品。
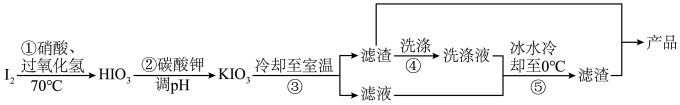
(4)步骤①需控制温度在 左右,原因是
左右,原因是________ 。
(5)步骤②中生成气体的反应的离子方程式为_______ 。
(6)产品碘酸钾纯度的测定:准确称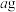 产品配成
产品配成 溶液,取
溶液,取 该溶液于碘量瓶中,加入稍过量的碘化钾溶液,用适量硫酸酸化。用
该溶液于碘量瓶中,加入稍过量的碘化钾溶液,用适量硫酸酸化。用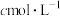 的硫代硫酸钠标准溶液滴定,滴定至淡黄色,加入少许淀粉溶液。平行滴定三次,平均消耗硫代硫酸钠标准溶液
的硫代硫酸钠标准溶液滴定,滴定至淡黄色,加入少许淀粉溶液。平行滴定三次,平均消耗硫代硫酸钠标准溶液 。已知
。已知 ,产品的纯度为
,产品的纯度为______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
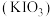 是常用的食盐加碘剂,可采用如下方法进行制备。
是常用的食盐加碘剂,可采用如下方法进行制备。已知:①
 为无色或白色颗粒或粉末状结晶,是一种较强的氧化剂,其水溶液呈中性。
为无色或白色颗粒或粉末状结晶,是一种较强的氧化剂,其水溶液呈中性。②
 加热至
加热至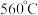 开始分解,不溶于乙醇。
开始分解,不溶于乙醇。方法一:采用如图所示装置用氯气氧化碘化钾得到碘酸钾溶液,再经一系列操作得到碘酸钾产品。

(1)装置B中盛装的试剂为
 的名称为
的名称为(2)装置C中多孔球泡的作用是
(3)一系列操作包括蒸发浓缩、冷却结晶、抽滤、洗涤、干燥等多步操作。下列说法正确的是______(填序号)。
| A.蒸发浓缩过程中需要使用三脚架、泥三角、坩埚等仪器 |
| B.抽滤可以加快过滤速率,获得较为干燥的产品 |
| C.产品可用乙醇洗涤以减少溶解损失 |
| D.干燥时高温烘干比低温烘干效果更好 |
方法二:采用如图实验流程,用碘单质制取碘酸钾产品。

(4)步骤①需控制温度在
 左右,原因是
左右,原因是(5)步骤②中生成气体的反应的离子方程式为
(6)产品碘酸钾纯度的测定:准确称
 产品配成
产品配成 溶液,取
溶液,取 该溶液于碘量瓶中,加入稍过量的碘化钾溶液,用适量硫酸酸化。用
该溶液于碘量瓶中,加入稍过量的碘化钾溶液,用适量硫酸酸化。用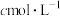 的硫代硫酸钠标准溶液滴定,滴定至淡黄色,加入少许淀粉溶液。平行滴定三次,平均消耗硫代硫酸钠标准溶液
的硫代硫酸钠标准溶液滴定,滴定至淡黄色,加入少许淀粉溶液。平行滴定三次,平均消耗硫代硫酸钠标准溶液 。已知
。已知 ,产品的纯度为
,产品的纯度为 、
、 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
7 . 邻苯二甲酸二丁酯(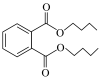 )为无色粘稠液体,可用作增塑剂,对多种树脂具有很强溶解力,通过邻苯二甲酸酐(
)为无色粘稠液体,可用作增塑剂,对多种树脂具有很强溶解力,通过邻苯二甲酸酐(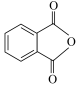 )和正丁醇制备邻苯二甲酸二丁酯的反应如下(其中第一步反应会完全进行):
)和正丁醇制备邻苯二甲酸二丁酯的反应如下(其中第一步反应会完全进行):
第二步:
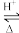
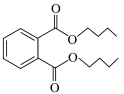 +H2O。
+H2O。
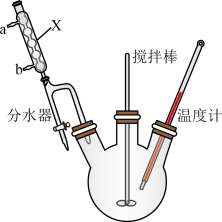
| 物质 | 相对分子质量 | 沸点/℃ | 溶解性 | 其他性质 |
| 正丁醇 | 74 | 117.6 | 易溶于有机溶剂,在水中溶解度不大 | 密度小于水 |
| 邻苯二甲酸单丁酯 | 222 | 363.5 | 易溶于有机溶剂,难溶于水 | |
| 邻苯二甲酸二丁酯 | 278 | 337 | 易溶于有机溶剂,不溶于水 | 着火点202℃ |
①向三颈烧瓶内加入
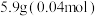 邻苯二甲酸酐,
邻苯二甲酸酐, 正丁醇,几粒沸石和
正丁醇,几粒沸石和 浓硫酸;另在分水器中加入正丁醇至与分水器支管口齐平,后加热三颈烧瓶至微沸。
浓硫酸;另在分水器中加入正丁醇至与分水器支管口齐平,后加热三颈烧瓶至微沸。②待三颈烧瓶内邻苯二甲酸䣲完全溶解后,继续升温,并持续搅拌反应2小时,保温至反应结束。
③冷却至室温,将反应混合物倒出;依次用
 溶液、饱和食盐水洗涤得到粗产品。
溶液、饱和食盐水洗涤得到粗产品。④粗产品用无水硫酸镁处理→取处理后的液体→圆底烧瓶→减压蒸馏,经过处理得到产品
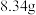 。
。回答下列问题:
(1)仪器X的名称为
(2)分水器使用前需要进行的操作为
(3)制备的第一步是制备邻苯二甲酸单丁酯,涉及反应的化学方程式为
(4)实验中用
 溶液洗涤的目的为
溶液洗涤的目的为(5)本实验中,邻苯二甲酸二丁酯的产率为
您最近一年使用:0次
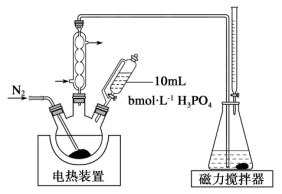
8 . 亚硫酸钠可用作人造纤维稳定剂、造纸木质素脱除剂等。某课题小组利用二氧化硫制备亚硫酸钠并测定其含量,装置如下所示。
(1)装置A中所装试剂为________ ,作用是________ 。
(2)实验时,关闭活塞 ,通入过量
,通入过量 ,再打开活塞
,再打开活塞 ,充分反应后即可制得亚硫酸钠。反应的离子方程式为
,充分反应后即可制得亚硫酸钠。反应的离子方程式为________ 。
(3)上述装置中存在的一处缺陷是________ 。
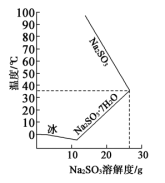
(4)亚硫酸钠的溶解度随温度的变化如上图所示,从 装置溶液中获得
装置溶液中获得 的方法是
的方法是________ 。
(5)测定上述产品中亚硫酸钠样品含量。其装置如图所示: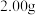 样品并加入水将其溶解,锥形瓶中加入
样品并加入水将其溶解,锥形瓶中加入 水、
水、 淀粉溶液,并预加
淀粉溶液,并预加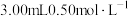 的碘标准溶液,搅拌。
的碘标准溶液,搅拌。
②持续通入氮气,再加入过量磷酸,加入并保持微沸。同时用碘标准液滴定,至终点时滴定消耗了 碘标准溶液。
碘标准溶液。
③做空白实验,消耗了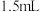 碘标准溶液。
碘标准溶液。
该样品中亚硫酸钠的含量为_______ (保留两位有效数字);
若先加入磷酸再通入氮气,会使测定结果_______ 。(填“偏高”“偏低”或“无影响”)

(1)装置A中所装试剂为
(2)实验时,关闭活塞
 ,通入过量
,通入过量 ,再打开活塞
,再打开活塞 ,充分反应后即可制得亚硫酸钠。反应的离子方程式为
,充分反应后即可制得亚硫酸钠。反应的离子方程式为(3)上述装置中存在的一处缺陷是
(4)亚硫酸钠的溶解度随温度的变化如上图所示,从
 装置溶液中获得
装置溶液中获得 的方法是
的方法是(5)测定上述产品中亚硫酸钠样品含量。其装置如图所示:
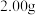 样品并加入水将其溶解,锥形瓶中加入
样品并加入水将其溶解,锥形瓶中加入 水、
水、 淀粉溶液,并预加
淀粉溶液,并预加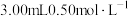 的碘标准溶液,搅拌。
的碘标准溶液,搅拌。②持续通入氮气,再加入过量磷酸,加入并保持微沸。同时用碘标准液滴定,至终点时滴定消耗了
 碘标准溶液。
碘标准溶液。③做空白实验,消耗了
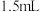 碘标准溶液。
碘标准溶液。该样品中亚硫酸钠的含量为
若先加入磷酸再通入氮气,会使测定结果
您最近一年使用:0次
解题方法
9 . 硫及其化合物是十分重要的化工原料。
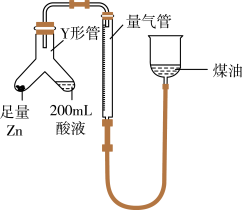
(1)某同学设计如图实验测定硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气):__________ (填字母)。
②已知开始时量气管读数为 ,最终读数为
,最终读数为 (均折合成标准状况,且
(均折合成标准状况,且 )。则锌与稀硫酸发生反应的最低硫酸浓度为
)。则锌与稀硫酸发生反应的最低硫酸浓度为__________  。
。
(2)已知 具有还原性,可以还原
具有还原性,可以还原 ,也可以与
,也可以与 发生反应。
发生反应。
①将 通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。若木条不复燃,则说明
通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。若木条不复燃,则说明 与
与 反应无
反应无 生成,可能发生反应的化学方程式为
生成,可能发生反应的化学方程式为__________ 。
②将 通入装有碘水(含淀粉)的洗气瓶中,若
通入装有碘水(含淀粉)的洗气瓶中,若__________ ,说明还原性: ,写出该反应的离子方程式:
,写出该反应的离子方程式:__________ 。
(3)为探究 在盐酸中与Cu、
在盐酸中与Cu、 的反应,某实验小组设计如图实验。
的反应,某实验小组设计如图实验。
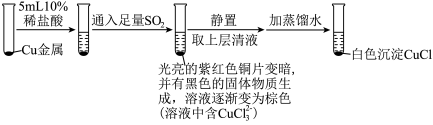
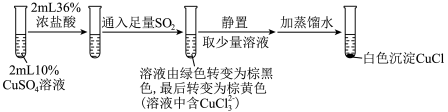
实验Ⅰ: ,实验Ⅰ中得到的黑色固体为
,实验Ⅰ中得到的黑色固体为 。
。
①实验Ⅰ通入 时反应的离子方程式为
时反应的离子方程式为__________ ,实验Ⅱ通入 时反应的离子方程式为
时反应的离子方程式为__________ 。
②实验Ⅱ若消耗__________  ,则生成
,则生成 个
个 。
。
(1)某同学设计如图实验测定硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气):
②已知开始时量气管读数为
 ,最终读数为
,最终读数为 (均折合成标准状况,且
(均折合成标准状况,且 )。则锌与稀硫酸发生反应的最低硫酸浓度为
)。则锌与稀硫酸发生反应的最低硫酸浓度为 。
。(2)已知
 具有还原性,可以还原
具有还原性,可以还原 ,也可以与
,也可以与 发生反应。
发生反应。①将
 通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。若木条不复燃,则说明
通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。若木条不复燃,则说明 与
与 反应无
反应无 生成,可能发生反应的化学方程式为
生成,可能发生反应的化学方程式为②将
 通入装有碘水(含淀粉)的洗气瓶中,若
通入装有碘水(含淀粉)的洗气瓶中,若 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(3)为探究
 在盐酸中与Cu、
在盐酸中与Cu、 的反应,某实验小组设计如图实验。
的反应,某实验小组设计如图实验。实验Ⅰ:
 ,实验Ⅰ中得到的黑色固体为
,实验Ⅰ中得到的黑色固体为 。
。①实验Ⅰ通入
 时反应的离子方程式为
时反应的离子方程式为 时反应的离子方程式为
时反应的离子方程式为②实验Ⅱ若消耗
 ,则生成
,则生成 个
个 。
。
您最近一年使用:0次
10 . 一种从火法炼铜烟道灰(主要成分是 的硫酸盐,还有少量
的硫酸盐,还有少量 和
和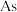 的氧化物)中回收铅,并制取三盐基硫酸铅(
的氧化物)中回收铅,并制取三盐基硫酸铅(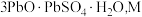 为
为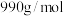 )的工艺如图:
)的工艺如图:
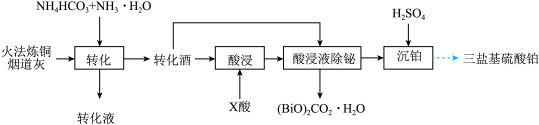
已知: 微溶于水
微溶于水
(1)写出铅原子的核外电子排布式:
_______ ,它位于元素周期表的_______ 区。
(2)转化过程温度选择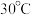 ,原因是
,原因是_______ 。
(3)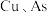 元素均进入转化液中,相关的离子分别为
元素均进入转化液中,相关的离子分别为_______ 、_______ (填离子符号)。
(4)转化渣主要成分为碳酸铅和碳酸氧铋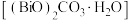 ,写出
,写出 转化为
转化为 的离子反应方程式:
的离子反应方程式:_______ 。
(5)加入适量的 酸,
酸, 酸宜为_______(填序号)。
酸宜为_______(填序号)。
(6)转化渣除铋的离子方程式为_______ 。
(7)若使用 烟道灰,最终制得纯度为
烟道灰,最终制得纯度为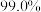 的三盐基硫酸铅
的三盐基硫酸铅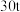 ,已知该工艺铅的回收率约为
,已知该工艺铅的回收率约为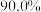 ,则烟道灰中含铅的质量分数为
,则烟道灰中含铅的质量分数为_______ 。
 的硫酸盐,还有少量
的硫酸盐,还有少量 和
和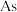 的氧化物)中回收铅,并制取三盐基硫酸铅(
的氧化物)中回收铅,并制取三盐基硫酸铅(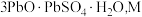 为
为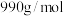 )的工艺如图:
)的工艺如图:
已知:
 微溶于水
微溶于水(1)写出铅原子的核外电子排布式:

(2)转化过程温度选择
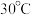 ,原因是
,原因是(3)
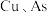 元素均进入转化液中,相关的离子分别为
元素均进入转化液中,相关的离子分别为(4)转化渣主要成分为碳酸铅和碳酸氧铋
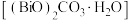 ,写出
,写出 转化为
转化为 的离子反应方程式:
的离子反应方程式:(5)加入适量的
 酸,
酸, 酸宜为_______(填序号)。
酸宜为_______(填序号)。| A.盐酸 | B.硫酸 | C.硝酸 | D.氢硫酸 |
(6)转化渣除铋的离子方程式为
(7)若使用
 烟道灰,最终制得纯度为
烟道灰,最终制得纯度为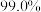 的三盐基硫酸铅
的三盐基硫酸铅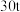 ,已知该工艺铅的回收率约为
,已知该工艺铅的回收率约为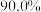 ,则烟道灰中含铅的质量分数为
,则烟道灰中含铅的质量分数为
您最近一年使用:0次



