名校
1 . 六水合硫酸亚铁铵的化学式为 ,商品名为摩尔盐。可由硫酸亚铁与硫酸铵反应生成硫酸亚铁铵,硫酸亚铁盐在空气中易被氧化,而形成摩尔盐后就比较稳定了。
,商品名为摩尔盐。可由硫酸亚铁与硫酸铵反应生成硫酸亚铁铵,硫酸亚铁盐在空气中易被氧化,而形成摩尔盐后就比较稳定了。
已知:摩尔盐可溶于水,在酒精中溶解度很小。
I.实验室制取少量摩尔盐的流程如下:
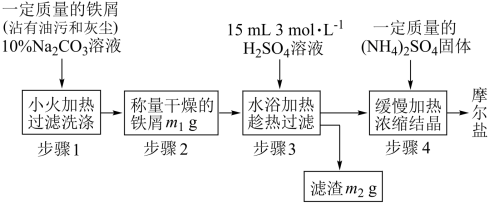
试回答下列问题:
(1)步骤1中加入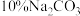 溶液的主要作用是
溶液的主要作用是____________________ 。
(2)将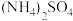 溶液与
溶液与 溶液混合后加热、浓缩,当有
溶液混合后加热、浓缩,当有_____________ 出现时停止加热,冷却结晶。
(3)步骤4中析出的晶体会吸附杂质离子,如何获得较纯净的摩尔盐,简述操作方法:________________________________________________________________ 。
II.测定该产品纯度的方法是:
 称取
称取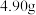 该产品,溶解,在250mL容量瓶中定容;
该产品,溶解,在250mL容量瓶中定容;
 量取25mL待测溶液于锥形瓶中;
量取25mL待测溶液于锥形瓶中;
 用硫酸酸化的
用硫酸酸化的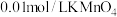 溶液滴定至终点。
溶液滴定至终点。
(4)在滴定管中装入酸性高锰酸钾溶液后,要先排放滴定管尖嘴处的气泡,其正确的图示为_______  用相应的字母回答
用相应的字母回答 。
。
A. B.
B. C.
C. D.
D.
(5)试写出该滴定过程中反应的离子方程式_________________________________ 。
(6)判断该反应到达滴定终点的现象为_____________________________________ 。
(7)滴定前后,酸性 溶液的读数如下表,则该产品的纯度为
溶液的读数如下表,则该产品的纯度为___________ 。
 ,商品名为摩尔盐。可由硫酸亚铁与硫酸铵反应生成硫酸亚铁铵,硫酸亚铁盐在空气中易被氧化,而形成摩尔盐后就比较稳定了。
,商品名为摩尔盐。可由硫酸亚铁与硫酸铵反应生成硫酸亚铁铵,硫酸亚铁盐在空气中易被氧化,而形成摩尔盐后就比较稳定了。已知:摩尔盐可溶于水,在酒精中溶解度很小。
I.实验室制取少量摩尔盐的流程如下:

试回答下列问题:
(1)步骤1中加入
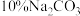 溶液的主要作用是
溶液的主要作用是(2)将
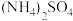 溶液与
溶液与 溶液混合后加热、浓缩,当有
溶液混合后加热、浓缩,当有(3)步骤4中析出的晶体会吸附杂质离子,如何获得较纯净的摩尔盐,简述操作方法:
II.测定该产品纯度的方法是:
 称取
称取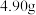 该产品,溶解,在250mL容量瓶中定容;
该产品,溶解,在250mL容量瓶中定容; 量取25mL待测溶液于锥形瓶中;
量取25mL待测溶液于锥形瓶中; 用硫酸酸化的
用硫酸酸化的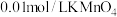 溶液滴定至终点。
溶液滴定至终点。(4)在滴定管中装入酸性高锰酸钾溶液后,要先排放滴定管尖嘴处的气泡,其正确的图示为
 用相应的字母回答
用相应的字母回答 。
。A.
 B.
B. C.
C. D.
D.
(5)试写出该滴定过程中反应的离子方程式
(6)判断该反应到达滴定终点的现象为
(7)滴定前后,酸性
 溶液的读数如下表,则该产品的纯度为
溶液的读数如下表,则该产品的纯度为滴定前 | 滴定后 |
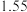 | 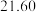 |
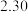 |  |
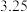 | 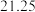 |
您最近一年使用:0次
2020-10-20更新
|
67次组卷
|
2卷引用:河北省沧州市第一中学2020-2021学年高二上学期第一次月考化学试题
名校
2 . 蒸馏碘滴定法可测量中药材中二氧化硫是否超标(亚硫酸盐折算成二氧化硫)。原理是利用如图装置将亚硫酸盐转化为SO2,然后通过碘标准溶液滴定吸收液。
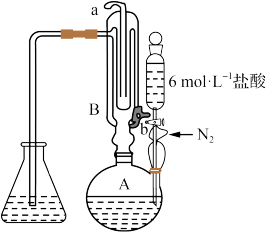
实验步骤如下:
Ⅰ. SO2含量的测定
烧瓶A中加中药粉10g,加蒸馏水300mL;
锥形瓶中加蒸馏水125mL和淀粉试液1mL作为吸收液;
打开冷凝水,通氮气,滴入盐酸10mL;加热烧瓶A并保持微沸约3min后,用0.01000mol·L-1碘标准溶液一边吸收一边滴定,至终点时消耗碘标准溶液V1mL。
Ⅱ.空白实验
只加300mL蒸馏水,重复上述操作,需碘标准溶液体积为V0mL。
(1)滴入盐酸前先通氮气一段时间作用是_________ ,测定过程中氮气的流速过快会导致测量结果__________ (填“偏大”“偏小”或“不变”)。
(2)滴定时锥形瓶中反应的离子方程式为________ ,滴定终点的现象是__________ 。
(3)空白实验的目的是___________ 。
(4)该中药中含SO2含量为_________ mg/kg。

实验步骤如下:
Ⅰ. SO2含量的测定
烧瓶A中加中药粉10g,加蒸馏水300mL;
锥形瓶中加蒸馏水125mL和淀粉试液1mL作为吸收液;
打开冷凝水,通氮气,滴入盐酸10mL;加热烧瓶A并保持微沸约3min后,用0.01000mol·L-1碘标准溶液一边吸收一边滴定,至终点时消耗碘标准溶液V1mL。
Ⅱ.空白实验
只加300mL蒸馏水,重复上述操作,需碘标准溶液体积为V0mL。
(1)滴入盐酸前先通氮气一段时间作用是
(2)滴定时锥形瓶中反应的离子方程式为
(3)空白实验的目的是
(4)该中药中含SO2含量为
您最近一年使用:0次
名校
解题方法
3 . 利用 和
和 为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
已知 和三氯氧磷的性质如下表:
和三氯氧磷的性质如下表:
(1)仪器乙的名称是__________ 。
(2)实验过程中仪器丁的进水口为__________ (选填“ ”或“
”或“ ”)口。
”)口。
(3)装置B的作用是__________ (填标号)。
a.气体除杂 b.加注浓硫酸 c.观察气体流出速度 d.调节气压

(4)整个装置必须干燥,若未干燥,写出所有副反应的化学方程式______________________________ 。
(5)制备三氯氧磷所用PCl3测定纯度的方法如下:迅速称取 产品,水解完全后配成
产品,水解完全后配成 溶液,取出
溶液,取出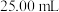 入过量的
入过量的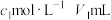 碘溶液,充分反应后再用
碘溶液,充分反应后再用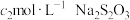 溶液滴定过量的碘,终点时消耗
溶液滴定过量的碘,终点时消耗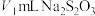 溶液。
溶液。
已知: ;
; ;假设测定过程中没有其他反应。根据上述数据,该产品中
;假设测定过程中没有其他反应。根据上述数据,该产品中 (相对分子质量为137.5)的质量分数的计算式为
(相对分子质量为137.5)的质量分数的计算式为__________ %。(用含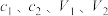 的代数式表示)
的代数式表示)
 和
和 为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):已知
 和三氯氧磷的性质如下表:
和三氯氧磷的性质如下表:熔点 | 沸点 | 其他物理或化学性质 | |
 | 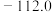 | 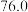 |  和 和 互溶,均为无色液体,遇水均剧烈水解,发生复分解反应生成磷的含氧酸和 互溶,均为无色液体,遇水均剧烈水解,发生复分解反应生成磷的含氧酸和 |
 | 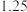 | 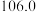 |
(1)仪器乙的名称是
(2)实验过程中仪器丁的进水口为
 ”或“
”或“ ”)口。
”)口。(3)装置B的作用是
a.气体除杂 b.加注浓硫酸 c.观察气体流出速度 d.调节气压

(4)整个装置必须干燥,若未干燥,写出所有副反应的化学方程式
(5)制备三氯氧磷所用PCl3测定纯度的方法如下:迅速称取
 产品,水解完全后配成
产品,水解完全后配成 溶液,取出
溶液,取出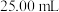 入过量的
入过量的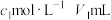 碘溶液,充分反应后再用
碘溶液,充分反应后再用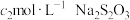 溶液滴定过量的碘,终点时消耗
溶液滴定过量的碘,终点时消耗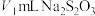 溶液。
溶液。已知:
 ;
; ;假设测定过程中没有其他反应。根据上述数据,该产品中
;假设测定过程中没有其他反应。根据上述数据,该产品中 (相对分子质量为137.5)的质量分数的计算式为
(相对分子质量为137.5)的质量分数的计算式为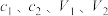 的代数式表示)
的代数式表示)
您最近一年使用:0次
2020-06-12更新
|
139次组卷
|
2卷引用:河北省武安市第三中学2021届高三上学期期中考试化学试题
名校
解题方法
4 . 亚氯酸钠(NaClO2)是一种应用广泛的高效氧化型漂白剂。以下是某小组模拟工业制法利用ClO2与H2O2在碱性条件下制备少量NaClO2的实验装置:
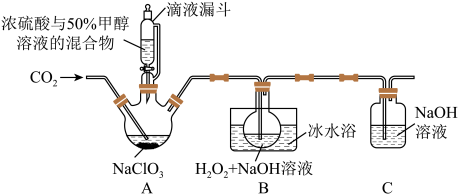
已知:(1)硫酸作酸化剂时,甲醇(CH3OH)可将NaClO3还原为ClO2。
(2)ClO2沸点为9.9℃,可溶于水,有毒,气体中ClO2浓度较高时易发生爆炸。
(3)饱和NaClO2溶液在温度低于38℃时析出晶体NaClO2•3H2O,在温度高于38℃时析出晶体NaClO2,高于60℃时分解生成NaClO3和NaCl。
回答下列问题:
(1)实验前用浓硫酸与50%甲醇溶液配制混合溶液的操作是:___________ 。
(2)实验过程中需要持续通入CO2的主要目的,一是可以起到搅拌作用,二是___________ 。
(3)装置A中,若氧化产物为CO2,则氧化剂与还原剂的物质的量之比为___________ 。
(4)装置B中生成NaClO2的化学方程式是____ 。
(5)从反应后的B溶液中制得NaClO2晶体的操作步骤是:a.___ ;b._____ ;c.用38~60℃的热水洗涤;d.在低于60oC的真空中蒸发,干燥。
(6)装置C中C1O2与NaOH溶液反应生成等物质的量的两种钠盐,其中一种为NaClO2,装置C中C1O2与NaOH溶液反应的化学方程式为______ 。
(7)NaClO2纯度测定:①称取所得NaClO2样品1.000g于烧杯中,加入适量蒸馏水过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的还原产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用0.2000mol/LNa2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,判断达到滴定终点时的现象为_____ 。重复滴定3次,测得Na2S2O3标准液平均用量为18.00mL,则该样品中NaClO2的质量分数为____________ 。

已知:(1)硫酸作酸化剂时,甲醇(CH3OH)可将NaClO3还原为ClO2。
(2)ClO2沸点为9.9℃,可溶于水,有毒,气体中ClO2浓度较高时易发生爆炸。
(3)饱和NaClO2溶液在温度低于38℃时析出晶体NaClO2•3H2O,在温度高于38℃时析出晶体NaClO2,高于60℃时分解生成NaClO3和NaCl。
回答下列问题:
(1)实验前用浓硫酸与50%甲醇溶液配制混合溶液的操作是:
(2)实验过程中需要持续通入CO2的主要目的,一是可以起到搅拌作用,二是
(3)装置A中,若氧化产物为CO2,则氧化剂与还原剂的物质的量之比为
(4)装置B中生成NaClO2的化学方程式是
(5)从反应后的B溶液中制得NaClO2晶体的操作步骤是:a.
(6)装置C中C1O2与NaOH溶液反应生成等物质的量的两种钠盐,其中一种为NaClO2,装置C中C1O2与NaOH溶液反应的化学方程式为
(7)NaClO2纯度测定:①称取所得NaClO2样品1.000g于烧杯中,加入适量蒸馏水过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的还原产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用0.2000mol/LNa2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,判断达到滴定终点时的现象为
您最近一年使用:0次
2020-05-12更新
|
263次组卷
|
3卷引用:河北省张家口市宣化第一中学2021-2022学年高三上学期12月月考化学试题
解题方法
5 . 工业上用空气氧化(NH4)2SO3的方法制取(NH4)2SO4,某研究小组用如图装置模拟该过程,并通过测定反应后溶液中SOT的浓度来计算该反应的转化率。
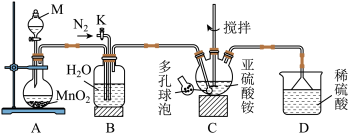
实验步骤如下:
①按图连接好装置,检查装置气密性;
②取200 mL 0.5000 mol•L-1(NH4)2SO3溶液(调节pH = 8)装入三颈烧瓶中,加入催化剂,控制气体流速为300 L•h-1,在温度为50℃下进行实验;
③反应2.5 h后,测定反应后溶液中SO32-的浓度。
回答下列问题:
(1)仪器M的名称为_____ ,仪器M中装有H2O2溶液,则装置A中发生反应的化学方程式为_______ 。
(2)实验中通如N2的目的是_____ 。
(3)装置B的作用是_____ (任答一条)。
(4)装置C中采用多孔球泡的目的是_____ ,已知亚硫酸铵溶液的pH小于8,要调节装置C中溶液的pH=8,应向该溶液中加入一定量的_____ (填标号
a NH3 • H2O b Ba(OH)2 c 澄清石灰水
(5)该实验缺少的装置是_____ 。
(6)取VmL反应后的溶液(反应前后体积不变)于碘量瓶中,滴入3滴淀粉溶液,用a mol•L-1的标准碘溶 液滴定至终点时,消耗碘水的体积为b mL,则(NH4 )2SO3的转化率为_____ 。

实验步骤如下:
①按图连接好装置,检查装置气密性;
②取200 mL 0.5000 mol•L-1(NH4)2SO3溶液(调节pH = 8)装入三颈烧瓶中,加入催化剂,控制气体流速为300 L•h-1,在温度为50℃下进行实验;
③反应2.5 h后,测定反应后溶液中SO32-的浓度。
回答下列问题:
(1)仪器M的名称为
(2)实验中通如N2的目的是
(3)装置B的作用是
(4)装置C中采用多孔球泡的目的是
a NH3 • H2O b Ba(OH)2 c 澄清石灰水
(5)该实验缺少的装置是
(6)取VmL反应后的溶液(反应前后体积不变)于碘量瓶中,滴入3滴淀粉溶液,用a mol•L-1的标准碘溶 液滴定至终点时,消耗碘水的体积为b mL,则(NH4 )2SO3的转化率为
您最近一年使用:0次
6 . PCl3是磷的常见氯化物,可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
(一)制备
如图是实验室制备PCl3的装置(部分仪器已省略)。
(1)仪器乙的名称是________ ;其中,与自来水进水管连接的接口编号是________ 。(填“a”或“b”)
(2)实验室制备Cl2的离子方程式___________________________ 。实验过程中,为减少PCl5的生成,应控制____________ 。
(3)碱石灰的作用:一是防止空气中的水蒸气进入而使PCl3水解,影响产品的纯度;二是_________ 。
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间CO2排尽装置中的空气,其目的是________ 。
(二)分析
测定产品中PCl3纯度的方法如下:迅速称取4.100 g产品,水解完全后配成500 mL溶液,取出25.00 mL加入过量的0.100 0 mol·L-1 20.00 mL碘溶液,充分反应后再用0.100 0 mol·L-1 Na2S2O3溶液滴定过量的碘,终点时消耗12.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2===H3PO4+2HI;I2+2Na2S2O3===2NaI+Na2S4O6;假设测定过程中没有其他反应。
(5)根据上述数据,该产品中PCl3(相对分子质量为137.5)的质量分数为________ 。若滴定终点时俯视读数,则PCl3的质量分数________ (填“偏大”“偏小”或“无影响”)。
(三)探究
(6)设计实验证明PCl3具有还原性:_____________________________________ 。(限选试剂有:蒸馏水、稀盐酸、碘水、淀粉)
| 熔点/℃ | 沸点/℃ | 密度/ g·mL-1 | 其他 | |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P+3Cl2(少量)  2PCl3;2P+5Cl2(过量) 2PCl3;2P+5Cl2(过量)  2PCl5 2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
如图是实验室制备PCl3的装置(部分仪器已省略)。
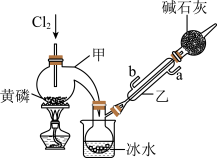
(1)仪器乙的名称是
(2)实验室制备Cl2的离子方程式
(3)碱石灰的作用:一是防止空气中的水蒸气进入而使PCl3水解,影响产品的纯度;二是
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间CO2排尽装置中的空气,其目的是
(二)分析
测定产品中PCl3纯度的方法如下:迅速称取4.100 g产品,水解完全后配成500 mL溶液,取出25.00 mL加入过量的0.100 0 mol·L-1 20.00 mL碘溶液,充分反应后再用0.100 0 mol·L-1 Na2S2O3溶液滴定过量的碘,终点时消耗12.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2===H3PO4+2HI;I2+2Na2S2O3===2NaI+Na2S4O6;假设测定过程中没有其他反应。
(5)根据上述数据,该产品中PCl3(相对分子质量为137.5)的质量分数为
(三)探究
(6)设计实验证明PCl3具有还原性:
您最近一年使用:0次
2019-10-02更新
|
129次组卷
|
2卷引用:河北省大名县第一中学(清北班,一)2020届高三9月月考化学试题
名校
7 . 研究小组用下图装置制取 ,证明产生的气体中含有HCl。
,证明产生的气体中含有HCl。
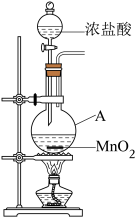
(1)仪器A的名称为____ ;A中反应的离子方程式为_____ 。
(2)甲同学将A中产生的气体通入下列溶液:
①实验a中的现象为_____ 。
②不能证明产生的气体中含有 的实验是
的实验是____ (填字母序号).
(3)已知将 气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有
气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有 ,结合化学用语解释其原因:
,结合化学用语解释其原因:_____ 。
(4)已知: 。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有
。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有 。
。
Ⅰ.测定X中溶解的 .取
.取 溶液X,加入过量KI溶液,然后用
溶液X,加入过量KI溶液,然后用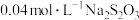 ,溶液滴定生成的
,溶液滴定生成的 ,达滴定终点时消耗
,达滴定终点时消耗 溶液
溶液 。
。
Ⅱ.测定X中 元素总量.另取
元素总量.另取 溶液X,选用适当的还原剂将溶解的
溶液X,选用适当的还原剂将溶解的 全部还原为
全部还原为 ,再用
,再用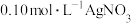 溶液滴定所得溶液中的
溶液滴定所得溶液中的 。
。
由Ⅰ、Ⅱ中实验数据可证明A中产生的气体中含有 ,则Ⅱ中消耗
,则Ⅱ中消耗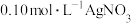 溶液的体积应大于
溶液的体积应大于___ mL(用含V的代数式表示)。
 ,证明产生的气体中含有HCl。
,证明产生的气体中含有HCl。
(1)仪器A的名称为
(2)甲同学将A中产生的气体通入下列溶液:
| 实验序号 | 试剂 | 现象 |
| a | 紫色石蕊溶液 | ___________ |
| b |  溶液 溶液 | 出现白色沉淀 |
②不能证明产生的气体中含有
 的实验是
的实验是(3)已知将
 气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有
气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有 ,结合化学用语解释其原因:
,结合化学用语解释其原因:(4)已知:
 。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有
。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有 。
。Ⅰ.测定X中溶解的
 .取
.取 溶液X,加入过量KI溶液,然后用
溶液X,加入过量KI溶液,然后用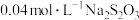 ,溶液滴定生成的
,溶液滴定生成的 ,达滴定终点时消耗
,达滴定终点时消耗 溶液
溶液 。
。Ⅱ.测定X中
 元素总量.另取
元素总量.另取 溶液X,选用适当的还原剂将溶解的
溶液X,选用适当的还原剂将溶解的 全部还原为
全部还原为 ,再用
,再用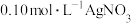 溶液滴定所得溶液中的
溶液滴定所得溶液中的 。
。由Ⅰ、Ⅱ中实验数据可证明A中产生的气体中含有
 ,则Ⅱ中消耗
,则Ⅱ中消耗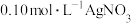 溶液的体积应大于
溶液的体积应大于
您最近一年使用:0次
8 . 某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用下图所示装置进行实验。
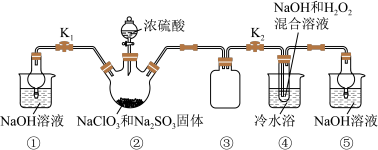
(1)装置③的作用是______________________________ 。
(2)装置②中产生ClO2的化学方程式为________________________________ 。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③______________ ;④低于60 ℃干燥,得到成品。
(4)装置①、⑤的作用是______________________________ 。
(5)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象:取少量晶体溶于蒸馏水,___________________________________ 。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+===2H2O+2I2+Cl-)。将所得混合液配成100 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2+2S2O32-===2I-+S4O62-)。
(6)滴定中使用的指示剂是______________ ,达到滴定终点时的现象为__________ 。
(7)样品中NaClO2的质量分数为______________ (用含m、c、V的代数式表示)。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用下图所示装置进行实验。
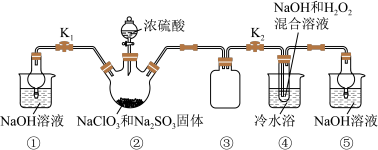
(1)装置③的作用是
(2)装置②中产生ClO2的化学方程式为
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③
(4)装置①、⑤的作用是
(5)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象:取少量晶体溶于蒸馏水,
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+===2H2O+2I2+Cl-)。将所得混合液配成100 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2+2S2O32-===2I-+S4O62-)。
(6)滴定中使用的指示剂是
(7)样品中NaClO2的质量分数为
您最近一年使用:0次
名校
9 . 已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/L KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______ (填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______ (填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________ 。
(4)计算H2C2O4溶液的物质的量浓度为__________ mol/L。
Ⅱ.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
请回答:
(5)表中v1=______ 。
(6)实验中需要测量的数据是______________________________ 。
(7)实验中______ (填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________ 。
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/L KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会
(3)步骤②中到达滴定终点时的现象为
(4)计算H2C2O4溶液的物质的量浓度为
Ⅱ.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
| 实验序号 | 体积V/mL | |||
| 0.1mol•L-1KMnO4溶液 | 0.11mol•L-1H2C2O4溶液 | 0.11mol•L-1H2SO4溶液 | H2O | |
| ① | 2.0 | 5.0 | 6.0 | 7.0 |
| ② | 2.0 | 8.0 | 6.0 | V1 |
| ③ | 2.0 | V2 | 6.0 | 2.0 |
(5)表中v1=
(6)实验中需要测量的数据是
(7)实验中
您最近一年使用:0次
2019-06-28更新
|
898次组卷
|
7卷引用:2016-2017学年河北省张家口市高二上学期期末考试化学试卷
名校
10 . 用沉淀滴定法快速测定NaI等碘化物溶液中c(I-),实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100mL0.1000mol·L-1NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00mL于锥形瓶中。
b.加入25.00mL0.1000mol·L-1AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.1000mol·L-1NH4SCN溶液滴定过量的Ag+,已知AgSCN为白色沉淀。
e.重复上述操作两次到三次测定数据如下表:
f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有________ 。制得AgNO3溶液的浓度为__________________ ;
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是________________________ 。
(3)滴定应在pH<0.5的条件下进行,其原因是________ 。
(4)过程Ⅱ中b和c两步操作是否可以颠倒________ ,说明理由:___________ 。
(5)达到滴定终点时的现象________________________ 。
(6)由上述实验数据测得c(I-)=________ mol·L-1。
(7)若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则对c(I-)测定结果的影响________ (填“偏高”“偏低”或“无影响”)。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100mL0.1000mol·L-1NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00mL于锥形瓶中。
b.加入25.00mL0.1000mol·L-1AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.1000mol·L-1NH4SCN溶液滴定过量的Ag+,已知AgSCN为白色沉淀。
e.重复上述操作两次到三次测定数据如下表:
| 实验序号 | 1 | 2 | 3 |
| 消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是
(3)滴定应在pH<0.5的条件下进行,其原因是
(4)过程Ⅱ中b和c两步操作是否可以颠倒
(5)达到滴定终点时的现象
(6)由上述实验数据测得c(I-)=
(7)若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则对c(I-)测定结果的影响
您最近一年使用:0次
2019-04-25更新
|
370次组卷
|
2卷引用:【全国百强校】河北省石家庄市第二中学2019届高三下学期4月月考理科综合化学试题



