1 . 下列由实验现象所得结论错误的是
A.向NaHSO3溶液中滴加氢硫酸,产生淡黄色沉淀,证明HSO 具有氧化性 具有氧化性 |
| B.向酸性KMnO4溶液中加入Fe3O4粉末,紫色褪去,证明Fe3O4中含Fe(Ⅱ) |
| C.向NaClO溶液中滴加酚酞试剂,先变红后褪色,证明NaClO溶液中存在HClO分子 |
| D.向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2 |
您最近一年使用:0次
名校
解题方法
2 . 某同学在实验室选用下列实验装置,验证浓硫酸与碳反应的生成物。下列说法正确的是
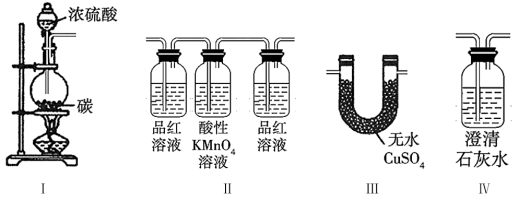

| A.浓硫酸与碳反应中,浓硫酸表现出酸性和强氧化性 |
| B.验证产物的正确连接顺序为: I→IV→III→II |
| C.装置II中两侧品红溶液在实验设计中的作用不相同 |
| D.若连接顺序为I→II→III→IV,无法检验产物中有无CO2 |
您最近一年使用:0次
2021-05-28更新
|
765次组卷
|
14卷引用:江西省宜春市奉新县冶城职业学校(奉新县第三中学)2020-2021学年高三上学期期末考试化学(普高)试题
江西省宜春市奉新县冶城职业学校(奉新县第三中学)2020-2021学年高三上学期期末考试化学(普高)试题江西省宜春市万载中学2021-2022学年高一下学期3月月考化学试题安徽省滁州市定远县2021届高三上学期第二次联考化学试题山东省泰安市2021届高考第一次模拟化学试题黑龙江省大庆市东风中学2020-2021学年高一下学期开学考试化学试题武汉市江夏实验高中2020-2021学年高一下学期3月月考化学试题河北省石家庄正中实验中学2020-2021学年高一第二学期第一次月考化学试题(已下线)专题12 硫及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练河北正定中学2020-2021学年高一下学期第一次月考化学试题(已下线)专题11 化学实验基础-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省济南大学城实验高中2021-2022学年高三2月阶段性调研化学试题山东省菏泽市单县第二中学2021-2022学年高一上学期1月段考(实验班)化学试题(已下线)第4讲 浓硫酸 不同价态含硫物质的转化黑龙江省大庆市大庆中学2023-2024学年高二上学期开学考试化学试题
3 . 甲醛(HCHO)是无色气体,易溶于水,有特殊的刺激性气味,对人眼、鼻等有刺激作用。40%甲醛溶液沸点为96℃,易挥发。甲醛在碱性溶液中具有极强的还原性。为探究过量甲醛和新制 反应的产物成分,进行如下研究:
反应的产物成分,进行如下研究:
(1)在如图装置中进行实验,向a中加入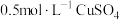 溶液50mL和
溶液50mL和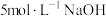 溶液100mL ,振荡,再加入40%的甲醛溶液40mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。
溶液100mL ,振荡,再加入40%的甲醛溶液40mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。
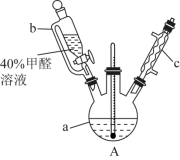
①仪器b的名称是_______ 。
②仪器c的作用为_______ 。
③能说明甲醛具有还原性的实验现象是_______ 。
(2)查阅资料发现气体产物是副反应产生的。为确认气体产物中含 不含CO,将装置A和如图所示的装置连接后进行实验。
不含CO,将装置A和如图所示的装置连接后进行实验。
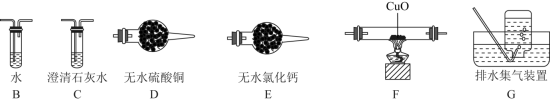
①依次连接的合理顺序为:A→B→_______→_______→_______→_______→G。______
②装置B的作用是_______ 。
③确认气体产物中含 而不含CO的现象是
而不含CO的现象是_______ 。
 反应的产物成分,进行如下研究:
反应的产物成分,进行如下研究:(1)在如图装置中进行实验,向a中加入
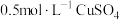 溶液50mL和
溶液50mL和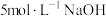 溶液100mL ,振荡,再加入40%的甲醛溶液40mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。
溶液100mL ,振荡,再加入40%的甲醛溶液40mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。
①仪器b的名称是
②仪器c的作用为
③能说明甲醛具有还原性的实验现象是
(2)查阅资料发现气体产物是副反应产生的。为确认气体产物中含
 不含CO,将装置A和如图所示的装置连接后进行实验。
不含CO,将装置A和如图所示的装置连接后进行实验。
①依次连接的合理顺序为:A→B→_______→_______→_______→_______→G。
②装置B的作用是
③确认气体产物中含
 而不含CO的现象是
而不含CO的现象是
您最近一年使用:0次
名校
解题方法
4 . 某研究小组设计如下所示实验装置(夹持装置已略去)分别探究NO与铜粉、Na2O2的反应。
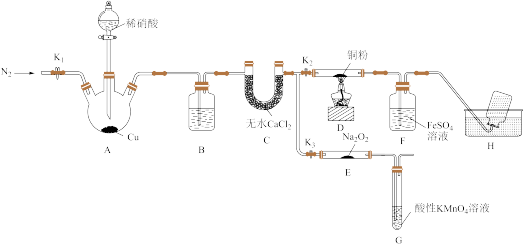
已知:①NO与Na2O2可发生反应2NO+Na2O2=2NaNO2。
②NO能被酸性高锰酸钾溶液氧化为
③在溶液中存在平衡FeSO4+NO⇌Fe(NO)SO4(棕色)
I.关闭K3,打开K2,探究NO与铜粉的反应并检验NO。
(1)反应开始前,打开K1,通入一段时间N2,其目的是_______ 。
(2)装置B中盛放的试剂为水,其作用是_______ 。
(3)装置F中的实验现象为_______ 。装置H中收集的气体为_______ (填化学式)。
(4)铜与稀硝酸反应的离子方程式为_______
II.关闭K2,打开K3,探究NO与Na2O2的反应并制备NaNO2。
(5)装置G的作用是_______ 。
(6)若省略装置C,则进入装置G中的气体除N2、NO外,可能还有_______ (填化学式)。
(7)测定反应后装置E中NaNO2的含量。已知;在酸性条件下, 可将
可将 还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。
还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。
①滴定过程中发生反应的离子方程式为_______ 。
②滴定过程中酸性KMnO4溶液的作用是_______ 。
③样品中NaNO2的质量分数为_______ 用含有a、b的代数式表示)。该实验要迅速操作,否则测定结果会偏小,原因是_______ 。

已知:①NO与Na2O2可发生反应2NO+Na2O2=2NaNO2。
②NO能被酸性高锰酸钾溶液氧化为

③在溶液中存在平衡FeSO4+NO⇌Fe(NO)SO4(棕色)
I.关闭K3,打开K2,探究NO与铜粉的反应并检验NO。
(1)反应开始前,打开K1,通入一段时间N2,其目的是
(2)装置B中盛放的试剂为水,其作用是
(3)装置F中的实验现象为
(4)铜与稀硝酸反应的离子方程式为
II.关闭K2,打开K3,探究NO与Na2O2的反应并制备NaNO2。
(5)装置G的作用是
(6)若省略装置C,则进入装置G中的气体除N2、NO外,可能还有
(7)测定反应后装置E中NaNO2的含量。已知;在酸性条件下,
 可将
可将 还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。
还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。①滴定过程中发生反应的离子方程式为
②滴定过程中酸性KMnO4溶液的作用是
③样品中NaNO2的质量分数为
您最近一年使用:0次
名校
5 . 锰的化合物种类较多,大多具有广泛的用途。
Ⅰ.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
该小组设计了如下4个方案以验证MnO2的氧化性,可行的是__________ (填序号)。
把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
Na2SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL0.2mol/L NaOH溶液、1mL水、1mL0.1mol/L稀硫酸。现象记录如表所示:
①从以上实验中,我们可以得出的结论是_____________________ 。
②写出C试管中发生反应的离子方程式:_______________________ 。
Ⅱ.铁酸锰(MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如图:
已知:Fe3+、Mn2+沉淀的pH如表格所示。
步骤一中投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比理论上应为_________________ 。
步骤二中需控制pH的范围是_________________ 。
步骤三中是否洗涤干净的判断方法是_____________________ 。
Ⅰ.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
该小组设计了如下4个方案以验证MnO2的氧化性,可行的是
把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
Na2SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL0.2mol/L NaOH溶液、1mL水、1mL0.1mol/L稀硫酸。现象记录如表所示:
| 试管编号 | 实验现象 |
| A | 溶液不变色 |
| B | 溶液缓慢变浅棕褐色 |
| C | 溶液迅速变棕褐色 |
①从以上实验中,我们可以得出的结论是
②写出C试管中发生反应的离子方程式:
Ⅱ.铁酸锰(MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如图:
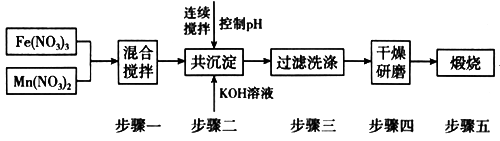
已知:Fe3+、Mn2+沉淀的pH如表格所示。
| 开始沉淀 | 完全沉淀 | |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
步骤二中需控制pH的范围是
步骤三中是否洗涤干净的判断方法是
您最近一年使用:0次
2017-03-06更新
|
59次组卷
|
2卷引用:2016-2017学年江西省景德镇市第一中学高二(素质班)上学期期末考试化学试卷
10-11高三上·浙江杭州·期中
6 . 某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性。

(1)为完成上述实验,正确的连接顺序为A连_______ ;B连_______ (填写连接的字母)。
(2)对硬质玻璃管里的氧化铜粉末加热前,需要的操作为________________ 。
(3)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是_____________ ,对应的现象为___________________________________________________ 。
(4)丙装置的c瓶中盛放的试剂为_____________ ,作用是____________________ 。
(5)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案
精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g,实验完毕后
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g,进而确定Cu的相对原子质量。
乙方案:通过精确测定生成水的质量d g,进而确定Cu的相对原子质量。
①请你分析并回答:________ 方案测得结果更准确。你认为不合理的方案的不足之处在________________________________ 。
②按测得结果更准确的方案进行计算,Cu的相对原子质量___________________ 。

(1)为完成上述实验,正确的连接顺序为A连
(2)对硬质玻璃管里的氧化铜粉末加热前,需要的操作为
(3)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是
(4)丙装置的c瓶中盛放的试剂为
(5)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案
精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g,实验完毕后
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g,进而确定Cu的相对原子质量。
乙方案:通过精确测定生成水的质量d g,进而确定Cu的相对原子质量。
①请你分析并回答:
②按测得结果更准确的方案进行计算,Cu的相对原子质量
您最近一年使用:0次
7 . 铁氰化钾 是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验
是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验 。某小组拟设计实验制备铁氰化钾并探究其性质。
。某小组拟设计实验制备铁氰化钾并探究其性质。
实验(一)制备铁氰化钾。以亚铁氰化钾为原料采用氧化法制备铁氰化钾,装置如图所示。
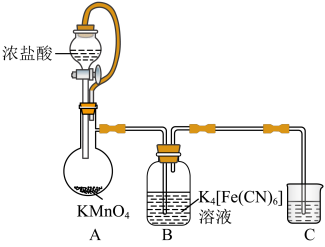
(1)装置A中橡胶管的作用是___________ 。装置C中试剂可能是___________ 。
(2)装置B中化学方程式为___________ 。
(3)从装置B中分离产品,可采用___________ 、降温结晶、___________ 、洗涤、干燥一系列操作。
实验(二)探究 性质。
性质。
【资料显示】
配合物在水中能完全电离出外界和内界,例如: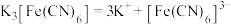 。
。
【提出问题】
 能否电离?
能否电离?
【提出猜想】
猜想1:不能电离;猜想2:能部分电离(存在电离平衡);猜想3:___________。
【设计实验】
(4)猜想3的横线上应填___________ ,综合上述实验分析,可知:猜想___________ 成立。
(5)用方程式和必要的文字分析实验②现象:___________ ,写出产生蓝色沉淀的离子方程式:___________ 。
 是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验
是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验 。某小组拟设计实验制备铁氰化钾并探究其性质。
。某小组拟设计实验制备铁氰化钾并探究其性质。实验(一)制备铁氰化钾。以亚铁氰化钾为原料采用氧化法制备铁氰化钾,装置如图所示。

(1)装置A中橡胶管的作用是
(2)装置B中化学方程式为
(3)从装置B中分离产品,可采用
实验(二)探究
 性质。
性质。【资料显示】
配合物在水中能完全电离出外界和内界,例如:
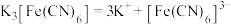 。
。【提出问题】
 能否电离?
能否电离?【提出猜想】
猜想1:不能电离;猜想2:能部分电离(存在电离平衡);猜想3:___________。
【设计实验】
| 实验 | 实验操作及现象 |
| ① | 向浓度均为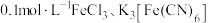 的混合溶液中插入一根无锈铁丝,立即产生蓝色沉淀 的混合溶液中插入一根无锈铁丝,立即产生蓝色沉淀 |
| ② | 向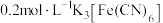 溶液插入一根无锈铁丝(与①相同),一段时间后,溶液产生蓝色 溶液插入一根无锈铁丝(与①相同),一段时间后,溶液产生蓝色 |
(4)猜想3的横线上应填
(5)用方程式和必要的文字分析实验②现象:
您最近一年使用:0次
解题方法
8 . 过硫酸钠(Na2S2O8)具有极强的氧化性,且不稳定,某化学兴趣小组探究过硫酸钠的相关性质,实验如下。已知SO3是无色易挥发的固体,熔点16.8℃,沸点44.8℃。
(1)稳定性探究(装置如图):
分解原理:2Na2S2O8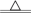 2Na2SO4+2SO3↑+O2↑。
2Na2SO4+2SO3↑+O2↑。
此装置有明显错误之处,请改正:______________________ ,水槽冰水浴的目的是____________________ ;带火星的木条的现象_______________ 。

(2)过硫酸钠在酸性环境下,在Ag+的催化作用下可以把Mn2+氧化为紫红色的离子,所得溶液加入BaCl2可以产生白色沉淀,该反应的离子方程式为______________________ ,该反应的氧化剂是______________ ,氧化产物是________ 。
(3)向上述溶液中加入足量的BaCl2,过滤后对沉淀进行洗涤的操作是___________________________ 。
(4)可用H2C2O4溶液滴定产生的紫红色离子,取20mL待测液,消耗0.1mol·L-1的H2C2O4溶液30mL,则上述溶液中紫红色离子的浓度为______ mol·L-1,若Na2S2O8有剩余,则测得的紫红色离子浓度将________ (填“偏高”“偏低”或“不变”)。
(1)稳定性探究(装置如图):
分解原理:2Na2S2O8
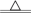 2Na2SO4+2SO3↑+O2↑。
2Na2SO4+2SO3↑+O2↑。此装置有明显错误之处,请改正:

(2)过硫酸钠在酸性环境下,在Ag+的催化作用下可以把Mn2+氧化为紫红色的离子,所得溶液加入BaCl2可以产生白色沉淀,该反应的离子方程式为
(3)向上述溶液中加入足量的BaCl2,过滤后对沉淀进行洗涤的操作是
(4)可用H2C2O4溶液滴定产生的紫红色离子,取20mL待测液,消耗0.1mol·L-1的H2C2O4溶液30mL,则上述溶液中紫红色离子的浓度为
您最近一年使用:0次
2020-04-25更新
|
296次组卷
|
3卷引用:江西省都昌蔡岭慈济中学2020届高三5月月考理综化学试题
江西省都昌蔡岭慈济中学2020届高三5月月考理综化学试题辽宁省丹东市2020届高三第一次模拟考试理科综合化学试题(已下线)专题40 硫的含氧酸盐-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
名校
9 . 某化学兴趣小组查阅资料后制备过氧化钠,并设计实验验证其相关性质。
(1)某小组查阅资料发现, 用途广泛,写出
用途广泛,写出 的一种用途;
的一种用途;___________ ; 能与盐酸发生剧烈反应,写出该反应的化学方程式:
能与盐酸发生剧烈反应,写出该反应的化学方程式:___________ 。
(2)某小组同学取一定量淡黄色固体粉末溶于冷水中,待固体粉末全部反应后,仍可缓慢释放出气体。为探究该固体粉末溶解后的溶液成分,设计如下实验:

①如何证明乙中产生的气体是什么物质?___________ 。
②乙→丙过程说明固体粉末溶解后溶液中含有___________ (填化学式), 在丙中的作用是
在丙中的作用是___________ 。
(3)为验证 与
与 能否反应,该小组同学设计如下实验:
能否反应,该小组同学设计如下实验:
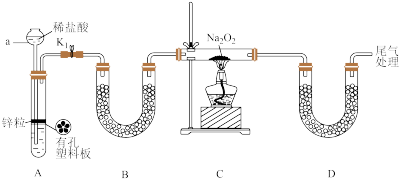
①仪器a的名称是___________ ;装置B的作用是___________ 。
②若 与
与 能反应产生
能反应产生 ,该实验装置C、D之间还缺少检验反应产物
,该实验装置C、D之间还缺少检验反应产物 的装置,缺少的仪器和药品是
的装置,缺少的仪器和药品是___________ 。
(1)某小组查阅资料发现,
 用途广泛,写出
用途广泛,写出 的一种用途;
的一种用途; 能与盐酸发生剧烈反应,写出该反应的化学方程式:
能与盐酸发生剧烈反应,写出该反应的化学方程式:(2)某小组同学取一定量淡黄色固体粉末溶于冷水中,待固体粉末全部反应后,仍可缓慢释放出气体。为探究该固体粉末溶解后的溶液成分,设计如下实验:

①如何证明乙中产生的气体是什么物质?
②乙→丙过程说明固体粉末溶解后溶液中含有
 在丙中的作用是
在丙中的作用是(3)为验证
 与
与 能否反应,该小组同学设计如下实验:
能否反应,该小组同学设计如下实验:
①仪器a的名称是
②若
 与
与 能反应产生
能反应产生 ,该实验装置C、D之间还缺少检验反应产物
,该实验装置C、D之间还缺少检验反应产物 的装置,缺少的仪器和药品是
的装置,缺少的仪器和药品是
您最近一年使用:0次
名校
10 . 某研究小组设计如图所示实验装置(夹持装置已略去)分别探究NO与铜粉、Na2O2的反应。
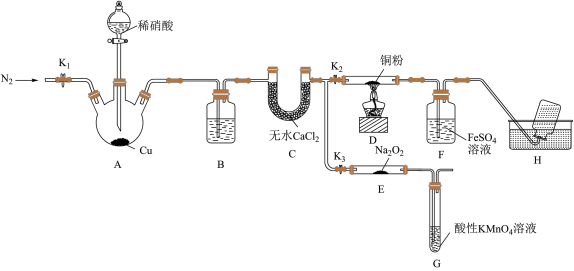
已知:①NO与Na2O2可发生反应2NO+Na2O2 =2NaNO2。
②NO、NO 能被酸性高锰酸钾溶液氧化为
能被酸性高锰酸钾溶液氧化为
③在溶液中存在平衡FeSO4+NO Fe(NO)SO4(棕色)
Fe(NO)SO4(棕色)
I.关闭K3,打开K2,探究NO与铜粉的反应并检验NO。
(1)反应开始前,打开K1,通入一段时间N2,其目的是________ 。
(2)装置B中盛放的试剂为水,其作用是________ 。
(3)装置F中的实验现象为______ 。装置H中收集的气体为N2和_______ (填化学式)。
Ⅱ.关闭K2,打开K3,探究NO与Na2O2的反应并制备NaNO2。
(4)装置G的作用是________ 。
(5)若省略装置C,则进入装置G中的气体除N2、NO外,可能还有NO2和_____ (填化学式)。
(6)测定反应后装置E中NaNO2的含量。已知;在酸性条件下,NO 可将MnO
可将MnO 还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。
还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。
①判断滴定终点的方法________ 。
②样品中NaNO2的质量分数为___________ (用含有a、b的代数式表示)。
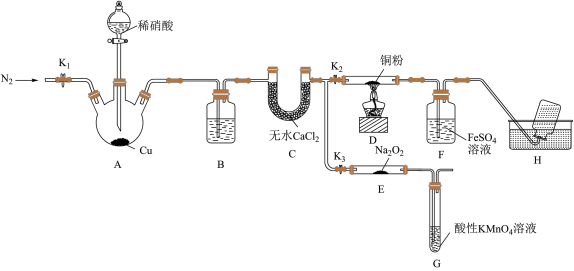
已知:①NO与Na2O2可发生反应2NO+Na2O2 =2NaNO2。
②NO、NO
 能被酸性高锰酸钾溶液氧化为
能被酸性高锰酸钾溶液氧化为
③在溶液中存在平衡FeSO4+NO
 Fe(NO)SO4(棕色)
Fe(NO)SO4(棕色)I.关闭K3,打开K2,探究NO与铜粉的反应并检验NO。
(1)反应开始前,打开K1,通入一段时间N2,其目的是
(2)装置B中盛放的试剂为水,其作用是
(3)装置F中的实验现象为
Ⅱ.关闭K2,打开K3,探究NO与Na2O2的反应并制备NaNO2。
(4)装置G的作用是
(5)若省略装置C,则进入装置G中的气体除N2、NO外,可能还有NO2和
(6)测定反应后装置E中NaNO2的含量。已知;在酸性条件下,NO
 可将MnO
可将MnO 还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。
还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。①判断滴定终点的方法
②样品中NaNO2的质量分数为
您最近一年使用:0次
2020-11-04更新
|
690次组卷
|
5卷引用:【南昌新东方】8. 2020 高三 南昌十中 期中 刘志平



