已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(1)下列离子中,最容易结合H+的是___________ (用编号填写)
a.CH3COO- b. c.CN- d.
c.CN- d.
(2)常温下,0.1 mol·L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是___________ (填字母)
A.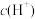 B.
B. C.
C.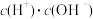 D.
D.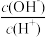 E.
E.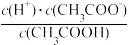
(3)写出向NaCN溶液中通入少量二氧化碳的离子方程式:___________
(4)25℃时,CH3COOH与CH3COONa混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=___________ (填准确数值)。
(5)标准状况下,将1.12 L CO2通入100 mL 1 mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+___________ 。
| 化学式 | CH3COOH | H2CO3 | HCN |
| 电离平衡常数 | 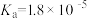 | 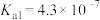  | K=4.9×10-10 |
(1)下列离子中,最容易结合H+的是
a.CH3COO- b.
 c.CN- d.
c.CN- d.
(2)常温下,0.1 mol·L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是
A.
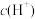 B.
B. C.
C.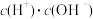 D.
D.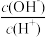 E.
E.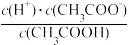
(3)写出向NaCN溶液中通入少量二氧化碳的离子方程式:
(4)25℃时,CH3COOH与CH3COONa混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=
(5)标准状况下,将1.12 L CO2通入100 mL 1 mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+
更新时间:2021-01-07 11:21:26
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】水的电离平衡曲线如图所示:
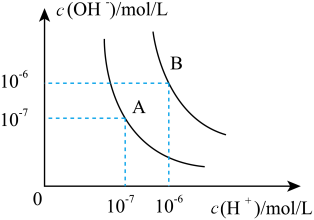
(1)若以A点表示25℃时水的电离平衡时的离子的浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从_______ 增加到_______ ,造成水的离子积增大的原因是_______ 。
(2)恒温下,向pH=6的蒸馏水中加入2.3g的金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=_______ 。
(3)向pH=6的蒸馏水和c(H+)=10-6 mol·L-1的稀盐酸中分别加入大小、质量相同的金属钠,反应刚开始时,产生H2的速率前者与后者相比是_______(填序号)
(4)25℃时,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是_______。

(5)100℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合, 若所得混合溶液pH=7,则NaOH溶液与硫酸溶液的体积比为_______ 。

(1)若以A点表示25℃时水的电离平衡时的离子的浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从
(2)恒温下,向pH=6的蒸馏水中加入2.3g的金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=
(3)向pH=6的蒸馏水和c(H+)=10-6 mol·L-1的稀盐酸中分别加入大小、质量相同的金属钠,反应刚开始时,产生H2的速率前者与后者相比是_______(填序号)
| A.一样快 | B.前者快 | C.后者快 | D.无法比较 |

| A.X、Y两种碱溶液中溶质的物质的量浓度一定相等 |
| B.稀释后,X溶液的碱性比Y溶液的碱性强 |
| C.分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积VX>VY |
| D.若8<a<10,则X、Y都是弱碱 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】Ⅰ.在某温度( )的水溶液中,
)的水溶液中,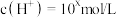 ,
,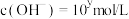 ,x与y关系如图所示。
,x与y关系如图所示。
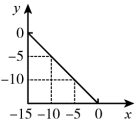
(1)该温度下,水的离子积为_______ ,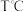
_______ 25℃(填“大于”“小于”或“等于”)。
(2)将此温度下 的
的 溶液与
溶液与 的
的 溶液等体积混合,混合后溶液的
溶液等体积混合,混合后溶液的 约为
约为_______ (已知 )。
)。
Ⅱ. 俗称砒霜,可作长效杀虫剂、杀菌剂和除草剂,在医疗上还可用于治疗急性白血病.测定某
俗称砒霜,可作长效杀虫剂、杀菌剂和除草剂,在医疗上还可用于治疗急性白血病.测定某 粗产品(含
粗产品(含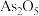 杂质)中
杂质)中 的质量分数实验过程如下:
的质量分数实验过程如下:
①称取0.2g粗产品完全溶解于适量的 溶液后,配制成含
溶液后,配制成含 、
、 的混合溶液100mL。
的混合溶液100mL。
②分别移取25.00mL上述溶液于锥形瓶中,用 的
的 标准溶液进行滴定(在碱性环境中
标准溶液进行滴定(在碱性环境中 可将
可将 氧化为
氧化为 ,指示剂为淀粉).每次滴定开始时液面读数如图a所示,3次滴定结束时,
,指示剂为淀粉).每次滴定开始时液面读数如图a所示,3次滴定结束时, 标准溶液液面读数如图b~d所示。
标准溶液液面读数如图b~d所示。
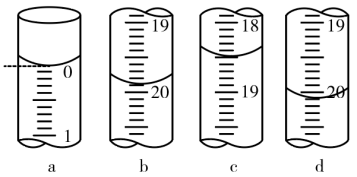
回答下列问题:
(3)配制成含 、
、 的的混合溶液时用到的定量仪器为
的的混合溶液时用到的定量仪器为_______ 。
(4)滴定时将 标准溶液装在如图中的
标准溶液装在如图中的_______ (填“甲”或“乙”)滴定管中。
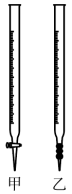
(5)滴定终点的现象是_______ 。
(6)碱性环境中 将
将 氧化为
氧化为 的离子方程式是
的离子方程式是_______ 。
(7)粗产品中 的质量分数为
的质量分数为_______ 。若测定结果偏高,其原因可能是_______ (填字母)
A滴定管用蒸馏水洗净后未用标准溶液润洗
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水清洗后再用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
 )的水溶液中,
)的水溶液中,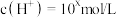 ,
, ,x与y关系如图所示。
,x与y关系如图所示。
(1)该温度下,水的离子积为
(2)将此温度下
 的
的 溶液与
溶液与 的
的 溶液等体积混合,混合后溶液的
溶液等体积混合,混合后溶液的 约为
约为 )。
)。Ⅱ.
 俗称砒霜,可作长效杀虫剂、杀菌剂和除草剂,在医疗上还可用于治疗急性白血病.测定某
俗称砒霜,可作长效杀虫剂、杀菌剂和除草剂,在医疗上还可用于治疗急性白血病.测定某 粗产品(含
粗产品(含 杂质)中
杂质)中 的质量分数实验过程如下:
的质量分数实验过程如下:①称取0.2g粗产品完全溶解于适量的
 溶液后,配制成含
溶液后,配制成含 、
、 的混合溶液100mL。
的混合溶液100mL。②分别移取25.00mL上述溶液于锥形瓶中,用
 的
的 标准溶液进行滴定(在碱性环境中
标准溶液进行滴定(在碱性环境中 可将
可将 氧化为
氧化为 ,指示剂为淀粉).每次滴定开始时液面读数如图a所示,3次滴定结束时,
,指示剂为淀粉).每次滴定开始时液面读数如图a所示,3次滴定结束时, 标准溶液液面读数如图b~d所示。
标准溶液液面读数如图b~d所示。
回答下列问题:
(3)配制成含
 、
、 的的混合溶液时用到的定量仪器为
的的混合溶液时用到的定量仪器为(4)滴定时将
 标准溶液装在如图中的
标准溶液装在如图中的
(5)滴定终点的现象是
(6)碱性环境中
 将
将 氧化为
氧化为 的离子方程式是
的离子方程式是(7)粗产品中
 的质量分数为
的质量分数为A滴定管用蒸馏水洗净后未用标准溶液润洗
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水清洗后再用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】酸、碱、盐的水溶液在生产生活及化学实验中有广泛的应用,请同学们运用所学知识解决下列问题。
(1)某温度 T 下,0.1mol/L 的 NaOH 溶液中,c(H+)=1.0×10- 11mol/L,此时水的离子积常数 Kw=_______ 。温度 T_______ 25℃(填“大于”“小于”或“等于”) ,原因是_______ 。
(2)已知水溶液中 c(H+)和 c(OH-)的关系如图所示:
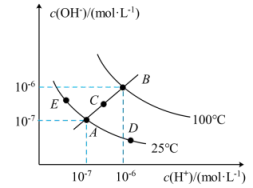
①图中 A 、B 、C 、D 四点对应的水的离子积常数由大到小的顺序是_______ 。
②若 A 点到 E 点,可采用的措施是_______ (填序号,下同);从 A 点到 C 点,可采用的措 施是_______ ;促进水的电离平衡的措施是_______ 。(以上填序号)
a.升温 b.加入少量的盐酸 c.加入少量的 NaOH
(3)常温下 0. 1mol/L 的 HA 溶液中,c(H+)=0.001mol/L ,写出 HA 的电离方程式_______ ,水 电离的 c(H+)=_______ mol/L。为使 HA 溶液中 HA 的电离平衡正向移动,而水的 Kw 保持不 变可以采取的措施是_______ 。
(1)某温度 T 下,0.1mol/L 的 NaOH 溶液中,c(H+)=1.0×10- 11mol/L,此时水的离子积常数 Kw=
(2)已知水溶液中 c(H+)和 c(OH-)的关系如图所示:

①图中 A 、B 、C 、D 四点对应的水的离子积常数由大到小的顺序是
②若 A 点到 E 点,可采用的措施是
a.升温 b.加入少量的盐酸 c.加入少量的 NaOH
(3)常温下 0. 1mol/L 的 HA 溶液中,c(H+)=0.001mol/L ,写出 HA 的电离方程式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】SO2经一系列反应可以得到硫酸和芒硝(Na2SO4·10H2O),其转化关系如图:
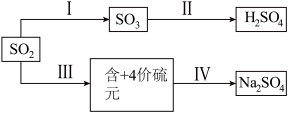
(1)SO2可用于H2SO4。已知25℃、101kPa 时:
2SO2(g)+O2(g)+2H2O(l) = 2H2SO4(l) ΔH1=-456kJ/mol
SO3(g)+H2O(l)=H2SO4(l) ΔH2=-130kJ/mol
则I中SO2(g)→SO3(g)的热化学方程式是_____ 。
(2)若Ⅲ中将SO2通入NaHCO3溶液中,反应的离子反应方程式是_____ 。已知:25℃时,H2CO3电离平衡常数:K1=4.3×10-7K2=5.6×10-11;H2SO3电离平衡常数:K1=1.5×10-2K2=6.0×10-8
(3)若Ⅲ中将SO2通入NaOH 溶液中,得到NaHSO3溶液,用化学用语表示NaHSO3在水溶液中存在的可逆过程_____ 。25℃时,SO2与NaOH溶液反应后的溶液中,含硫各微粒(H2SO3、 和
和 )的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是
)的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是_____ (填字母)。
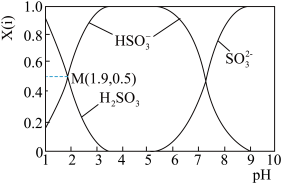
A.为获得更多的NaHSO3,应将溶液的 pH 控制在 4~5
B.pH=3 时,溶液中 c( )>c(H2SO3)> c(
)>c(H2SO3)> c( )
)
C.由 M 点坐标,可以计算H2SO3⇌H++ 的电离常数
的电离常数
D.pH=9 时,溶液中存在c(H+)=c( )+2c(
)+2c( )+c(OH-)
)+c(OH-)
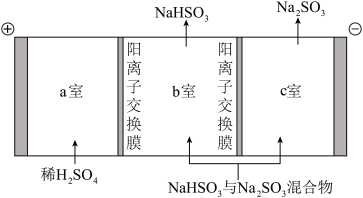
(4)通过电解法可分离NaHSO3与Na2SO3混合物,如图所示,结合化学用语解释 c 室只排出Na2SO3的原因_____ 。
(5)步骤 IV 中可以将NaHSO3转化为Na2SO4的试剂是_____ ,_____ (任意写两种)。

(1)SO2可用于H2SO4。已知25℃、101kPa 时:
2SO2(g)+O2(g)+2H2O(l) = 2H2SO4(l) ΔH1=-456kJ/mol
SO3(g)+H2O(l)=H2SO4(l) ΔH2=-130kJ/mol
则I中SO2(g)→SO3(g)的热化学方程式是
(2)若Ⅲ中将SO2通入NaHCO3溶液中,反应的离子反应方程式是
(3)若Ⅲ中将SO2通入NaOH 溶液中,得到NaHSO3溶液,用化学用语表示NaHSO3在水溶液中存在的可逆过程
 和
和 )的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是
)的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是
A.为获得更多的NaHSO3,应将溶液的 pH 控制在 4~5
B.pH=3 时,溶液中 c(
 )>c(H2SO3)> c(
)>c(H2SO3)> c( )
)C.由 M 点坐标,可以计算H2SO3⇌H++
 的电离常数
的电离常数D.pH=9 时,溶液中存在c(H+)=c(
 )+2c(
)+2c( )+c(OH-)
)+c(OH-)(4)通过电解法可分离NaHSO3与Na2SO3混合物,如图所示,结合化学用语解释 c 室只排出Na2SO3的原因

(5)步骤 IV 中可以将NaHSO3转化为Na2SO4的试剂是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】电离常数可以衡量弱电解质电离程度强弱。已知部分弱电解质的电离常数如下表:
请回答下列问题。
(1)25℃时,等浓度的a. 溶液b.
溶液b. 溶液c.NaCN溶液d.
溶液c.NaCN溶液d. 溶液,四种溶液的pH由大到小的顺序为
溶液,四种溶液的pH由大到小的顺序为___________ 。(填溶液前序号)
(2)等浓度、等体积的 溶液与
溶液与 溶液混合,溶液中
溶液混合,溶液中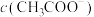
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
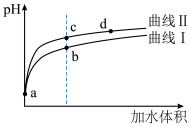
(3)将pH值和体积均相同的 溶液和HCN溶液加水稀释,pH变化如图所示,下列说法正确的是___________。
溶液和HCN溶液加水稀释,pH变化如图所示,下列说法正确的是___________。
(4)向NaCN溶液中通入少量 反应的化学方程式是
反应的化学方程式是___________ 。
(5)向0.1mol⋅L-1 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至 ,此时溶液
,此时溶液
___________ 。
(6)已知 的
的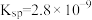 ,现将浓度为
,现将浓度为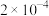 mol⋅L-1
mol⋅L-1 溶液与amol⋅L-1
溶液与amol⋅L-1 溶液等体积混合,生成
溶液等体积混合,生成 沉淀,所需
沉淀,所需 溶液的浓度a最小为
溶液的浓度a最小为___________ mol⋅L-1。
| 化学式 |  |  | HCN |  |
| 电离平衡常数(25℃) |  | 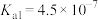  | 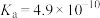 |  |
(1)25℃时,等浓度的a.
 溶液b.
溶液b. 溶液c.NaCN溶液d.
溶液c.NaCN溶液d. 溶液,四种溶液的pH由大到小的顺序为
溶液,四种溶液的pH由大到小的顺序为(2)等浓度、等体积的
 溶液与
溶液与 溶液混合,溶液中
溶液混合,溶液中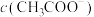
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(3)将pH值和体积均相同的
 溶液和HCN溶液加水稀释,pH变化如图所示,下列说法正确的是___________。
溶液和HCN溶液加水稀释,pH变化如图所示,下列说法正确的是___________。
| A.曲线I代表HCN溶液 | B.酸的浓度: |
C.a点有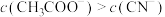 | D.水的电离程度:b点<c点 |
(4)向NaCN溶液中通入少量
 反应的化学方程式是
反应的化学方程式是(5)向0.1mol⋅L-1
 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至 ,此时溶液
,此时溶液
(6)已知
 的
的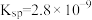 ,现将浓度为
,现将浓度为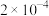 mol⋅L-1
mol⋅L-1 溶液与amol⋅L-1
溶液与amol⋅L-1 溶液等体积混合,生成
溶液等体积混合,生成 沉淀,所需
沉淀,所需 溶液的浓度a最小为
溶液的浓度a最小为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】砷(As)是第四周期ⅤA族元素,可以形成As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图:___________ 。
(2)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+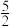 O2(g)=As2O5(s) ΔH3
O2(g)=As2O5(s) ΔH3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s) 的ΔH =___________ 。
(3)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如下左、右两图所示。
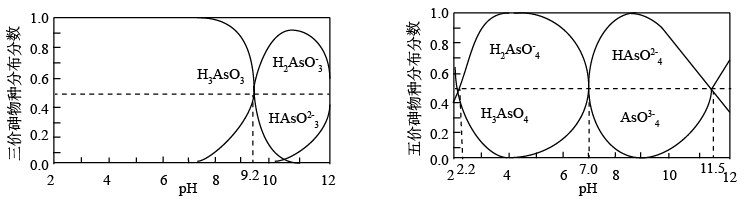
①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为___________ 。
②H3AsO4第一步电离方程式H3AsO4 H2AsO
H2AsO +H+的电离常数为Ka1,则pKa1=
+H+的电离常数为Ka1,则pKa1= ___________ (pKa1=-lgKa1)。
(4)298 K时,将一定量的Na3AsO3、I2和NaOH溶液混合,发生反应: AsO (aq)+I2(aq)+2OH-(aq)
(aq)+I2(aq)+2OH-(aq)  AsO
AsO (aq)+2I−(aq)+H2O(l) 溶液中c(AsO
(aq)+2I−(aq)+H2O(l) 溶液中c(AsO )与反应时间t的关系如图所示。
)与反应时间t的关系如图所示。
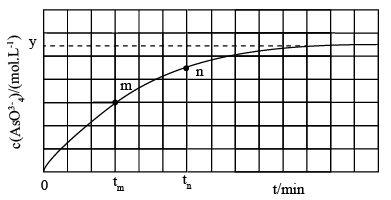
①该反应的平衡常数表达式为___________ 。
②下列可判断反应达到平衡的是___________ (填标号)。
a.溶液的pH不再变化 b. v(I-)=2v(AsO )
)
c.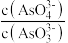 不再变化 d. c(I-)=y mol·L−1
不再变化 d. c(I-)=y mol·L−1
③tm时,v正___________ v逆(填“>”“<”或“=”)。
(1)画出砷的原子结构示意图:
(2)已知:As(s)+
 H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1H2(g)+
 O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH22As(s)+
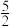 O2(g)=As2O5(s) ΔH3
O2(g)=As2O5(s) ΔH3则反应As2O5(s)+3H2O(l)=2H3AsO4(s) 的ΔH =
(3)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如下左、右两图所示。

①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为
②H3AsO4第一步电离方程式H3AsO4
 H2AsO
H2AsO +H+的电离常数为Ka1,则pKa1=
+H+的电离常数为Ka1,则pKa1= (4)298 K时,将一定量的Na3AsO3、I2和NaOH溶液混合,发生反应: AsO
 (aq)+I2(aq)+2OH-(aq)
(aq)+I2(aq)+2OH-(aq)  AsO
AsO (aq)+2I−(aq)+H2O(l) 溶液中c(AsO
(aq)+2I−(aq)+H2O(l) 溶液中c(AsO )与反应时间t的关系如图所示。
)与反应时间t的关系如图所示。
①该反应的平衡常数表达式为
②下列可判断反应达到平衡的是
a.溶液的pH不再变化 b. v(I-)=2v(AsO
 )
)c.
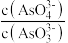 不再变化 d. c(I-)=y mol·L−1
不再变化 d. c(I-)=y mol·L−1③tm时,v正
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡,请根据所学知识回答:
I.常温下,一定浓度的 溶液的
溶液的 ,已知
,已知 的电离平衡常数
的电离平衡常数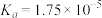 。
。
(1)乙酸钠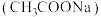 溶液呈碱性的原因是
溶液呈碱性的原因是_______ (用离子方程式表示)。 的
的 溶液中:
溶液中: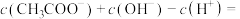
_______  。
。
Ⅱ.常温下向某氨水中缓缓通入 气体,溶液中
气体,溶液中 与
与 关系如图所示。
关系如图所示。

(2)在常温下 的电离平衡常数
的电离平衡常数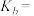
_______ (用含有a的代数式表示)。
Ⅲ. 时,向
时,向 溶液中滴加
溶液中滴加 溶液(一种酸,酸性强弱未知)时,溶液中由水电离的
溶液(一种酸,酸性强弱未知)时,溶液中由水电离的 浓度随加入的HA体积的变化如图所示:
浓度随加入的HA体积的变化如图所示:

(3)根据该图判断HA为_______ (填“强酸”或“弱酸”),理由是_______ 。
(4)若稀释a点溶液,则与稀释前相比,稀释后的溶液中水的电离程度会_______ (填“增大”、“减小”或“不变”)。
(5)d点溶液中溶质成分是_______ ,溶液中离子浓度大小关系_______ 。
I.常温下,一定浓度的
 溶液的
溶液的 ,已知
,已知 的电离平衡常数
的电离平衡常数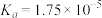 。
。(1)乙酸钠
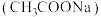 溶液呈碱性的原因是
溶液呈碱性的原因是 的
的 溶液中:
溶液中: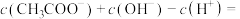
 。
。Ⅱ.常温下向某氨水中缓缓通入
 气体,溶液中
气体,溶液中 与
与 关系如图所示。
关系如图所示。
(2)在常温下
 的电离平衡常数
的电离平衡常数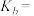
Ⅲ.
 时,向
时,向 溶液中滴加
溶液中滴加 溶液(一种酸,酸性强弱未知)时,溶液中由水电离的
溶液(一种酸,酸性强弱未知)时,溶液中由水电离的 浓度随加入的HA体积的变化如图所示:
浓度随加入的HA体积的变化如图所示:
(3)根据该图判断HA为
(4)若稀释a点溶液,则与稀释前相比,稀释后的溶液中水的电离程度会
(5)d点溶液中溶质成分是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】Ⅰ.在25℃时对氨水进行如下操作。请填写下列空白。
(1)若向氨水中加入少量硫酸铵固体,则溶液中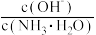 将
将_______ (填“增大”“减小”或“不变”)。
(2)若向氨水中加入稀硫酸至溶液的 ,此时溶液中
,此时溶液中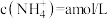 ,则
,则
_______ 。
Ⅱ.为配制溶液,取固体少许溶于2~3mL水中,有白色沉淀产生。
(3)此溶液的pH_______ 7(填“小于”“大于”或“等于”),配制 溶液的正确方法是
溶液的正确方法是_______ 。
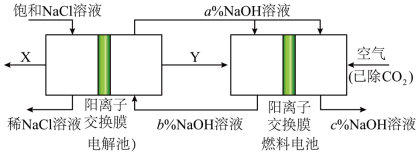
Ⅲ.氯碱工业的一种节能新工艺是将电解池与燃料电池相连,相关物料的传输及转化关系如图所示(电极未标出)。
(4)下列说法错误的是_______
Ⅳ.碱式氯化铜[Cum(OH)xCly]为绿色或墨绿色的结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。实验室现进行无水碱式氯化铜组成的测定,称取产品12.87g,加稀硝酸溶解,并加水定容至500mL,得到待测液。
铜的测定:取50mL待测液,加入足量的氢氧化钠,经过滤,洗涤,低温烘干,称量得到的蓝色固体质量为1.176g。
采用沉淀滴定法测定氯,步骤如下:
a.准确量取25.00mL待测液于锥形瓶中,加入20ml0.2mol/LAgNO3溶液,充分反应;
b.向其中加入少量硝基苯,使沉淀表面被有机物覆盖;
c.加入指示剂NH4Fe(SO4)2,用NH4SCN标准溶液滴定过量的AgNO3溶液;
d.重复实验操作三次,消耗0.1mol/LNH4SCN溶液的体积平均为10.00mL。
已知Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12
(5)其中加入硝基苯的作用是_______ 。
(6)判断达到滴定终点的现象是_______ 。
(7)根据上述实验结果可推知该碱式氯化铜的化学式为_______ 。
(1)若向氨水中加入少量硫酸铵固体,则溶液中
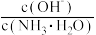 将
将(2)若向氨水中加入稀硫酸至溶液的
 ,此时溶液中
,此时溶液中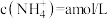 ,则
,则
Ⅱ.为配制溶液,取固体少许溶于2~3mL水中,有白色沉淀产生。
(3)此溶液的pH
 溶液的正确方法是
溶液的正确方法是Ⅲ.氯碱工业的一种节能新工艺是将电解池与燃料电池相连,相关物料的传输及转化关系如图所示(电极未标出)。

(4)下列说法错误的是_______
| A.图中的X是H2,Y是Cl2 |
B.燃料电池的负极反应式为 |
C.电解池中产生 时,理论上燃料电池中消耗 时,理论上燃料电池中消耗 |
| D.a、b、c的大小关系为a>c>b |
Ⅳ.碱式氯化铜[Cum(OH)xCly]为绿色或墨绿色的结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。实验室现进行无水碱式氯化铜组成的测定,称取产品12.87g,加稀硝酸溶解,并加水定容至500mL,得到待测液。
铜的测定:取50mL待测液,加入足量的氢氧化钠,经过滤,洗涤,低温烘干,称量得到的蓝色固体质量为1.176g。
采用沉淀滴定法测定氯,步骤如下:
a.准确量取25.00mL待测液于锥形瓶中,加入20ml0.2mol/LAgNO3溶液,充分反应;
b.向其中加入少量硝基苯,使沉淀表面被有机物覆盖;
c.加入指示剂NH4Fe(SO4)2,用NH4SCN标准溶液滴定过量的AgNO3溶液;
d.重复实验操作三次,消耗0.1mol/LNH4SCN溶液的体积平均为10.00mL。
已知Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12
(5)其中加入硝基苯的作用是
(6)判断达到滴定终点的现象是
(7)根据上述实验结果可推知该碱式氯化铜的化学式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】(一)完成下列问题
(1)在2L密闭容器中进行如下反应: ,在2s内用X表示的平均反应速率是
,在2s内用X表示的平均反应速率是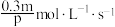 ,则2s时W增加的物质的量是_______
,则2s时W增加的物质的量是_______
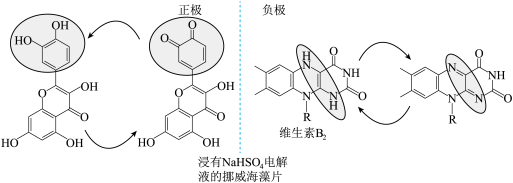
(2)科学家从天然产物中筛选物质开发出了一款完全可食用、可充电的电池。维生素 为负极,从水果皮中提取的槲皮素为正极,
为负极,从水果皮中提取的槲皮素为正极, 水溶液为电解质溶液,如图所示。电池的性能测试显示电压为0.6~0.8V,水电解所需最低电压为1.23V。下列说法错误的是_________
水溶液为电解质溶液,如图所示。电池的性能测试显示电压为0.6~0.8V,水电解所需最低电压为1.23V。下列说法错误的是_________
(3)一定温度下,在体积可变的反应器中充入足量的黄钠铁矾[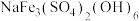 ],发生反应:
],发生反应: ,达到平衡时压强为
,达到平衡时压强为 ,保持温度不变,将体积变为原来的一半,平衡时测得压强为p。判断
,保持温度不变,将体积变为原来的一半,平衡时测得压强为p。判断 与p的关系,并说明理由
与p的关系,并说明理由___________
___________
(4)以酚酞为指示剂,用0.1000 的NaOH溶液滴定20.00mL未知浓度的二元酸
的NaOH溶液滴定20.00mL未知浓度的二元酸 溶液。溶液中,pH、分布系数
溶液。溶液中,pH、分布系数 随滴加NaOH溶液体积VNaOH的变化关系如下图所示。
随滴加NaOH溶液体积VNaOH的变化关系如下图所示。
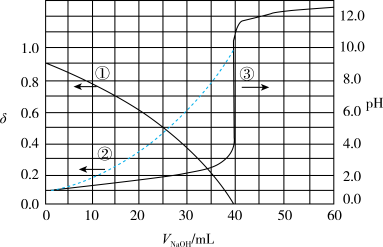
[比如 的分布系数:
的分布系数: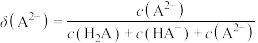 ]知:常温下
]知:常温下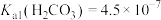 ,
,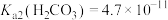 。
。
下列叙述正确的是______
(二)神舟十五号顺利发射升空,标志着我国航天事业的飞速发展。
Ⅰ.火箭推进剂的研究是航天工业中的重要课题,常见推进剂的燃料包括汽油液肼( )、液氢等,具有不同的推进效能。回答下列问题:
)、液氢等,具有不同的推进效能。回答下列问题:
(5)火箭推进剂可用 作燃料,
作燃料, 作氧化剂,反应的热化学方程式可表示为
作氧化剂,反应的热化学方程式可表示为

 。相关物质的摩尔生成焓
。相关物质的摩尔生成焓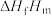 如下表所示。
如下表所示。
注:一定温度下,由元素的最稳定单质生成1mol纯物质的热效应称为该物质的摩尔生成焓,用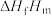 表示。如
表示。如 (l)的摩尔生成焓:
(l)的摩尔生成焓: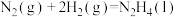
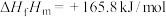
①
___________ kJ/mol。
②结合化学反应原理分析, (l)作推近剂燃料可与
(l)作推近剂燃料可与 (g)自发进行反应的原因是
(g)自发进行反应的原因是___________
___________ 。
(6)火箭推进器内氨氧燃烧的简化反应历程如下图所示,分析其反应机理。
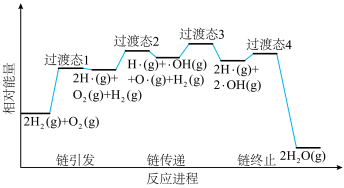
该历程分___________ 步进行,其中氢氧燃烧决速步对应的反应方程式为___________ 。
Ⅱ.利用“一碳化学”技术可有效实现工业制氢,为推进剂提供了丰富的氢燃料,该工业制氢方法主要涉及以下两个反应:
a:
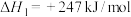
b:
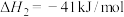
已知为反应的标准压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的相对分压代替浓度;气体的相对分压等于其分压(单位为kPa)除以标准压力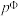 (
(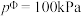 )。反应a、b的ln随
)。反应a、b的ln随 (T为温度)的变化如图所示。
(T为温度)的变化如图所示。
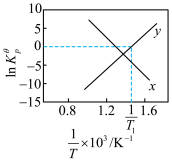
(7)①能表示反应b的曲线为___________ ,反应a的标准压强平衡常数表达式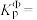
___________ 。
②维持 温度下,往恒容密闭容器中通入等量
温度下,往恒容密闭容器中通入等量 、
、 、
、 混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下
混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下 的平衡转化率为
的平衡转化率为___________ , 的平衡分压为(结果保留3位有效数字)
的平衡分压为(结果保留3位有效数字)___________ kPa。
Ⅲ.电解法在物质制备中具有巨大的研究价值,可广泛用于化工生产。
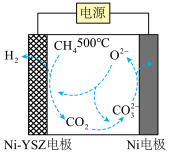
(8)我国科学家报道了一种在500℃下电解甲烷制氢的方法,反应原理如下图所示,请写出Ni电极上的电极反应式:___________ 。
(1)在2L密闭容器中进行如下反应:
 ,在2s内用X表示的平均反应速率是
,在2s内用X表示的平均反应速率是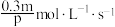 ,则2s时W增加的物质的量是_______
,则2s时W增加的物质的量是_______A.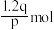 | B. | C.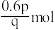 | D.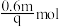 |
(2)科学家从天然产物中筛选物质开发出了一款完全可食用、可充电的电池。维生素
 为负极,从水果皮中提取的槲皮素为正极,
为负极,从水果皮中提取的槲皮素为正极, 水溶液为电解质溶液,如图所示。电池的性能测试显示电压为0.6~0.8V,水电解所需最低电压为1.23V。下列说法错误的是_________
水溶液为电解质溶液,如图所示。电池的性能测试显示电压为0.6~0.8V,水电解所需最低电压为1.23V。下列说法错误的是_________
A.放电过程中海藻片中 向维生素 向维生素 电极迁移 电极迁移 |
B.放电时负极反应: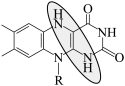 -2e- -2e- 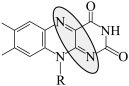 +2H+ +2H+ |
C.充电时总反应: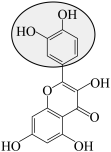 + +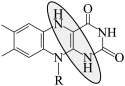 → →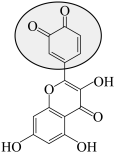 + + |
| D.该电池即使儿童误食也不会导致体内水电解而损害身体 |
(3)一定温度下,在体积可变的反应器中充入足量的黄钠铁矾[
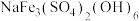 ],发生反应:
],发生反应: ,达到平衡时压强为
,达到平衡时压强为 ,保持温度不变,将体积变为原来的一半,平衡时测得压强为p。判断
,保持温度不变,将体积变为原来的一半,平衡时测得压强为p。判断 与p的关系,并说明理由
与p的关系,并说明理由(4)以酚酞为指示剂,用0.1000
 的NaOH溶液滴定20.00mL未知浓度的二元酸
的NaOH溶液滴定20.00mL未知浓度的二元酸 溶液。溶液中,pH、分布系数
溶液。溶液中,pH、分布系数 随滴加NaOH溶液体积VNaOH的变化关系如下图所示。
随滴加NaOH溶液体积VNaOH的变化关系如下图所示。
[比如
 的分布系数:
的分布系数: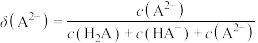 ]知:常温下
]知:常温下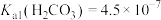 ,
,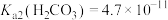 。
。下列叙述正确的是______
A.曲线①代表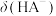 , ,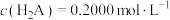 |
B. 的电离常数 的电离常数 |
C.滴定过程,pH=2时溶液中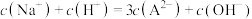 |
D.向 溶液中加入少量 溶液中加入少量 溶液,发生离子反应: 溶液,发生离子反应: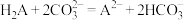 |
(二)神舟十五号顺利发射升空,标志着我国航天事业的飞速发展。
Ⅰ.火箭推进剂的研究是航天工业中的重要课题,常见推进剂的燃料包括汽油液肼(
 )、液氢等,具有不同的推进效能。回答下列问题:
)、液氢等,具有不同的推进效能。回答下列问题:(5)火箭推进剂可用
 作燃料,
作燃料, 作氧化剂,反应的热化学方程式可表示为
作氧化剂,反应的热化学方程式可表示为

 。相关物质的摩尔生成焓
。相关物质的摩尔生成焓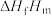 如下表所示。
如下表所示。| 物质 |  (g) (g) |  (l) (l) |  (g) (g) |
摩尔生成焓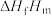 (kJ/mol) (kJ/mol) | +10.8 | +165.8 | -242.0 |
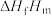 表示。如
表示。如 (l)的摩尔生成焓:
(l)的摩尔生成焓: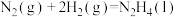
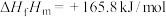
①

②结合化学反应原理分析,
 (l)作推近剂燃料可与
(l)作推近剂燃料可与 (g)自发进行反应的原因是
(g)自发进行反应的原因是(6)火箭推进器内氨氧燃烧的简化反应历程如下图所示,分析其反应机理。

该历程分
Ⅱ.利用“一碳化学”技术可有效实现工业制氢,为推进剂提供了丰富的氢燃料,该工业制氢方法主要涉及以下两个反应:
a:

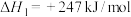
b:

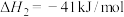
已知为反应的标准压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的相对分压代替浓度;气体的相对分压等于其分压(单位为kPa)除以标准压力
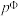 (
(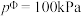 )。反应a、b的ln随
)。反应a、b的ln随 (T为温度)的变化如图所示。
(T为温度)的变化如图所示。
(7)①能表示反应b的曲线为
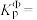
②维持
 温度下,往恒容密闭容器中通入等量
温度下,往恒容密闭容器中通入等量 、
、 、
、 混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下
混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下 的平衡转化率为
的平衡转化率为 的平衡分压为(结果保留3位有效数字)
的平衡分压为(结果保留3位有效数字)Ⅲ.电解法在物质制备中具有巨大的研究价值,可广泛用于化工生产。
(8)我国科学家报道了一种在500℃下电解甲烷制氢的方法,反应原理如下图所示,请写出Ni电极上的电极反应式:

您最近一年使用:0次



