工业上利用粗 (含
(含 、
、 )制取金属锌的流程如图所示(部分步骤省略):
)制取金属锌的流程如图所示(部分步骤省略):
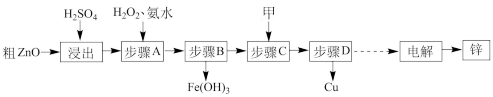
已知:几种离子形成氢氧化物沉淀时的 如下表:
如下表:
请回答下列问题:
(1)酸浸粗氧化锌的过程中,将粗氧化锌研碎的目的是_______ 。
(2)步骤 中加入
中加入 的目的是
的目的是_______ (用离子方程式表示);若加入氨水只沉淀铁元素,控制溶液 的范围是
的范围是_______ 。
(3)甲物质最好是_______ (填写化学式)。
(4)室温下,向 的氨水中加入少量
的氨水中加入少量 固体,当固体溶解后,测得溶液
固体,当固体溶解后,测得溶液 减小,主要原因是_______(填序号)。
减小,主要原因是_______(填序号)。
(5)由粗 制取单质锌的另一种方法是将粗
制取单质锌的另一种方法是将粗 (含
(含 、
、 )溶于
)溶于 溶液,
溶液, 全部转化为
全部转化为 溶液;然后将
溶液;然后将 、
、 过滤除去;再用惰性电极电解该滤液,阳极上逸出无色无味气体,阴极上析出锌,则阴极电极反应式为
过滤除去;再用惰性电极电解该滤液,阳极上逸出无色无味气体,阴极上析出锌,则阴极电极反应式为_______ 。
(6)常温下,用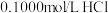 溶液滴定
溶液滴定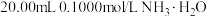 溶液,滴定曲线如图所示。
溶液,滴定曲线如图所示。
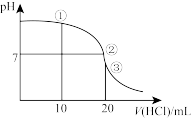
①溶液中离子浓度由大到小的顺序是_______ ;①②③溶液水的电离程度最大的是_______ 。
 (含
(含 、
、 )制取金属锌的流程如图所示(部分步骤省略):
)制取金属锌的流程如图所示(部分步骤省略):
已知:几种离子形成氢氧化物沉淀时的
 如下表:
如下表:| 待沉淀的离子 |  |  |  |  |
开始沉淀时 | 6.3 | 1.5 | 6.2 | 5.2 |
沉淀完全时 | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)酸浸粗氧化锌的过程中,将粗氧化锌研碎的目的是
(2)步骤
 中加入
中加入 的目的是
的目的是 的范围是
的范围是(3)甲物质最好是
(4)室温下,向
 的氨水中加入少量
的氨水中加入少量 固体,当固体溶解后,测得溶液
固体,当固体溶解后,测得溶液 减小,主要原因是_______(填序号)。
减小,主要原因是_______(填序号)。A.氨水与 发生化学反应 发生化学反应 |
B. 水解显酸性,增大了 水解显酸性,增大了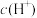 |
C. 溶于水,电离出 溶于水,电离出 ,抑制了 ,抑制了 的电离,使 的电离,使 减小 减小 |
D. 水解产生的 水解产生的 中和了 中和了 电离出的 电离出的 |
 制取单质锌的另一种方法是将粗
制取单质锌的另一种方法是将粗 (含
(含 、
、 )溶于
)溶于 溶液,
溶液, 全部转化为
全部转化为 溶液;然后将
溶液;然后将 、
、 过滤除去;再用惰性电极电解该滤液,阳极上逸出无色无味气体,阴极上析出锌,则阴极电极反应式为
过滤除去;再用惰性电极电解该滤液,阳极上逸出无色无味气体,阴极上析出锌,则阴极电极反应式为(6)常温下,用
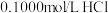 溶液滴定
溶液滴定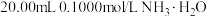 溶液,滴定曲线如图所示。
溶液,滴定曲线如图所示。
①溶液中离子浓度由大到小的顺序是
更新时间:2022-06-21 20:30:50
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某同学用0.1000mol·L-1NaOH溶液滴定20.00 mL某浓度的CH3COOH溶液。
(1)部分操作如下:
①取一支用蒸馏水洗净的碱式滴定管,加入标准氢氧化钠溶液,记录初始读数
②用酸式滴定管放出一定量待测液,置于用蒸馏水洗净的锥形瓶中,加入2滴甲基橙
③滴定时,边滴加边振荡,同时注视滴定管内液面的变化
请选出上述操作过程中存在错误的序号:________ 。
(2)某次滴定前滴定管液面如图1所示,读数为______________ mL。
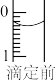
(3)根据实验结果所绘制的滴定曲线如图,其中点①所示溶液中c(CH3COO-)=1.7c(CH3COOH),点③所示溶液中c(CH3COO-)+c(CH3COOH)=c(Na+)。计算醋酸的电离常数:______________ ,该CH3COOH的物质的量浓度为__________ mol·L-1。

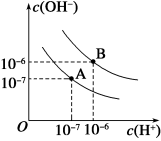
(4)水的电离平衡曲线如下图所示。若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积_____________ 。将常温下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为_____________ 。
(1)部分操作如下:
①取一支用蒸馏水洗净的碱式滴定管,加入标准氢氧化钠溶液,记录初始读数
②用酸式滴定管放出一定量待测液,置于用蒸馏水洗净的锥形瓶中,加入2滴甲基橙
③滴定时,边滴加边振荡,同时注视滴定管内液面的变化
请选出上述操作过程中存在错误的序号:
(2)某次滴定前滴定管液面如图1所示,读数为
(3)根据实验结果所绘制的滴定曲线如图,其中点①所示溶液中c(CH3COO-)=1.7c(CH3COOH),点③所示溶液中c(CH3COO-)+c(CH3COOH)=c(Na+)。计算醋酸的电离常数:

(4)水的电离平衡曲线如下图所示。若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】硫一碘循环分解水制氢主要涉及下列反应:
Ⅰ.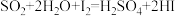
Ⅱ.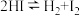
Ⅲ.
(1)分析上述反应,下列判断正确的是___________ 。
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程产生1 mol O2的同时产生1 molH2
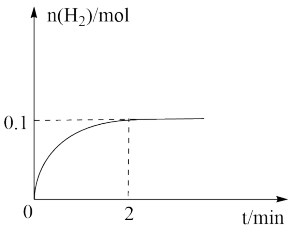
(2)一定温度下,向1L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。该温度下, 的平衡常数K=
的平衡常数K=___________ 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则平衡后,_________ 是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡___________ 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的___________ ,产生 的速率将增大。
的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。已知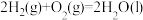
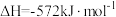 某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为
某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为___________ 。
Ⅰ.
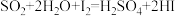
Ⅱ.
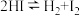
Ⅲ.

(1)分析上述反应,下列判断正确的是
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程产生1 mol O2的同时产生1 molH2
(2)一定温度下,向1L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。该温度下,
 的平衡常数K=
的平衡常数K=
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡
 的速率将增大。
的速率将增大。a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。已知
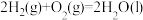
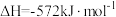 某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为
某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与 pH=12的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与 pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是________ (选填序号);
(2)若将②、③混合后所得溶液 pH=7,则消耗溶液的体积:②______ ③(选填“>”、“<”或“=”,下同);若将②、③溶液等体积混合后,所得溶液 pH_____________ 7。
(3)若将①、④溶液按体积比为2:1混合后,所得溶液pH______ 7(选填“>”、“<”或“=”)此时溶液中除水分子外的各微粒的浓度由大到小的顺序为:__________ ;将①、④混合,若有c(CH3COO-)>c(H+),则混合液可能呈_________ (填序号)。
a.酸性 b.碱性 c.中性
(1)其中水的电离程度最大的是
(2)若将②、③混合后所得溶液 pH=7,则消耗溶液的体积:②
(3)若将①、④溶液按体积比为2:1混合后,所得溶液pH
a.酸性 b.碱性 c.中性
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ:为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,1 g甲醇在氧气中充分燃烧生成二氧化碳和液态水释放出22.7 kJ的热量,试写出甲醇燃烧的热化学方程式___________ 。
(2)已知反应CH3—CH3(g) → CH2=CH2(g)+H2(g),有关化学键的键能如下。
试计算该反应的反应热___________ 。
Ⅱ:某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA- H++A2-
H++A2-
回答下列问题:
(1)Na2A溶液显___________ (填“酸性”“中性”或“碱性”),用离子方程式表示其原因___________ 。
(2)在0.1 mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是___________ 。
A.c(A2-)+c(HA-)+c(H2A)=0.1 mol·L-1
B.c(OH-)=c(H+)+c(HA-)+2c(H2A)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
(3)常温下,已知0.1 mol·L-1NaHA溶液的pH=2,则0.1 mol·L-1H2A溶液中c(H+)可能___________ (填“>”、“<”或“=”)0.11 mol·L-1;理由是___________ 。
(4)比较①0.1 mol·L-1 Na2A溶液 ②0.1 mol·L-1 Na2SO4溶液,两种溶液中阴离子总浓度的大小①___________ ②(填“>”、“<”或“=”)。
(1)实验测得,1 g甲醇在氧气中充分燃烧生成二氧化碳和液态水释放出22.7 kJ的热量,试写出甲醇燃烧的热化学方程式
(2)已知反应CH3—CH3(g) → CH2=CH2(g)+H2(g),有关化学键的键能如下。
| 化学键 | C—H | C=C | C—C | H—H |
| 键能/kJ·mol-1 | 414.4 | 615.3 | 347.4 | 435.3 |
试计算该反应的反应热
Ⅱ:某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA-
 H++A2-
H++A2-回答下列问题:
(1)Na2A溶液显
(2)在0.1 mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是
A.c(A2-)+c(HA-)+c(H2A)=0.1 mol·L-1
B.c(OH-)=c(H+)+c(HA-)+2c(H2A)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
(3)常温下,已知0.1 mol·L-1NaHA溶液的pH=2,则0.1 mol·L-1H2A溶液中c(H+)可能
(4)比较①0.1 mol·L-1 Na2A溶液 ②0.1 mol·L-1 Na2SO4溶液,两种溶液中阴离子总浓度的大小①
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.常温下,如果取0.2 mol/LCH3COOH溶液与0.2 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,试回答以下问题:
(1)写出该混合过程中所发生反应的离子方程式:__________________ ,混合溶液的pH=9的原因是:(用必要的文字和离子方程式表示)________________ 。
(2)该混合溶液中由水电离出的c(H+)和pH=9的NaOH溶液中由水电离出c(H+)的比值为_________ 。
(3)求该混合溶液中下列算式的计算结果:
c(Na+)-c(CH3COO-)=_________ mol/L(代入数据,列出算式即可)
c(OH-)-c(CH3COOH)=_________ moL/L。
Ⅱ.(4)由表格中的电离平衡常数判断可以发生的反应是_________ (填字母序号)。
A.NaClO+NaHCO3=HClO+Na2CO3
B.2HClO+Na2CO3=2NaClO+CO2↑+H2O
C.2NaClO+CO2+H2O=2HClO+Na2CO3
D.NaClO+CO2+H2O=HClO+NaHCO3
(5)将同温度下等浓度的下列四种盐溶液:(已知常温下一水合氨的电离常数Kb=1.8×10-5;碳酸的电离常数:Ka1=4.4×10-7,Ka2=4.7×10-11)
A.NH4HCO3 B.NH4Cl C.(NH4)2SO4 D.CH3COONH4
按pH由大到小的顺序排列:_________ (填字母序号)。
(6)下列固体物质溶于水,再将其溶液加热,蒸发结晶、再灼烧,能得到化学组成与原固体物质相同的是_________ (填字母序号)。
①胆矾 ②氯化铝 ③硫酸铝 ④Na2CO3 ⑤NaHCO3 ⑥高锰酸钾
A.③④ B.①③④ C.①②③④⑤ D.全部
(1)写出该混合过程中所发生反应的离子方程式:
(2)该混合溶液中由水电离出的c(H+)和pH=9的NaOH溶液中由水电离出c(H+)的比值为
(3)求该混合溶液中下列算式的计算结果:
c(Na+)-c(CH3COO-)=
c(OH-)-c(CH3COOH)=
Ⅱ.(4)由表格中的电离平衡常数判断可以发生的反应是
| 化学式 | 常温下的电离常数 |
| HClO | K=3×10-8 |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
A.NaClO+NaHCO3=HClO+Na2CO3
B.2HClO+Na2CO3=2NaClO+CO2↑+H2O
C.2NaClO+CO2+H2O=2HClO+Na2CO3
D.NaClO+CO2+H2O=HClO+NaHCO3
(5)将同温度下等浓度的下列四种盐溶液:(已知常温下一水合氨的电离常数Kb=1.8×10-5;碳酸的电离常数:Ka1=4.4×10-7,Ka2=4.7×10-11)
A.NH4HCO3 B.NH4Cl C.(NH4)2SO4 D.CH3COONH4
按pH由大到小的顺序排列:
(6)下列固体物质溶于水,再将其溶液加热,蒸发结晶、再灼烧,能得到化学组成与原固体物质相同的是
①胆矾 ②氯化铝 ③硫酸铝 ④Na2CO3 ⑤NaHCO3 ⑥高锰酸钾
A.③④ B.①③④ C.①②③④⑤ D.全部
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】Na2SO3用途广泛,可用作还原剂、吸收剂等。
I.探究Na2SO3溶液与FeCl3溶液的反应原理
某兴趣小组进行了如下实验:
(1)配制1mol·L-1FeCl3溶液时;先将FeCl3固体溶于_______ ,再稀释至指定浓度。
(2)针对上述现象,小组成员展开讨论,甲同学认为Fe3+与SO 发生了相互促进的水解反应得到一种胶体,其离子方程式为
发生了相互促进的水解反应得到一种胶体,其离子方程式为_______ ;乙同学认为Fe3+与SO 还发生了氧化还原反应,并依据反应现象判断出两种反应活化能较大的是
还发生了氧化还原反应,并依据反应现象判断出两种反应活化能较大的是_______ (填“水解反应”或“氧化还原反应”)。
经查阅资料和进一步实验探究,证实了SO 与Fe3+既发生了水解反应又发生了氧化还原反应。
与Fe3+既发生了水解反应又发生了氧化还原反应。
II.Na2SO3溶液作吸收剂
工业上可用Na2SO3溶液吸收SO2。已知25°C时,H2SO3的电离常数Ka1=1.0×10-2,Ka2=6.2×10-8。
(3)25°C时,NaHSO3的水解常数为Kh=_______ mol·L-1。
(4)25°C时,用Na2SO3溶液吸收SO2至pH=7时,溶液中各离子浓度的大小关系为_______ ;若向该溶液中加入少量的I2, 将
将_______ (填“增大”“减小”或“不变”)。
I.探究Na2SO3溶液与FeCl3溶液的反应原理
某兴趣小组进行了如下实验:
| 装置 | 现象 |
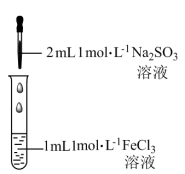 | 现象i:一开始液体颜色加深,由棕黄色变为红褐色。 现象ii:一段时间后液体颜色变浅,变为浅黄色。 |
(2)针对上述现象,小组成员展开讨论,甲同学认为Fe3+与SO
 发生了相互促进的水解反应得到一种胶体,其离子方程式为
发生了相互促进的水解反应得到一种胶体,其离子方程式为 还发生了氧化还原反应,并依据反应现象判断出两种反应活化能较大的是
还发生了氧化还原反应,并依据反应现象判断出两种反应活化能较大的是经查阅资料和进一步实验探究,证实了SO
 与Fe3+既发生了水解反应又发生了氧化还原反应。
与Fe3+既发生了水解反应又发生了氧化还原反应。II.Na2SO3溶液作吸收剂
工业上可用Na2SO3溶液吸收SO2。已知25°C时,H2SO3的电离常数Ka1=1.0×10-2,Ka2=6.2×10-8。
(3)25°C时,NaHSO3的水解常数为Kh=
(4)25°C时,用Na2SO3溶液吸收SO2至pH=7时,溶液中各离子浓度的大小关系为
 将
将
您最近一年使用:0次
【推荐1】锂和铍是重要的稀有金属,被国内外视为战略性资源。一种从尾矿(主要含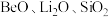 及
及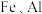 元素)中回收锂、铍、铝的工艺流程如图:
元素)中回收锂、铍、铝的工艺流程如图:
(1)“浸渣”中主要成分的晶体类型为_____ 。
(2)“沉铁”中生成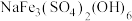 沉淀,其中
沉淀,其中 元素的化合价为
元素的化合价为_____ ,该反应的离子方程式为_____ 。
(3)“萃取”时,以 为萃取剂、
为萃取剂、 为协萃剂,溶液中的
为协萃剂,溶液中的 可与
可与 结合成
结合成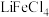 而被
而被 萃取。“反萃取”时,加入浓盐酸,发生
萃取。“反萃取”时,加入浓盐酸,发生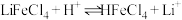 。
。
①“萃取”时还需要加入 ,其作用是
,其作用是_____ 。
②取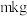 尾矿(其中
尾矿(其中 的质量分数为
的质量分数为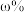 ),“反萃取”后所得
),“反萃取”后所得 水相中
水相中 ,则该过程
,则该过程 的回收率为
的回收率为_____ (用含相关物理量字母的代数式表示)。
(4)实验室提纯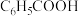 的方法是
的方法是_____ 。
(5)为了得到较高的空间利用率,离子晶体中的阴离子(通常半径较大)会尽可能紧密堆积,阳离子(通常半径较小)填入阴离子形成的空隙中,这种模型称为离子晶体的“堆积-填隙模型”。
已知常见的 型离子晶体的离子半径比和配位数的关系如下表:
型离子晶体的离子半径比和配位数的关系如下表:
表中离子半径比的临界值是由“堆积—填隙模型”中阴阳离子的几何关系确定的,例如配位数为8时,阳离子进入阴离子形成的正方体空隙,正方体8个顶点处的阴离了相切,空隙处(正方体体心)的阳离子与8个阴离子也相切,此时可由相关几何关系求得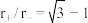 。
。
①
_____ 。
② 晶胞为立方
晶胞为立方 型,而
型,而 等的晶胞为
等的晶胞为 型。请结合上表,解释出现此结果的原因:
型。请结合上表,解释出现此结果的原因:_____ 。
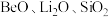 及
及 元素)中回收锂、铍、铝的工艺流程如图:
元素)中回收锂、铍、铝的工艺流程如图: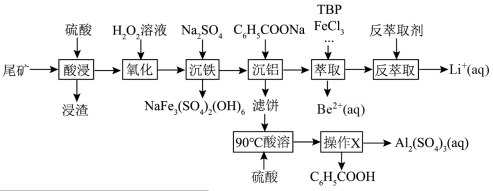
(1)“浸渣”中主要成分的晶体类型为
(2)“沉铁”中生成
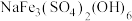 沉淀,其中
沉淀,其中 元素的化合价为
元素的化合价为(3)“萃取”时,以
 为萃取剂、
为萃取剂、 为协萃剂,溶液中的
为协萃剂,溶液中的 可与
可与 结合成
结合成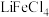 而被
而被 萃取。“反萃取”时,加入浓盐酸,发生
萃取。“反萃取”时,加入浓盐酸,发生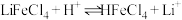 。
。①“萃取”时还需要加入
 ,其作用是
,其作用是②取
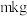 尾矿(其中
尾矿(其中 的质量分数为
的质量分数为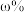 ),“反萃取”后所得
),“反萃取”后所得 水相中
水相中 ,则该过程
,则该过程 的回收率为
的回收率为(4)实验室提纯
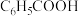 的方法是
的方法是(5)为了得到较高的空间利用率,离子晶体中的阴离子(通常半径较大)会尽可能紧密堆积,阳离子(通常半径较小)填入阴离子形成的空隙中,这种模型称为离子晶体的“堆积-填隙模型”。
已知常见的
 型离子晶体的离子半径比和配位数的关系如下表:
型离子晶体的离子半径比和配位数的关系如下表: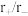 | 配位数 | 晶胞类型 |
 | 4 | 立方 |
 | 6 |  |
 | 8 |  |
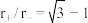 。
。①

②
 晶胞为立方
晶胞为立方 型,而
型,而 等的晶胞为
等的晶胞为 型。请结合上表,解释出现此结果的原因:
型。请结合上表,解释出现此结果的原因:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:

已知:25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:________ 。
(2)用盐酸酸浸时,为使酸浸速率加快,可采取的一种措施是:____________________ ,发生反应的离子方程式为:____________________________________ 。
(3)流程中通过过滤得到草酸氧化钛钡晶体,过滤操作中使用的玻璃仪器有:______________ 。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:___________________________ 。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:___________ 。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol·L-1,则c(CO32-)在浸出液中的最大浓度为:_________ mol·L-1。

已知:25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:
(2)用盐酸酸浸时,为使酸浸速率加快,可采取的一种措施是:
(3)流程中通过过滤得到草酸氧化钛钡晶体,过滤操作中使用的玻璃仪器有:
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol·L-1,则c(CO32-)在浸出液中的最大浓度为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:________________ .
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的还原剂为_________ .
(3)请完成MnO2和浓盐酸制备Cl2的离子方程式:__________________ .
(4)如果14.2g氯气与足量的氢气反应,然后生成的气体用500mL某浓度的NaOH溶液恰好反应,则此NaOH的浓度为_________ (请写出计算过程)
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl 、OH
、OH 和SO
和SO .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设 .
假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO ;假设3:SO32-、ClO
;假设3:SO32-、ClO 都存在。
都存在。
设计实验方案,进行实验。请在答题卡上写出与实验步骤相应的预期现象和结论。限选实验试剂:3moL L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
(1)请完成SO2与过量NaOH溶液反应的化学方程式:
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的还原剂为
(3)请完成MnO2和浓盐酸制备Cl2的离子方程式:
(4)如果14.2g氯气与足量的氢气反应,然后生成的气体用500mL某浓度的NaOH溶液恰好反应,则此NaOH的浓度为
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl
 、OH
、OH 和SO
和SO .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).①提出合理假设 .
假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO
 ;假设3:SO32-、ClO
;假设3:SO32-、ClO 都存在。
都存在。设计实验方案,进行实验。请在答题卡上写出与实验步骤相应的预期现象和结论。限选实验试剂:3moL
 L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.| 实验步骤 | 预期现象和结论 |
 步骤1:取少量吸收液于试管中,滴加3 moL 步骤1:取少量吸收液于试管中,滴加3 moL L-1H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. L-1H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. | |
| 步骤2:在A试管中滴加紫色石蕊试液 | |
步骤3:在B试管中滴加0.01mol L-1KMnO4 L-1KMnO4 |
您最近一年使用:0次



