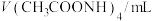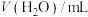醋酸钠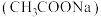 是一种常用的防腐剂和缓冲剂。
是一种常用的防腐剂和缓冲剂。
(1)写出 水解的离子方程式
水解的离子方程式______ ,其水解平衡常数的表达式为______ 。
(2)欲用醋酸钠晶体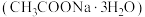 配制
配制 溶液,需要称量晶体的质量为
溶液,需要称量晶体的质量为______ 。实验需要的仪器有电子天平、药匙、玻璃棒、量筒、______ 。
(3)某小组探究外界因素对 水解程度的影响。
水解程度的影响。
①甲同学设计实验方案如下(表中溶液浓度均为 ):
):
i实验______ (填序号),探究加水稀释对CH3COONa水解程度的影响;
ii.实验1和3,探究加入 对CH3COONa水解程度的影响;
对CH3COONa水解程度的影响;
iii.实验1和4,探究温度对 水解程度的影响。
水解程度的影响。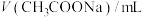
②根据甲同学的实验方案,补充数据:
______ 。实验测得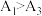 ,该结果不足以证明加入
,该结果不足以证明加入 促进了
促进了 的水解。根据
的水解。根据______ (填一种微粒的化学式)的浓度增大可以说明加入 能促进
能促进 的水解。
的水解。
③已知 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测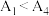 ,但实验结果为
,但实验结果为 。实验结果与预测不一致的原因是
。实验结果与预测不一致的原因是______ 。
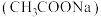 是一种常用的防腐剂和缓冲剂。
是一种常用的防腐剂和缓冲剂。(1)写出
 水解的离子方程式
水解的离子方程式(2)欲用醋酸钠晶体
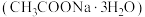 配制
配制 溶液,需要称量晶体的质量为
溶液,需要称量晶体的质量为(3)某小组探究外界因素对
 水解程度的影响。
水解程度的影响。①甲同学设计实验方案如下(表中溶液浓度均为
 ):
):i实验
ii.实验1和3,探究加入
 对CH3COONa水解程度的影响;
对CH3COONa水解程度的影响;iii.实验1和4,探究温度对
 水解程度的影响。
水解程度的影响。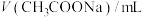
序号 | 温度 |
|
|
|
|
1 | 25℃ | 40.0 | 0 | 0 |
|
2 | 25℃ | 4.0 | 0 | 36.0 |
|
3 | 25℃ | 20.0 | 10.0 |
|
|
4 | 40℃ | 40.0 | 0 | 0 |
|

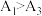 ,该结果不足以证明加入
,该结果不足以证明加入 促进了
促进了 的水解。根据
的水解。根据 能促进
能促进 的水解。
的水解。③已知
 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测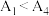 ,但实验结果为
,但实验结果为 。实验结果与预测不一致的原因是
。实验结果与预测不一致的原因是
更新时间:2023/09/04 15:51:13
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】了解原理就能更好地解决问题,是学生迁移与应用的能力外显。请用学习的相关原理回答问题。
(1)已知:电离平衡常数:Ka(CH3COOH)=1.8×10-5;Kb(NH3·H2O)=1.8×10-5。
则:①CH3COONH4溶液呈____ 性(填“酸”、“碱”或“中”),理由是____ 。
②对于醋酸溶液和醋酸钠溶液的下列说法正确的是____ (填字母)
A.升高温度可以促进醋酸电离,也可以促进醋酸钠水解
B.常温下,在pH=3的醋酸与pH=11醋酸钠溶液中,由水电离出的c(H+)都是1×10-11 mol·L-1
C.常温下,等浓度等体积的醋酸和醋酸钠混合后,溶液中2c(Na+)=c(CH3COO-)+c(CH3COOH)
D.25℃时,向0.1 mol·L-1醋酸中滴加NaOH至溶液中c(CH3COO-):c(CH3COOH)=9:5,则溶液pH=9
(2)在25℃时, 浓度相等的①NH4Cl ②CH3COONH4 ③NH4HSO4 ④(NH4)2CO3四种溶液,其对应溶液中溶质的物质的量浓度由小到大的顺序是
浓度相等的①NH4Cl ②CH3COONH4 ③NH4HSO4 ④(NH4)2CO3四种溶液,其对应溶液中溶质的物质的量浓度由小到大的顺序是____ 。(用序号回答)
(3)利用下列装置可以验证不同化合价铁的氧化还原能力。

①电流表显示电子由铁电极流向石墨电极。则盐桥(含有琼胶的KCl饱和溶液)中的 进入
进入___ 电极溶液中。
②电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加,石墨电极上未见Fe析出。则石墨电极溶液中的电极反应式为____ ;则Fe2+氧化性小于____ 。
(4)金属腐蚀现象遍及国民经济和国防建设各个领域,危害十分严重。金属阳极钝化法是一种金属防腐的处理方法。如图是金属阳极钝化法在Al表面形成致密Al2O3氧化膜,则石墨电极附近产生的气体是____ (填化学式);该阳极的电极反应式____ 。

(1)已知:电离平衡常数:Ka(CH3COOH)=1.8×10-5;Kb(NH3·H2O)=1.8×10-5。
则:①CH3COONH4溶液呈
②对于醋酸溶液和醋酸钠溶液的下列说法正确的是
A.升高温度可以促进醋酸电离,也可以促进醋酸钠水解
B.常温下,在pH=3的醋酸与pH=11醋酸钠溶液中,由水电离出的c(H+)都是1×10-11 mol·L-1
C.常温下,等浓度等体积的醋酸和醋酸钠混合后,溶液中2c(Na+)=c(CH3COO-)+c(CH3COOH)
D.25℃时,向0.1 mol·L-1醋酸中滴加NaOH至溶液中c(CH3COO-):c(CH3COOH)=9:5,则溶液pH=9
(2)在25℃时,
 浓度相等的①NH4Cl ②CH3COONH4 ③NH4HSO4 ④(NH4)2CO3四种溶液,其对应溶液中溶质的物质的量浓度由小到大的顺序是
浓度相等的①NH4Cl ②CH3COONH4 ③NH4HSO4 ④(NH4)2CO3四种溶液,其对应溶液中溶质的物质的量浓度由小到大的顺序是(3)利用下列装置可以验证不同化合价铁的氧化还原能力。

①电流表显示电子由铁电极流向石墨电极。则盐桥(含有琼胶的KCl饱和溶液)中的
 进入
进入②电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加,石墨电极上未见Fe析出。则石墨电极溶液中的电极反应式为
(4)金属腐蚀现象遍及国民经济和国防建设各个领域,危害十分严重。金属阳极钝化法是一种金属防腐的处理方法。如图是金属阳极钝化法在Al表面形成致密Al2O3氧化膜,则石墨电极附近产生的气体是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】自然界是各类物质相互依存、各种变化相互制约的复杂平衡体系,水溶液中的离子平衡是其中一个重要方面。请根据所学知识,回答下列问题。
(1)某温度下,0.1mol/L的盐酸中水电离出的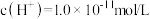 ,该温度下将
,该温度下将 的NaOH溶液与
的NaOH溶液与 的
的 溶液等体积混合,混合后溶液的
溶液等体积混合,混合后溶液的
_______ 。
(2)常温下将pH均为3,体积均为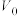 的HA和HB溶液,分别加水稀释至体积V,pH随
的HA和HB溶液,分别加水稀释至体积V,pH随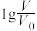 的变化如图所示。
的变化如图所示。
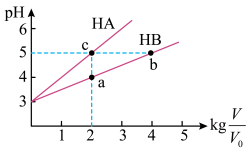
①a、b、c三点水的电离程度_______ (用“>”、“=”、“<”填空)。
②常温下,取上述pH均为3的HA和HB溶液各100mL,向其中分别加入足量的Zn粒,反应结束时HA中产生氢气的物质的量为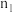 ,HB溶液中产生氢气的物质的量为
,HB溶液中产生氢气的物质的量为 ,则
,则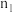
_______ 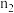 (用“>”、“=”、“<”填空)。
(用“>”、“=”、“<”填空)。
(3)查阅资料获得25℃时部分弱电解质的电离平衡常数数据:
①KSCN溶液呈弱碱性,用离子方程式解释原因_______ 。
② 溶液的水解平衡常数
溶液的水解平衡常数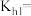
_______ (保留两位有效数字)。
③同浓度的NaF溶液和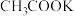 溶液相比,
溶液相比,
后者溶液中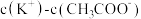
_______ 前者溶液中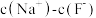 (用“>”、“=”、“<”填空)。
(用“>”、“=”、“<”填空)。
④现有25℃时等浓度的5种溶液:
A. B.
B. C.
C. D.
D. E.
E.
这5种溶液中 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:_______ (填字母)。
(1)某温度下,0.1mol/L的盐酸中水电离出的
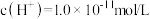 ,该温度下将
,该温度下将 的NaOH溶液与
的NaOH溶液与 的
的 溶液等体积混合,混合后溶液的
溶液等体积混合,混合后溶液的
(2)常温下将pH均为3,体积均为
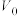 的HA和HB溶液,分别加水稀释至体积V,pH随
的HA和HB溶液,分别加水稀释至体积V,pH随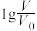 的变化如图所示。
的变化如图所示。
①a、b、c三点水的电离程度
②常温下,取上述pH均为3的HA和HB溶液各100mL,向其中分别加入足量的Zn粒,反应结束时HA中产生氢气的物质的量为
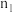 ,HB溶液中产生氢气的物质的量为
,HB溶液中产生氢气的物质的量为 ,则
,则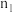
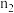 (用“>”、“=”、“<”填空)。
(用“>”、“=”、“<”填空)。(3)查阅资料获得25℃时部分弱电解质的电离平衡常数数据:
| 化学式 | HF | HClO |  |  | HSCN |  |
| 电离平衡常数 | 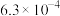 |  | 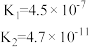 |  | 0.13 | 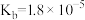 |
②
 溶液的水解平衡常数
溶液的水解平衡常数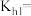
③同浓度的NaF溶液和
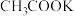 溶液相比,
溶液相比,后者溶液中
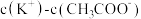
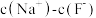 (用“>”、“=”、“<”填空)。
(用“>”、“=”、“<”填空)。④现有25℃时等浓度的5种溶液:
A.
 B.
B. C.
C. D.
D. E.
E.
这5种溶液中
 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】现有:①醋酸、②盐酸、③醋酸钠、④碳酸氢钠、⑤氨化钙、⑥氯化铵六种试剂。
(1)醋酸钠溶液呈碱性原因:_______ 。(化学用语)
(2)盐酸溶液与碳酸氢钠反应的离子方程式_______ 。
(3)有关0.1mol•L-1CH3COOH溶液的叙述不正确 的是_______ 。
a.与同浓度盐酸溶液的导电性不相同
b.常温下,等浓度等体积CH3COOH溶液与NaOH溶液混合后溶液pH<7
c.向CH3COOH溶液中加少量CH3COONa固体,c(H+)减小
d.向CH3COOH溶液中加少量Na2CO3固体,c(CH3COO-)增大
e.CH3COOH溶液中离子浓度关系满足:c(CH3COO-)>c(H+)>c(OH-)
(4)25℃时,pH均等于4的醋酸溶液和氯化铵溶液,醋酸溶液中水电离出的c(H+)与氯化铵溶液中水电离出的c(H+)之比是_______ 。
(5)室温下,向磷酸溶液中滴加NaOH溶液,含磷各微粒在溶液中的物质的量分数与pH的关系如图所示。
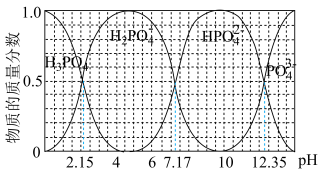
①H3PO4的电离平衡常数Ka1=_______ 。
②滴加NaOH溶液至pH=7,溶液中c(Na+)_______ c(H2PO )+c(HPO
)+c(HPO )+c(PO
)+c(PO )(填“>”“<”“=”)。
)(填“>”“<”“=”)。
(1)醋酸钠溶液呈碱性原因:
(2)盐酸溶液与碳酸氢钠反应的离子方程式
(3)有关0.1mol•L-1CH3COOH溶液的叙述
a.与同浓度盐酸溶液的导电性不相同
b.常温下,等浓度等体积CH3COOH溶液与NaOH溶液混合后溶液pH<7
c.向CH3COOH溶液中加少量CH3COONa固体,c(H+)减小
d.向CH3COOH溶液中加少量Na2CO3固体,c(CH3COO-)增大
e.CH3COOH溶液中离子浓度关系满足:c(CH3COO-)>c(H+)>c(OH-)
(4)25℃时,pH均等于4的醋酸溶液和氯化铵溶液,醋酸溶液中水电离出的c(H+)与氯化铵溶液中水电离出的c(H+)之比是
(5)室温下,向磷酸溶液中滴加NaOH溶液,含磷各微粒在溶液中的物质的量分数与pH的关系如图所示。

①H3PO4的电离平衡常数Ka1=
②滴加NaOH溶液至pH=7,溶液中c(Na+)
 )+c(HPO
)+c(HPO )+c(PO
)+c(PO )(填“>”“<”“=”)。
)(填“>”“<”“=”)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】含碳化合物种类繁多。回答下列问题:
(1)一定温度下,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应CO(g)+H2O(g) CO2(g)+H2(g),已知此温度下,该反应的平衡常数K=16,则平衡时体系中H2的物质的量分数为
CO2(g)+H2(g),已知此温度下,该反应的平衡常数K=16,则平衡时体系中H2的物质的量分数为___ 。
(2)在催化剂Ru催化下,CO2与H2反应可生成CH4,反应方程式为CO2(g)+4H2(g)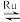 CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,则v正
CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,则v正___ (填"增大"减小"或"不变",下同),v逆___ ,平衡常数K___ ,转化率α(H2)___ ;若在相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如表:
则a、b、c、d与m、n、x、y之间的关系式为___ 。
(3)已知相关物质的电离平衡常数如表:
①0.1mol•L-1的Na2CO3溶液的pH___ (填“大于”“小于”或“等于”)0.1mol•L-1的Na2C2O4溶液的pH。
②若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中粒子浓度大小的顺序正确的是___ (填字母)。
a.c(H+)>c(HC2O )>c(HCO
)>c(HCO )>c(CO
)>c(CO )
)
b.c(HCO )>c(HC2O
)>c(HC2O )>c(C2O
)>c(C2O )>c(CO
)>c(CO )
)
c.c(H+)>c(HC2O )>c(CO
)>c(CO )>c(C2O
)>c(C2O )
)
d.c(H2CO3)>c(HCO )>c(HC2O
)>c(HC2O )>c(CO
)>c(CO )
)
(1)一定温度下,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应CO(g)+H2O(g)
 CO2(g)+H2(g),已知此温度下,该反应的平衡常数K=16,则平衡时体系中H2的物质的量分数为
CO2(g)+H2(g),已知此温度下,该反应的平衡常数K=16,则平衡时体系中H2的物质的量分数为(2)在催化剂Ru催化下,CO2与H2反应可生成CH4,反应方程式为CO2(g)+4H2(g)
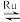 CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,则v正
CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,则v正| c(CO2)/mol·L-1 | c(H2)/mol·L-1 | c(CH4)/mol·L-1 | c(H2O)/mol·L-1 | |
| 平衡Ⅰ | a | b | c | d |
| 平衡Ⅱ | m | n | x | y |
(3)已知相关物质的电离平衡常数如表:
| 物质 | 电离平衡常数K |
| H2CO3 | Ka1=4.3×10-7,Ka2=5.6×10-11 |
| H2C2O4 | Ka1=5.9×10-2,Ka2=6.4×10-5 |
②若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中粒子浓度大小的顺序正确的是
a.c(H+)>c(HC2O
 )>c(HCO
)>c(HCO )>c(CO
)>c(CO )
)b.c(HCO
 )>c(HC2O
)>c(HC2O )>c(C2O
)>c(C2O )>c(CO
)>c(CO )
)c.c(H+)>c(HC2O
 )>c(CO
)>c(CO )>c(C2O
)>c(C2O )
)d.c(H2CO3)>c(HCO
 )>c(HC2O
)>c(HC2O )>c(CO
)>c(CO )
)
您最近一年使用:0次
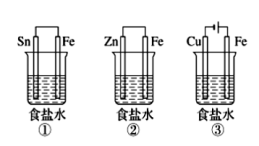
【推荐2】I.电化学与我们的生活有着密切的联系,请结合电化学知识回答下列有关问题:
(1)如图所示的三种探究钢铁的腐蚀与防护的装置中,采用牺牲阳极保护法进行金属Fe防护的是_______ (填装置序号)。
(2)已知铅蓄电池的工作原理为:Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O,现用如图装置进行电解(电解液足量),一段时间后铁电极质量减少并测得装置中转移了0.4 mol电子。请回答下列问题。
2PbSO4 + 2H2O,现用如图装置进行电解(电解液足量),一段时间后铁电极质量减少并测得装置中转移了0.4 mol电子。请回答下列问题。

①B是铅蓄电池的_______ 极,电极反应式为:_______ 。
②Ag电极的电极产物共_______ g,CuSO4溶液的浓度_______ (填“减小”“增大”或“不变”)。
Ⅱ.下表是常温下几种弱酸和弱碱的电离平衡常数
请回答下列问题:
(3)所给的四种酸中,酸性最弱的是_______ (填化学式)。物质的量浓度为0.1mol·L-1的下列四种溶液,pH由大到小的顺序是_______ (填标号)。
a.Na2CO3 b.NaCN c.CH3COONa d.NaHCO3
(4)CH3COONH4溶液中存在的各离子浓度大小关系为_______ 。
(1)如图所示的三种探究钢铁的腐蚀与防护的装置中,采用牺牲阳极保护法进行金属Fe防护的是

(2)已知铅蓄电池的工作原理为:Pb + PbO2 + 2H2SO4
 2PbSO4 + 2H2O,现用如图装置进行电解(电解液足量),一段时间后铁电极质量减少并测得装置中转移了0.4 mol电子。请回答下列问题。
2PbSO4 + 2H2O,现用如图装置进行电解(电解液足量),一段时间后铁电极质量减少并测得装置中转移了0.4 mol电子。请回答下列问题。
①B是铅蓄电池的
②Ag电极的电极产物共
Ⅱ.下表是常温下几种弱酸和弱碱的电离平衡常数
| 化学式 | CH3COOH | H2CO3 | HCN | HClO | NH3•H2O |
| 电离常数(Ka或Kb) | 1.8×10-5 | K1:4.4×10-7 K2:4.7×10-11 | 6.2×10-10 | 3×10-8 | 1.8×10-5 |
(3)所给的四种酸中,酸性最弱的是
a.Na2CO3 b.NaCN c.CH3COONa d.NaHCO3
(4)CH3COONH4溶液中存在的各离子浓度大小关系为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】氢氰酸(HCN)是一种具有苦杏仁气味的无色液体,易溶于水。回答下列问题:
(1)一定的温度和催化剂作用下,利用甲烷、氨气为原料氧化合成氢氰酸。
①氨气的电子式为______________ 。
②合成氢氰酸的化学方程式为________ 。
(2)已知25℃时HCN和H2CO3的电离常数(Ka)如下表:
25 ℃时,物质的量浓度均为0.1 mol • L-1的NaCN、NaHCO3和Na2CO3三种溶液,其pH最大的是________ (填化学式)。
(3)—定条件下,HCN与H2和H2O反应如下:
I. HCN(g)+3H2(g)⇌NH3(g)+CH4(g) △H1
Ⅱ.HCN(g) + H2O(g)⇌NH3(g)+CO(g) △H2
①反应Ⅲ,CO(g)+3H2(g)⇌CH4(g)+H2O(g)的△H=__________ (用△H1、△H2表示)。
②对于反应Ⅱ,减小压强,HCN的转化率______ (填“提高”、“不变”或“降低”)。
③反应I、Ⅱ的平衡常数对数值(lgK)与温度的关系如图甲所示,则T1K时,反应Ⅲ的平衡常数对数值lgK=_________ 。
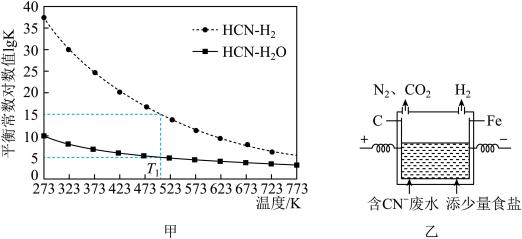
(4)电解法处理含氰废水的原理如图乙所示,阳极CN-先发生电极反应:CN-+2OH--2e-= CNO-+H2O,CNO-在阳极上进一步氧化的电极反应式为________________ 。
(1)一定的温度和催化剂作用下,利用甲烷、氨气为原料氧化合成氢氰酸。
①氨气的电子式为
②合成氢氰酸的化学方程式为
(2)已知25℃时HCN和H2CO3的电离常数(Ka)如下表:
| 物质 | 电离常数(Ka) |
| HCN | Ka=5×10-10 |
| H2CO3 | Ka1=4. 5×10-7 Ka2=4.7×10-11 |
(3)—定条件下,HCN与H2和H2O反应如下:
I. HCN(g)+3H2(g)⇌NH3(g)+CH4(g) △H1
Ⅱ.HCN(g) + H2O(g)⇌NH3(g)+CO(g) △H2
①反应Ⅲ,CO(g)+3H2(g)⇌CH4(g)+H2O(g)的△H=
②对于反应Ⅱ,减小压强,HCN的转化率
③反应I、Ⅱ的平衡常数对数值(lgK)与温度的关系如图甲所示,则T1K时,反应Ⅲ的平衡常数对数值lgK=

(4)电解法处理含氰废水的原理如图乙所示,阳极CN-先发生电极反应:CN-+2OH--2e-= CNO-+H2O,CNO-在阳极上进一步氧化的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】物质在水溶液中存在的电离平衡、水解平衡和沉淀溶解平衡,都可看作化学平衡。请根据所学知识回答:
(1)在0.1mol·L-1的NaHSO3溶液中存在的各种平衡体系为(用离子方程式表示)___________ 。已知该溶液中有关微粒浓度由大到小的顺序为:c(Na+)>c(HSO )>c(SO
)>c(SO )>c(H2SO3)。则该溶液中c(H+)
)>c(H2SO3)。则该溶液中c(H+)___________ c(OH-) (填“大于”、“小于”或“等于”),简述理由:___________ 。
(2)常温下,某水溶液中存在的离子有:Na+、A—、H+、OH—,若该溶液由0.1mol/L的HA溶液和0.1mol/L的NaOH溶液等体积混合而得,则溶液的pH___________ (填“大于”、“小于”或“等于”)7,理由是___________ 。
(3)25℃时,Fe(OH)3的Ksp=1.0×10-38mol4·L-4,Mg(OH)2的Ksp=1.0×10-11mol3·L-3。某混合溶液中Fe3+和Mg2+的浓度均为1.0×10-2mol/L,现要除去溶液中的Fe3+,而Mg2+不沉淀,应将溶液的pH控制在___________ 范围之内。(化学上通常认为残留在溶液中的离子浓度小于1.0×10-5mol/L时,沉淀就达到完全)
(1)在0.1mol·L-1的NaHSO3溶液中存在的各种平衡体系为(用离子方程式表示)
 )>c(SO
)>c(SO )>c(H2SO3)。则该溶液中c(H+)
)>c(H2SO3)。则该溶液中c(H+)(2)常温下,某水溶液中存在的离子有:Na+、A—、H+、OH—,若该溶液由0.1mol/L的HA溶液和0.1mol/L的NaOH溶液等体积混合而得,则溶液的pH
(3)25℃时,Fe(OH)3的Ksp=1.0×10-38mol4·L-4,Mg(OH)2的Ksp=1.0×10-11mol3·L-3。某混合溶液中Fe3+和Mg2+的浓度均为1.0×10-2mol/L,现要除去溶液中的Fe3+,而Mg2+不沉淀,应将溶液的pH控制在
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】一般来说,较强酸可以制取较弱酸,这是复分解反应的规律之一、已知在常温下测得浓度均为0.1mol·L−1的下列6种溶液的pH.
(1)①请根据上述信息判断下列反应不能发生的是_______ (填字母)。
a.CH3COOH+NaCN=CH3COONa+HCN
b.CO2+H2O+2NaClO=Na2CO3+2HClO
c.2HCN+Na2CO3=NaCN+CO2↑+H2O
d.Na2CO3+C6H5OH=NaHCO3+C6H5ONa
e.CO2+H2O+C6H5ONa=NaHCO3+C6H5OH
②已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A−=B2−+2HA,则A—、B2−、HB—三种阴离子结合H+的难易顺序为_______ 。
(2)一些复分解反应的发生还遵循其他规律。下列变化都属于复分解反应:①将石灰乳与纯碱溶液混合可制得苛性钠溶液;②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体;③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体。根据上述反应,总结出复分解反应发生的另一规律为_______ 。
(3)常温下将某电解质溶解在水中后,溶液中的c(H+)=10−9mol·L−1,则该电解质可能是_______ (填字母)。
a.CuSO4 b.HCl c.Na2S d.NaOH e.K2SO4
(4)常温下,将aLpH=3的盐酸分别与下列三种溶液混合,所得溶液均呈中性。
①bL浓度为1.0×10−3mol·L−1的氨水;
②cLc(OH−)=1.0×10−3mol·L−1的氨水;
③dLc(OH−)=1.0×10−3mol·L−1的氢氧化钠溶液。
则a、b、c、d的大小关系:_______ 。
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)①请根据上述信息判断下列反应不能发生的是
a.CH3COOH+NaCN=CH3COONa+HCN
b.CO2+H2O+2NaClO=Na2CO3+2HClO
c.2HCN+Na2CO3=NaCN+CO2↑+H2O
d.Na2CO3+C6H5OH=NaHCO3+C6H5ONa
e.CO2+H2O+C6H5ONa=NaHCO3+C6H5OH
②已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A−=B2−+2HA,则A—、B2−、HB—三种阴离子结合H+的难易顺序为
(2)一些复分解反应的发生还遵循其他规律。下列变化都属于复分解反应:①将石灰乳与纯碱溶液混合可制得苛性钠溶液;②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体;③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体。根据上述反应,总结出复分解反应发生的另一规律为
(3)常温下将某电解质溶解在水中后,溶液中的c(H+)=10−9mol·L−1,则该电解质可能是
a.CuSO4 b.HCl c.Na2S d.NaOH e.K2SO4
(4)常温下,将aLpH=3的盐酸分别与下列三种溶液混合,所得溶液均呈中性。
①bL浓度为1.0×10−3mol·L−1的氨水;
②cLc(OH−)=1.0×10−3mol·L−1的氨水;
③dLc(OH−)=1.0×10−3mol·L−1的氢氧化钠溶液。
则a、b、c、d的大小关系:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】常温下,浓度均为0.1 mol·L-1的六种溶液的pH如下表所示:
请回答下列问题:
(1)上述六种溶液中的阴离子,结合H+能力最强的是____________ (填离子符号)。
(2)上述六种溶液中,水的电离程度最小的是____________ (填化学式)。
(3)若欲增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是________ 、________ (每空填写一种物质)。
(4)依据复分解反应的规律,判断下列反应不能进行的是________ 。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaCN=Na2CO3+2HCN
(5)将CO2气体通入饱和碳酸钠溶液中,可以观察到的现象是_______ ,原因为_________ (用离子方程式表示)。
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |
请回答下列问题:
(1)上述六种溶液中的阴离子,结合H+能力最强的是
(2)上述六种溶液中,水的电离程度最小的是
(3)若欲增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是
(4)依据复分解反应的规律,判断下列反应不能进行的是
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaCN=Na2CO3+2HCN
(5)将CO2气体通入饱和碳酸钠溶液中,可以观察到的现象是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】"绿水青山就是金山银山",在造福人类的同时,保护环境也是化学必不可少的责任。磷酸铁锂电池由橄榄石结构的LiFePO4作为电池的正极,碳(石墨)吸附锂离子组成电池负极( ),电极上附着铝箔、铜箔。如图流程可以回收磷酸铁锂电池电极材料中的石墨并制备相应化工产品。
),电极上附着铝箔、铜箔。如图流程可以回收磷酸铁锂电池电极材料中的石墨并制备相应化工产品。

(1)LiFePO4中Fe的化合价为_______ ,滤渣I的主要成分除LFePO4还有_______ ,滤渣I中加入H2O2的目的是:_______ 。
(2)向滤液Ⅲ中通 H2S的目的是沉铜,当溶液中铜离子浓度为1×10-5mol/L时可认为铜离子沉淀完全,则此时溶液中S2-与Cu2+浓度之比为:_______ (已知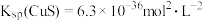 )。
)。
(3)碳酸锂在水中的溶解度随温度升高而减小,则操作X是_______ 。
a.静置、过滤 b.加热后,趁热过滤 c. 蒸发浓缩、冷却结晶 d.蒸发结晶
(4)回收后的Fe2O3可以与KOH和KNO3混合物加热共熔,从而制得净水剂高铁酸钾(K2FeO4)及其副产物KNO2,该反应的化学方程式为:_______ 。
(5)该流程中分离出的Li2CO3可以和NH4H2PO4及(CH3COO)2Fe制备正极材料LiFePO4,已知NH3·H2O的电离常数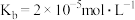 ,H3PO4的各级电离常数为
,H3PO4的各级电离常数为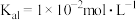 、
、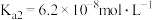 、
、 ,则常温下 NH4H2PO4溶液中
,则常温下 NH4H2PO4溶液中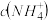
_______ 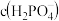 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
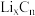 ),电极上附着铝箔、铜箔。如图流程可以回收磷酸铁锂电池电极材料中的石墨并制备相应化工产品。
),电极上附着铝箔、铜箔。如图流程可以回收磷酸铁锂电池电极材料中的石墨并制备相应化工产品。
(1)LiFePO4中Fe的化合价为
(2)向滤液Ⅲ中通 H2S的目的是沉铜,当溶液中铜离子浓度为1×10-5mol/L时可认为铜离子沉淀完全,则此时溶液中S2-与Cu2+浓度之比为:
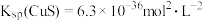 )。
)。(3)碳酸锂在水中的溶解度随温度升高而减小,则操作X是
a.静置、过滤 b.加热后,趁热过滤 c. 蒸发浓缩、冷却结晶 d.蒸发结晶
(4)回收后的Fe2O3可以与KOH和KNO3混合物加热共熔,从而制得净水剂高铁酸钾(K2FeO4)及其副产物KNO2,该反应的化学方程式为:
(5)该流程中分离出的Li2CO3可以和NH4H2PO4及(CH3COO)2Fe制备正极材料LiFePO4,已知NH3·H2O的电离常数
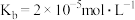 ,H3PO4的各级电离常数为
,H3PO4的各级电离常数为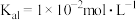 、
、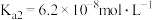 、
、 ,则常温下 NH4H2PO4溶液中
,则常温下 NH4H2PO4溶液中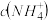
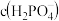 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
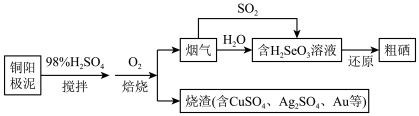
【推荐2】硒是人体和动物所必需的营养元素,在工农业生产中也有广阔的应用前景。从电解精炼铜的阳极泥(含有 、
、 、
、 、
、 、
、 、
、 等)中回收硒的工艺流程如图:
等)中回收硒的工艺流程如图:
资料:ⅰ. :315℃升华,易挥发,溶于水得
:315℃升华,易挥发,溶于水得 (
(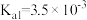 ,
, )。
)。
ⅱ. 能与
能与 生成硒代硫酸根(
生成硒代硫酸根(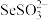 ),在强酸溶液中,硒代硫酸根(
),在强酸溶液中,硒代硫酸根(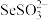 )分解生成
)分解生成 单质。
单质。
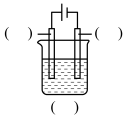
(1)实验室中电解精炼铜的简易装置如图所示,请在图中标出电极材料和电解液的名称_______ 。
(2)焙烧前,搅拌的目的是_______ 。
(3)阳极泥中的 与浓硫酸反应的化学方程式为
与浓硫酸反应的化学方程式为_______ 。
(4)常温下, 电离平衡体系中含
电离平衡体系中含 (+4价)微粒的物质的量分数与
(+4价)微粒的物质的量分数与 的关系如图所示。下列说法
的关系如图所示。下列说法不正确 的是_______ (填序号)。
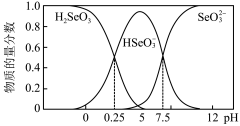
a.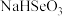 溶液显酸性
溶液显酸性
b. 时,溶液中存在
时,溶液中存在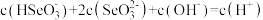
c. 溶液中,
溶液中,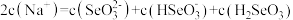
(5)探究硫酸浓度对 还原
还原 得到
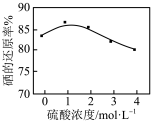
得到 的还原率的影响。相同投料比、相同反应时间,不同硫酸浓度对硒的还原率的影响如图。随着硫酸浓度的增大,硒的还原率先增大后减小的原因是
的还原率的影响。相同投料比、相同反应时间,不同硫酸浓度对硒的还原率的影响如图。随着硫酸浓度的增大,硒的还原率先增大后减小的原因是_______ 。
 、
、 、
、 、
、 、
、 、
、 等)中回收硒的工艺流程如图:
等)中回收硒的工艺流程如图:
资料:ⅰ.
 :315℃升华,易挥发,溶于水得
:315℃升华,易挥发,溶于水得 (
(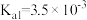 ,
, )。
)。ⅱ.
 能与
能与 生成硒代硫酸根(
生成硒代硫酸根(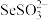 ),在强酸溶液中,硒代硫酸根(
),在强酸溶液中,硒代硫酸根(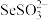 )分解生成
)分解生成 单质。
单质。(1)实验室中电解精炼铜的简易装置如图所示,请在图中标出电极材料和电解液的名称

(2)焙烧前,搅拌的目的是
(3)阳极泥中的
 与浓硫酸反应的化学方程式为
与浓硫酸反应的化学方程式为(4)常温下,
 电离平衡体系中含
电离平衡体系中含 (+4价)微粒的物质的量分数与
(+4价)微粒的物质的量分数与 的关系如图所示。下列说法
的关系如图所示。下列说法
a.
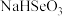 溶液显酸性
溶液显酸性b.
 时,溶液中存在
时,溶液中存在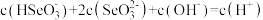
c.
 溶液中,
溶液中,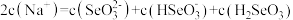
(5)探究硫酸浓度对
 还原
还原 得到
得到 的还原率的影响。相同投料比、相同反应时间,不同硫酸浓度对硒的还原率的影响如图。随着硫酸浓度的增大,硒的还原率先增大后减小的原因是
的还原率的影响。相同投料比、相同反应时间,不同硫酸浓度对硒的还原率的影响如图。随着硫酸浓度的增大,硒的还原率先增大后减小的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】水溶液中存在水的电离平衡。
(1)一定温度下,将某醋酸溶液加水稀释,溶液的导电能力变化导电能力如图所示。
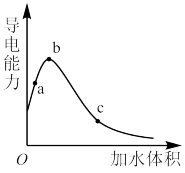
①用湿润的pH试纸测量c处溶液的pH,测量的结果___________ (填“无影响”、“偏小”或“偏大”), a 、b、c三点溶液的pH最大的是___________ (填“a”、“b”或“c”)点。
②a 、b、c三点溶液用1mol·L-1NaOH溶液中和,消耗NaOH溶液体积依次为Va、Vb、Vc,则Va、Vb、Vc大小关系为_______________________ 。
③25℃时,醋酸的电离常数Ka=1.8×10-5,则该温度下醋酸钠的水解平衡常数Kb=____ 。
(2)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。实际上硫酸在水中的第一步电离是完全的,第二步电离并不完全。
①硫酸的第一步电离方程式为__________________________________________ ,则H2SO4溶液与BaCl2溶液反应的离子方程式为______________________________ 。
②在0.1mol·L -1的Na2SO4溶液中,下列粒子浓度关系式正确的是______________ (填序号)。
A. c(OH- )=c(H+)+c(HSO ) B. c(
) B. c( )+c(HSO
)+c(HSO )= 2c(Na+)
)= 2c(Na+)
C. c( )+c(HSO
)+c(HSO )=0.lmol·L-1 D. c(Na+)+c(H+)=c(OH- )+c(HSO
)=0.lmol·L-1 D. c(Na+)+c(H+)=c(OH- )+c(HSO )
)
(3) K2CrO4常作指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO 生成砖红色沉淀来指示滴定终点。当Cl- 恰好完全沉淀(浓度等于1.0×10-5 mol·L-1)时,此时溶液中c(CrO
生成砖红色沉淀来指示滴定终点。当Cl- 恰好完全沉淀(浓度等于1.0×10-5 mol·L-1)时,此时溶液中c(CrO )为
)为___________________ mol·L-1(已知Ag2CrO4、AgCl 的Ksp分别为2.0×10-12和2.0×10-10)。
(1)一定温度下,将某醋酸溶液加水稀释,溶液的导电能力变化导电能力如图所示。

①用湿润的pH试纸测量c处溶液的pH,测量的结果
②a 、b、c三点溶液用1mol·L-1NaOH溶液中和,消耗NaOH溶液体积依次为Va、Vb、Vc,则Va、Vb、Vc大小关系为
③25℃时,醋酸的电离常数Ka=1.8×10-5,则该温度下醋酸钠的水解平衡常数Kb=
(2)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。实际上硫酸在水中的第一步电离是完全的,第二步电离并不完全。
①硫酸的第一步电离方程式为
②在0.1mol·L -1的Na2SO4溶液中,下列粒子浓度关系式正确的是
A. c(OH- )=c(H+)+c(HSO
 ) B. c(
) B. c( )+c(HSO
)+c(HSO )= 2c(Na+)
)= 2c(Na+)C. c(
 )+c(HSO
)+c(HSO )=0.lmol·L-1 D. c(Na+)+c(H+)=c(OH- )+c(HSO
)=0.lmol·L-1 D. c(Na+)+c(H+)=c(OH- )+c(HSO )
)(3) K2CrO4常作指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO
 生成砖红色沉淀来指示滴定终点。当Cl- 恰好完全沉淀(浓度等于1.0×10-5 mol·L-1)时,此时溶液中c(CrO
生成砖红色沉淀来指示滴定终点。当Cl- 恰好完全沉淀(浓度等于1.0×10-5 mol·L-1)时,此时溶液中c(CrO )为
)为
您最近一年使用:0次