钴的合金及其配合物用途非常广泛。已知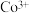 比
比 的氧化性更强,在水溶液中不能大量存在.
的氧化性更强,在水溶液中不能大量存在.
(1)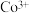 的核外电子排布式为
的核外电子排布式为_____________ 。
(2)无水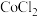 的熔点为
的熔点为 、沸点为
、沸点为 ,
, 熔点为
熔点为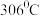 、沸点为
、沸点为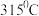 .
.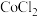 属于
属于_______ 晶体, 属于
属于_____ 晶体。
(3) 可用于激光起爆器等,可由
可用于激光起爆器等,可由 、
、 、
、 共反应制备.
共反应制备.
① 的空间构型为
的空间构型为______________________ 。
② 的化学式为
的化学式为 ,与
,与 (III)形成配位键的原子是
(III)形成配位键的原子是_____
已知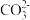 的结构式是
的结构式是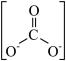
③ 可以
可以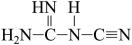 (双聚氰胺)为原料制备,
(双聚氰胺)为原料制备, 双聚氯胺分子中含
双聚氯胺分子中含 键的数目为
键的数目为___________ 。
(4) 与
与 作用可生成
作用可生成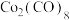 ,其结构如图所示,该分子中
,其结构如图所示,该分子中 原子的杂化方式为
原子的杂化方式为_____________________________ 。

(5)钴酸锂是常见锂电池的电极材料,其晶胞结构如图所示。该晶胞中氧原子的数目为______ 。已知 为阿伏伽德罗常数的数值,则该晶胞的密度为
为阿伏伽德罗常数的数值,则该晶胞的密度为______ (用含 、
、 、
、 的代数式表示)
的代数式表示)
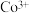 比
比 的氧化性更强,在水溶液中不能大量存在.
的氧化性更强,在水溶液中不能大量存在.(1)
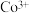 的核外电子排布式为
的核外电子排布式为(2)无水
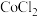 的熔点为
的熔点为 、沸点为
、沸点为 ,
, 熔点为
熔点为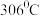 、沸点为
、沸点为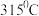 .
.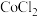 属于
属于 属于
属于(3)
 可用于激光起爆器等,可由
可用于激光起爆器等,可由 、
、 、
、 共反应制备.
共反应制备.①
 的空间构型为
的空间构型为②
 的化学式为
的化学式为 ,与
,与 (III)形成配位键的原子是
(III)形成配位键的原子是已知
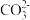 的结构式是
的结构式是
③
 可以
可以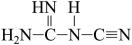 (双聚氰胺)为原料制备,
(双聚氰胺)为原料制备, 双聚氯胺分子中含
双聚氯胺分子中含 键的数目为
键的数目为(4)
 与
与 作用可生成
作用可生成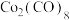 ,其结构如图所示,该分子中
,其结构如图所示,该分子中 原子的杂化方式为
原子的杂化方式为
(5)钴酸锂是常见锂电池的电极材料,其晶胞结构如图所示。该晶胞中氧原子的数目为
 为阿伏伽德罗常数的数值,则该晶胞的密度为
为阿伏伽德罗常数的数值,则该晶胞的密度为 、
、 、
、 的代数式表示)
的代数式表示)
更新时间:2019-05-09 10:26:49
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】二氧化硅是制造玻璃、石英玻璃、水玻璃、光导纤维、光学仪器、工艺品和耐火材料的原料,是科学研究的重要材料。
(1)Si原子中,能量最高的电子的电子云在空间有_______ 个伸展方向。
(2)原子核外的电子有两种相反的自旋状态,若一种自旋状态用“ ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于Si原子,其电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于Si原子,其电子自旋磁量子数的代数和为_______ 。
铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有 、
、 、CaO、MgO、
、CaO、MgO、 等氧化物。
等氧化物。
(3)O原子的最外层电子排布式为_______ ;上述元素中,与Fe原子最外层电子数目相同的元素的元素符号为_______ 。
(4)上述氧化物所涉及的元素中,处于元素周期表中副族的元素有_______ 种。
(5)原子失去电子需要吸收能量,吸收的能量越高,则表示电子越难以失去,请比较,失去第三个电子所需要的能量,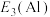
_______ 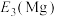 (填“>”或“<”),原因是
(填“>”或“<”),原因是_______ 。
(1)Si原子中,能量最高的电子的电子云在空间有
(2)原子核外的电子有两种相反的自旋状态,若一种自旋状态用“
 ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于Si原子,其电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于Si原子,其电子自旋磁量子数的代数和为铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有
 、
、 、CaO、MgO、
、CaO、MgO、 等氧化物。
等氧化物。(3)O原子的最外层电子排布式为
(4)上述氧化物所涉及的元素中,处于元素周期表中副族的元素有
(5)原子失去电子需要吸收能量,吸收的能量越高,则表示电子越难以失去,请比较,失去第三个电子所需要的能量,
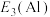
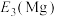 (填“>”或“<”),原因是
(填“>”或“<”),原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】金属材料对于促进生产发展、改善人类生活发挥了巨大作用。
I.钢是人类使用最早的金属之一,至今仍被广泛应用于电气、电子等领域。
(1)写出基态Cu原子的核外电子排布式___________ 。涩法冶炼是以赤铜矿( )精矿为主要原料,通过浸出、置换、电解等流程制备高坑度的工艺。
)精矿为主要原料,通过浸出、置换、电解等流程制备高坑度的工艺。
(2)赤铜矿在稀硫酸中浸出,得到硫酸铜溶液,该反应的离子方程式为___ 。
(3)已知: 晶胞为立方体形,边长为
晶胞为立方体形,边长为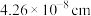 。根据图示,每个
。根据图示,每个 晶胞中含O原子的数目为
晶胞中含O原子的数目为___________ 个。计算 晶体的密度
晶体的密度
___________  (结果保留两位小数)。
(结果保留两位小数)。
(4)基态Na原子的价层电子轨道表示式为___________ 。
(5)NaCl熔点为:800.8℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式为:
 ,加入
,加入 的目的是
的目的是___________ 。
(6)除去 粉末中混有的少量
粉末中混有的少量 的方法是
的方法是___________ 。
Ⅲ.钛被誉为太空金属和亲生物金属,拥有卓越的金属特性。它在特定温度下能与多种物质发生反应,在生产和日常生活中都能找到它的踪影。
(7) 原子的价电子排布式为
原子的价电子排布式为 ,它在元素周期表中的位置是
,它在元素周期表中的位置是___________ 。
(8) 易与
易与 形成
形成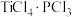 。下列关于
。下列关于 分子说法错误的是___________。
分子说法错误的是___________。
(9)钛溶于盐酸制得的三氯化钛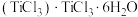 晶体有两种异构体:
晶体有两种异构体: (绿色)、
(绿色)、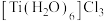 (紫色),两者配位数
(紫色),两者配位数___________ (选填“相同”或“不同”),绿色晶体中配体是___________ 。
I.钢是人类使用最早的金属之一,至今仍被广泛应用于电气、电子等领域。
(1)写出基态Cu原子的核外电子排布式
 )精矿为主要原料,通过浸出、置换、电解等流程制备高坑度的工艺。
)精矿为主要原料,通过浸出、置换、电解等流程制备高坑度的工艺。(2)赤铜矿在稀硫酸中浸出,得到硫酸铜溶液,该反应的离子方程式为
(3)已知:
 晶胞为立方体形,边长为
晶胞为立方体形,边长为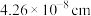 。根据图示,每个
。根据图示,每个 晶胞中含O原子的数目为
晶胞中含O原子的数目为 晶体的密度
晶体的密度
 (结果保留两位小数)。
(结果保留两位小数)。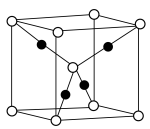
(4)基态Na原子的价层电子轨道表示式为
(5)NaCl熔点为:800.8℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式为:

 ,加入
,加入 的目的是
的目的是(6)除去
 粉末中混有的少量
粉末中混有的少量 的方法是
的方法是Ⅲ.钛被誉为太空金属和亲生物金属,拥有卓越的金属特性。它在特定温度下能与多种物质发生反应,在生产和日常生活中都能找到它的踪影。
(7)
 原子的价电子排布式为
原子的价电子排布式为 ,它在元素周期表中的位置是
,它在元素周期表中的位置是(8)
 易与
易与 形成
形成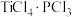 。下列关于
。下列关于 分子说法错误的是___________。
分子说法错误的是___________。| A.键角为120° | B.是极性分子 |
C.含有 键 键 | D.中心原子采取 杂化 杂化 |
(9)钛溶于盐酸制得的三氯化钛
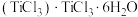 晶体有两种异构体:
晶体有两种异构体: (绿色)、
(绿色)、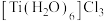 (紫色),两者配位数
(紫色),两者配位数
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】按要求填空
(1)在第二周期中(稀有气体除外),第一电离能最大的元素的原子结构示意图是_______ ,第一电离能最小的元素的原子轨道表达式_____________ 。
(2)第四周期元素中,4p轨道半充满的元素是_____________ (填元素符号)价电子层中s电子数与d电子数相同的元素是________ 填元素名称)。
(3)中国古代四大发明之一——黑火药,它的爆炸反应方程式为:
2KNO3+3C+S A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除K、S外,上述方程式中出现的元素形成氢化物的稳定性从大到小依次为____________ 。
②写出K的基态电子排布式___________________________
(1)在第二周期中(稀有气体除外),第一电离能最大的元素的原子结构示意图是
(2)第四周期元素中,4p轨道半充满的元素是
(3)中国古代四大发明之一——黑火药,它的爆炸反应方程式为:
2KNO3+3C+S
 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)①除K、S外,上述方程式中出现的元素形成氢化物的稳定性从大到小依次为
②写出K的基态电子排布式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】回答下列问题。
(1)Cu在元素周期表的位置:___________ ,元素周期表分区为:___________ 。
(2)在SO2分子中,S原子采取___________ 杂化,SO2的键角___________ (填“大于”“等于”或“小于”)120°,SO2分子的空间结构为___________ ,SO3分子中S原子采取___________ 杂化,SO3分子的空间结构为___________ 。
(3) 的空间结构是
的空间结构是___________ ,N原子采取___________ 杂化。
(4) 、
、 的空间结构分别为
的空间结构分别为___________ ,S原子的杂化轨道类型分别为___________ 、___________ 。
(1)Cu在元素周期表的位置:
(2)在SO2分子中,S原子采取
(3)
 的空间结构是
的空间结构是(4)
 、
、 的空间结构分别为
的空间结构分别为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】我国是世界上最早制得和使用铜的国家,铜及其化合物在日常生产和生活中有着广泛的应用。回答下列问题:
(1)Cu在元素周期表中位_______ 区,基态Cu2+价层电子的电子排布图(轨道表达式)为_______ 。
(2)由Cu2+形成的配合物种类繁多,在配离子[Cu(NH3)4]2+中,其配体的立体构型为_______ , 在[Cu(CN)4] 2−中,与其配体互为等电子体的一种分子是_______ (写化学式)。
(3)Cu2+能与吡咯( )的阴离子(
)的阴离子(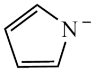 )形成双吡咯铜。
)形成双吡咯铜。
① 中C和N原子的杂化均为
中C和N原子的杂化均为_______ 。
②1mol 含有
含有_______ molσ键,分子中的大π键可用符号π 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为π ,则
,则 中的大π键应表示为
中的大π键应表示为_______ 。
(4)试从原子结构角度解释在高温下CuO能分解生成Cu2O的原因_______ 。
(5)高温超导体“钇钡铜氧”广泛应用于超导输电、磁悬浮列车等,其晶胞结构如图:
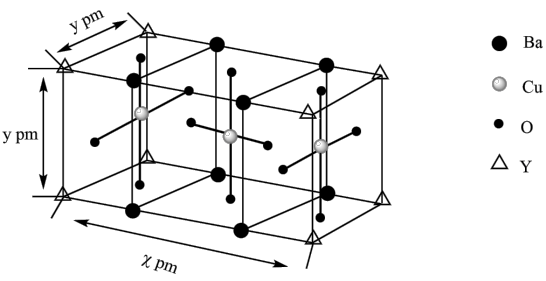
该物质以Y2O3、BaCO3和CuO为原料烧结而成,其原料物质的量之比为_______ ,若阿伏加德罗常数的值为NA,则该晶体的密度为_______ g·cm−3(列出计算表达式)。
(1)Cu在元素周期表中位
(2)由Cu2+形成的配合物种类繁多,在配离子[Cu(NH3)4]2+中,其配体的立体构型为
(3)Cu2+能与吡咯(
 )的阴离子(
)的阴离子( )形成双吡咯铜。
)形成双吡咯铜。①
 中C和N原子的杂化均为
中C和N原子的杂化均为②1mol
 含有
含有 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为π ,则
,则 中的大π键应表示为
中的大π键应表示为(4)试从原子结构角度解释在高温下CuO能分解生成Cu2O的原因
(5)高温超导体“钇钡铜氧”广泛应用于超导输电、磁悬浮列车等,其晶胞结构如图:

该物质以Y2O3、BaCO3和CuO为原料烧结而成,其原料物质的量之比为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】镍的化合物因具有物理特殊性而被广泛应用于现代科技。回答下列问题:
(1)基态Ni2+的价层电子的轨道表示式为_______ 。
(2)镍离子有多种配合物,其中水杨醛合镍(II)的结构如图所示:
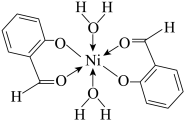
①Ni2+的配位数是_______ ,其无机物配体是H2O分子,形成配位键时H2O分子中的_______ 原子提供_______ (填“孤电子对”或“空轨道”)。
②有机物配体中的碳原子的杂化轨道类型是_______ 。
(3)Ni、Y(钇)、B、C形成的一种具有超导电性的化合物的结构属于四方晶系,其结构如图所示:
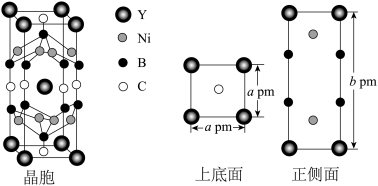
①该晶体中距离C原子最近的Ni原子的个数是_______ 。
②在正侧面图中碳原子的位置是_______ 。
③若Ni的原子半径为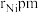 ,则Ni原子的空间占有率为
,则Ni原子的空间占有率为_______ (列出计算式)。
(1)基态Ni2+的价层电子的轨道表示式为
(2)镍离子有多种配合物,其中水杨醛合镍(II)的结构如图所示:

①Ni2+的配位数是
②有机物配体中的碳原子的杂化轨道类型是
(3)Ni、Y(钇)、B、C形成的一种具有超导电性的化合物的结构属于四方晶系,其结构如图所示:

①该晶体中距离C原子最近的Ni原子的个数是
②在正侧面图中碳原子的位置是
③若Ni的原子半径为
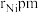 ,则Ni原子的空间占有率为
,则Ni原子的空间占有率为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17种元素。稀土元素有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,基态原子电子排布式为____ 。
(2)离子化合物Na3[Sc(OH)6]中,存在的化学键除离子键外还有__ 。
(3)Sm(钐)的单质与l,2-二碘乙烷可生成乙烯:Sm + ICH2CH2I →SmI2+ CH2=CH2。
则lmol CH2=CH2中含有的σ键数目为___ 。(用NA表示阿伏加 德罗常数的值)
(4)与N3-互为等电子体的分子有___ (写其中一个的化学式即可)。
(5)Ce(铈)单质为面心立方晶体,其晶胞参数a=516pm。Ce(铈)原子的配位数为___ ,列式表示Ce(铈)单质的密度:___ g/cm3(用NA表示阿伏加 德罗常数的值,不必计算出结果)

(1)钪(Sc)为21号元素,基态原子电子排布式为
(2)离子化合物Na3[Sc(OH)6]中,存在的化学键除离子键外还有
(3)Sm(钐)的单质与l,2-二碘乙烷可生成乙烯:Sm + ICH2CH2I →SmI2+ CH2=CH2。
则lmol CH2=CH2中含有的σ键数目为
(4)与N3-互为等电子体的分子有
(5)Ce(铈)单质为面心立方晶体,其晶胞参数a=516pm。Ce(铈)原子的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】O、S、Se、Te是元素周期表中第ⅥA族元素。
(1)第ⅥA族元素原子的价层电子排布式为_______ 。
(2)常压下, 、
、 、
、 的沸点分别为100℃、-61℃和-41℃,三者沸点差异的原因为
的沸点分别为100℃、-61℃和-41℃,三者沸点差异的原因为_______ 。
(3)半胱氨酸亚金钠可用于配制无氰镀金溶液,其结构简式如图所示。
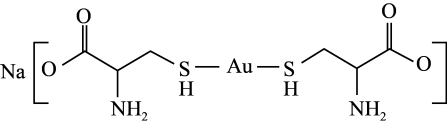
①半胱氨酸亚金钠中,碳原子的杂化轨道类型为_______ 。
②半胱氨酸亚金钠晶体中,不存在的化学键是_______ (填标号)。
A.共价键 B.离子键 C.金属键 D.配位键
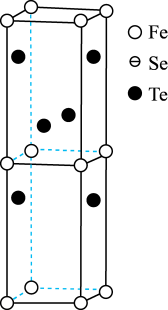
(4)FexSeyTez是一种准二维结构的铁系超导材料,其晶胞示意图如图所示。
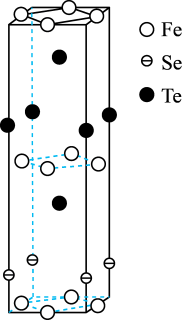
①
_______ 。
②若以铁原子为晶胞顶点,请在图中补画出铁、硒原子_______ 。
(1)第ⅥA族元素原子的价层电子排布式为
(2)常压下,
 、
、 、
、 的沸点分别为100℃、-61℃和-41℃,三者沸点差异的原因为
的沸点分别为100℃、-61℃和-41℃,三者沸点差异的原因为(3)半胱氨酸亚金钠可用于配制无氰镀金溶液,其结构简式如图所示。
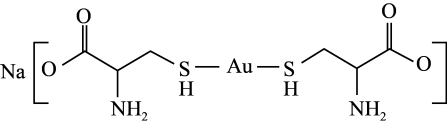
①半胱氨酸亚金钠中,碳原子的杂化轨道类型为
②半胱氨酸亚金钠晶体中,不存在的化学键是
A.共价键 B.离子键 C.金属键 D.配位键
(4)FexSeyTez是一种准二维结构的铁系超导材料,其晶胞示意图如图所示。

①

②若以铁原子为晶胞顶点,请在图中补画出铁、硒原子

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】据 科技日报
科技日报 报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成含氧化合物。
报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成含氧化合物。
请回答下列问题:
⑴在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”,该原子的外围电子排布式为____________ 。
⑵在第四周期过渡金属中,基态原子第一电离能最大的元素是___________ (填元素符号)。
⑶铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为________________ 。
⑷常温下,H2O2氧化CH4生成CH3OH、HCHO、 HCOOH等。
①CH3OH、HCHO、 HCOOH的沸点分别为64.7℃、-195℃、100.8℃,其主要原因是____________________ ;
②CH4和HCHO比较,键角较大的是_________ ,该分子的空间构型为____________ 。
⑸配离子中受配体的影响,中心离子同能级d轨道的能量不同,人们把1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量称为d的分裂能,用符号 表示。分裂能大小一般与配体种类和中心离子所带电荷数有关。据此判断分裂能Δ[Co(H2O)6]2+
表示。分裂能大小一般与配体种类和中心离子所带电荷数有关。据此判断分裂能Δ[Co(H2O)6]2+________ Δ[Co(H2O)6]3+(填“>”“<”或“=” ,理由是
,理由是____________ 。
⑹钴晶胞和白铜(铜镍合金)晶胞如图所示。

①钴晶胞堆积方式的名称为____________ ;
②已知白铜晶胞的密度为dg∙cm-3,NA代表阿伏加 德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为____________ pm(列出计算式)。
 科技日报
科技日报 报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成含氧化合物。
报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成含氧化合物。请回答下列问题:
⑴在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”,该原子的外围电子排布式为
⑵在第四周期过渡金属中,基态原子第一电离能最大的元素是
⑶铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为
⑷常温下,H2O2氧化CH4生成CH3OH、HCHO、 HCOOH等。
①CH3OH、HCHO、 HCOOH的沸点分别为64.7℃、-195℃、100.8℃,其主要原因是
②CH4和HCHO比较,键角较大的是
⑸配离子中受配体的影响,中心离子同能级d轨道的能量不同,人们把1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量称为d的分裂能,用符号
 表示。分裂能大小一般与配体种类和中心离子所带电荷数有关。据此判断分裂能Δ[Co(H2O)6]2+
表示。分裂能大小一般与配体种类和中心离子所带电荷数有关。据此判断分裂能Δ[Co(H2O)6]2+ ,理由是
,理由是⑹钴晶胞和白铜(铜镍合金)晶胞如图所示。

①钴晶胞堆积方式的名称为
②已知白铜晶胞的密度为dg∙cm-3,NA代表阿伏加 德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】H、N、O、S、Ni、As为元素周期表中1~4周期元素。请回答下列问题:
(1)上述元素中第一电离能最大的元素符号是___________ ,电负性最大的元素的原子其价电子轨道表示式为___________ 。
(2)CH3NO2中C和N的原子轨道杂化方式分别为___________ 、___________ 。
(3)SO32-其空间构型为___________ 。写出一种与该酸根等电子体的微粒___________ 。
(4)NH3极易溶于水其原因除二者都为极性分子外,另一个重要原因是___________ 。
(5)Ni与As形成的一种化合物,其晶体如图所示,属六方晶系。
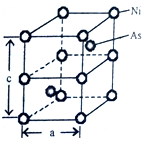
①该晶体的化学式为___________ ,As原子的配位数为___________ 。
②已知晶胞参数a=360.2pm,c=500.9pm,此晶体的密度为___________ g·cm-3。(写出计算式,NA为阿伏伽德罗常数的值)
(1)上述元素中第一电离能最大的元素符号是
(2)CH3NO2中C和N的原子轨道杂化方式分别为
(3)SO32-其空间构型为
(4)NH3极易溶于水其原因除二者都为极性分子外,另一个重要原因是
(5)Ni与As形成的一种化合物,其晶体如图所示,属六方晶系。

①该晶体的化学式为
②已知晶胞参数a=360.2pm,c=500.9pm,此晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】电池在人类生产生活中具有十分重要的作用,单晶硅和铜、锗、镓等的化合物常作为制备太阳能电池的原料。回答下列问题:
(1)基态镓原子的价层电子排布图是___________ 。
(2)四氯化硅属于___________ 晶体,硅原子的杂化方式是___________ 。
(3)下列锗卤化物的熔点和沸点,产生该变化规律的原因是___________ 。
(4)比较键角∠HNH:H2N−NH2中的−NH2___________ H2N−NH 中的−NH
中的−NH (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由___________ 。
(5)下图为铜的某种氯化物晶胞示意图,试回答下列问题___________ 。原子坐标参数可表示晶胞内部各原子的相对位置,图中各原子标参数分别为A(0,0,0);B(0,1,1);C(1,1,0);则D原子的坐标参数为___________ 。
②晶胞中C、D两原子核间距为298pm,阿伏加德罗常数的值为NA,则该晶体的密度___________ g/cm3(列出计算式即可)。
(1)基态镓原子的价层电子排布图是
(2)四氯化硅属于
(3)下列锗卤化物的熔点和沸点,产生该变化规律的原因是
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(4)比较键角∠HNH:H2N−NH2中的−NH2
 中的−NH
中的−NH (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由(5)下图为铜的某种氯化物晶胞示意图,试回答下列问题
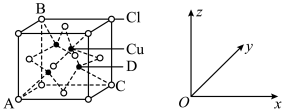
②晶胞中C、D两原子核间距为298pm,阿伏加德罗常数的值为NA,则该晶体的密度
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】Na3Zr2Si2PO12是一种具有交叉隧道三维结构的快离子导体功能材料。回答下列问题:
(1)40Zr位于周期表的第5周期IVB族,基态40Zr的价电子排布式为___________ ;第四周期元素中,基态原子核外成单电子数与基态40Zr相同且第一电离能最大的是___________ 。
(2)NH3、PH3和AsH3的沸点由高到低的顺序是___________ 。
(3)N(CH3)3和P(CH3)3是重要的化工原料。N(CH3)3中N原子的杂化方式为___________ ;键角C—N—C大于C—P—C的原因是___________ 。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。Na3OCl属立方晶系(正方体形),晶胞参数为a pm。晶胞沿y轴和沿z轴投影的各原子的分布图和原子分数坐标分别如图1、图2所示。据此推断该晶胞中Na原子的数目为___________ 。设NA为阿伏加德罗常数的值,则Na3OC1晶体的密度为___________ g·cm-3(用代数式表示)。
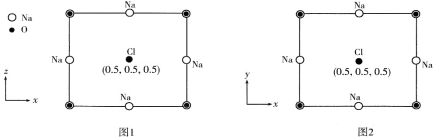
(1)40Zr位于周期表的第5周期IVB族,基态40Zr的价电子排布式为
(2)NH3、PH3和AsH3的沸点由高到低的顺序是
(3)N(CH3)3和P(CH3)3是重要的化工原料。N(CH3)3中N原子的杂化方式为
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。Na3OCl属立方晶系(正方体形),晶胞参数为a pm。晶胞沿y轴和沿z轴投影的各原子的分布图和原子分数坐标分别如图1、图2所示。据此推断该晶胞中Na原子的数目为

您最近一年使用:0次



