解题方法
1 . 海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
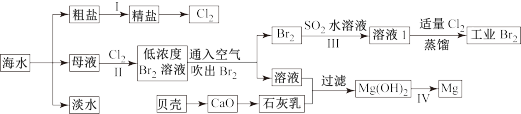
请回答下列问题:
Ⅰ.(1)步骤1中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式_________________ 。
(2)海水提溴,制得1mol Br2需要消耗_________ mol Cl2。步骤Ⅱ中需要向母液中加入稀硫酸酸化,其作用是___________________________ 。步骤Ⅲ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为_______________________________ 。
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2,可向其中加入__________ 溶液。
Ⅱ.(1)Mg在元素周期表中的位置:_____________ ,Mg(OH)2的电子式:____________ ,Mg(OH)2中所含元素的简单离子半径由小到大的顺序是____________________________ 。
(2)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是_______________ (填序号)。
A.Mg(OH)2→MgCl2 Mg B. Mg(OH)2
Mg B. Mg(OH)2 MgO
MgO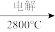 Mg
Mg
C. Mg(OH)2 MgO
MgO  Mg D. Mg(OH)2
Mg D. Mg(OH)2 无水MgCl2
无水MgCl2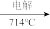 Mg
Mg
(3)判断Mg(OH)2是否洗涤干净的操作是__________________ 。
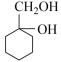
Ⅲ. 用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
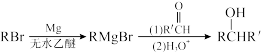 (R:烃基: R':烃基或H)依据上述信息,写出制备
(R:烃基: R':烃基或H)依据上述信息,写出制备 所需溴代烃的可能结构简式:
所需溴代烃的可能结构简式: ___________ 。

请回答下列问题:
Ⅰ.(1)步骤1中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式
(2)海水提溴,制得1mol Br2需要消耗
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2,可向其中加入
Ⅱ.(1)Mg在元素周期表中的位置:
(2)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是
A.Mg(OH)2→MgCl2
 Mg B. Mg(OH)2
Mg B. Mg(OH)2 MgO
MgO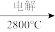 Mg
MgC. Mg(OH)2
 MgO
MgO  Mg D. Mg(OH)2
Mg D. Mg(OH)2 无水MgCl2
无水MgCl2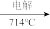 Mg
Mg(3)判断Mg(OH)2是否洗涤干净的操作是
Ⅲ. 用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
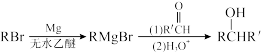 (R:烃基: R':烃基或H)依据上述信息,写出制备
(R:烃基: R':烃基或H)依据上述信息,写出制备 所需溴代烃的可能结构简式:
所需溴代烃的可能结构简式:
您最近一年使用:0次
名校
2 . (一)如图是部分短周期主族元素的原子序数与其最高或最低化合价的关系图(用原子序数代表所对应的元素),已知a为元素周期表中相对原子质量最小的元素,请回答下列问题:
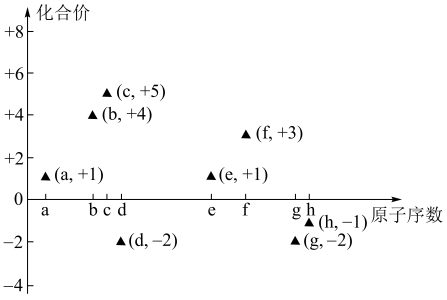
(1)a与c、d分别都可以形成有18个电子的分子甲和乙,甲分子的电子式_____ ,乙分子类型属于____ 分子(填“极性”或“非极性”)。
(2)b元素的一种单质丙可与g元素的最高价含氧酸丁的溶液反应,该反应的化学方程式为_____ ,如果一次性取样分别检验上述反应的生成物,按照最简单的操作顺序写出所用试剂的名称_____ 。
(3)f元素的单质可与e元素的最高价氧化物对应水化物反应放出氢气,该反应的化学方程式为_____ ,f元素的两种盐溶液也可以反应得到f元素最高价氧化物对应的水化物,该反应的离子方程式为_____ 。
(二)过渡金属在社会生产、生活发展中具有重要作用。
(4)原子序数21~30的元素中,基态电子排布未成对电子最多的元素在周期表的位置_____ ,其价电子排布图为____ 。
(5)铁单质和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,该反应的化学方程式为______ 。若该晶体的密度是ρg•cm-3,则两个最近的Fe原子间的距离为_____ cm。(用NA表示阿伏加德罗常数的值)
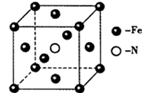
(6)铁的一种配合物的化学式为Fe[(Htrz)3](ClO4)2,其中Htrz为1,2,4—三氮唑()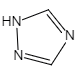 。
。
①配合物中阴离子的空间构型为_____ ,中心原子的杂化方式是_____ 。
② 分子中含σ键与π键个数比为
分子中含σ键与π键个数比为______ 。
③1摩尔1,2,4—三氮唑最多能与_____ molH+结合。
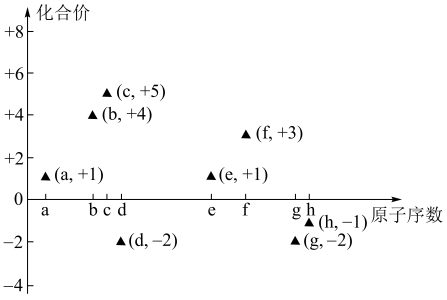
(1)a与c、d分别都可以形成有18个电子的分子甲和乙,甲分子的电子式
(2)b元素的一种单质丙可与g元素的最高价含氧酸丁的溶液反应,该反应的化学方程式为
(3)f元素的单质可与e元素的最高价氧化物对应水化物反应放出氢气,该反应的化学方程式为
(二)过渡金属在社会生产、生活发展中具有重要作用。
(4)原子序数21~30的元素中,基态电子排布未成对电子最多的元素在周期表的位置
(5)铁单质和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,该反应的化学方程式为

(6)铁的一种配合物的化学式为Fe[(Htrz)3](ClO4)2,其中Htrz为1,2,4—三氮唑()
 。
。①配合物中阴离子的空间构型为
②
 分子中含σ键与π键个数比为
分子中含σ键与π键个数比为③1摩尔1,2,4—三氮唑最多能与
您最近一年使用:0次
2022-01-13更新
|
163次组卷
|
2卷引用:天津市耀华中学2021-2022学年高三上学期第二次月考化学试题
名校
3 . 现有下列短周期元素性质的有关数据:
(1)根据元素周期律确定a至h8种元素在周期表中的位置,将它们的元素编号填入下表相应的空格内_______ 。
(2)上述元素形成的常见氢化物中,分子间存在氢键的有(填氢化物的化学式)_______ 。
(3)氢化铝锂( )是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请画出这种还原剂的电子式
)是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请画出这种还原剂的电子式_______ 。写出该物质受热分解的反应方程式_______ 。
(4)在元素周期表中,相邻近的元素在结构和性质上有许多相似之处。第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除 外,还有
外,还有 ;碳元素的氢化物除
;碳元素的氢化物除 外,还有
外,还有 等;与之相似的氮元素的氢化物除
等;与之相似的氮元素的氢化物除 外,还有
外,还有_______ (填化学式),其沸点比液氨_______ (填“高”或“低”),稳定性比氨_______ (填“好”或“差”),该氢化物与足量盐酸反应的化学方程式为_______ 。
| 元素编号 | a | b | c | d | e | f | g | h |
| 原子半径/nm | 0.037 | 0.071 | 0.075 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最底 | 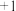 |  |  |  |  |  | 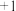 | 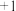 |
(1)根据元素周期律确定a至h8种元素在周期表中的位置,将它们的元素编号填入下表相应的空格内
| Ⅰ族 | Ⅱ族 | Ⅲ族 | Ⅳ族 | Ⅴ族 | Ⅵ族 | Ⅶ族 | Ⅷ族 | |
| 第一周期 | ||||||||
| 第二周期 | ||||||||
| 第三周期 |
(2)上述元素形成的常见氢化物中,分子间存在氢键的有(填氢化物的化学式)
(3)氢化铝锂(
 )是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请画出这种还原剂的电子式
)是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请画出这种还原剂的电子式(4)在元素周期表中,相邻近的元素在结构和性质上有许多相似之处。第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除
 外,还有
外,还有 ;碳元素的氢化物除
;碳元素的氢化物除 外,还有
外,还有 等;与之相似的氮元素的氢化物除
等;与之相似的氮元素的氢化物除 外,还有
外,还有
您最近一年使用:0次
名校
4 . 相对分子质量为92的某芳香烃X是一种重要的有机化工原料,以X为初始原料设计出转化关系图(部分产物、合成路线、反应条件略去),其中A是一氯代物;H是一种功能高分子,链节组成为C7H5NO。
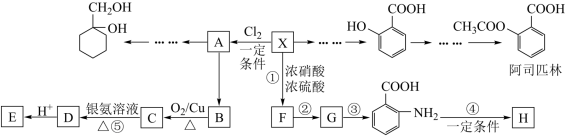
已知:Ⅰ.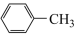

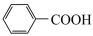
Ⅱ.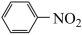

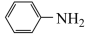 (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
(1)阿司匹林中含有的官能团的名称 是_____ ,H的结构简式是_____ 。
(2)X→A的反应条件是_____ ,编号①-⑤的反应反应类型相同的是_____ 。
(3)反应②、③的顺序如果颠倒会如何?_____ 。
(4)反应⑤的化学方程式是_____ 。
(5)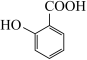 有多种同分异构体,能够发生银镜反应的芳香族化合物的同分异构体有
有多种同分异构体,能够发生银镜反应的芳香族化合物的同分异构体有_____ 种;写出其中核磁共振氢谱具有四种吸收峰的同分异构体的结构简式____ 。
(6)请用合成反应流程图表示出:由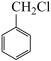 和其他无机物合成
和其他无机物合成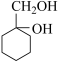 最合理的方案(不超过4步)。
最合理的方案(不超过4步)。_____ 。
例:
 ……
……

已知:Ⅰ.


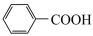
Ⅱ.
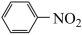

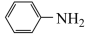 (苯胺,易被氧化)
(苯胺,易被氧化)请根据所学知识与本题所给信息回答下列问题:
(1)阿司匹林中含有的官能团的
(2)X→A的反应条件是
(3)反应②、③的顺序如果颠倒会如何?
(4)反应⑤的化学方程式是
(5)
 有多种同分异构体,能够发生银镜反应的芳香族化合物的同分异构体有
有多种同分异构体,能够发生银镜反应的芳香族化合物的同分异构体有(6)请用合成反应流程图表示出:由
 和其他无机物合成
和其他无机物合成 最合理的方案(不超过4步)。
最合理的方案(不超过4步)。例:

 ……
……

您最近一年使用:0次
名校
5 . 某钙钛矿 是一种新型半导体材料,用于制造太阳能电池。可用
是一种新型半导体材料,用于制造太阳能电池。可用 、
、 、
、 、
、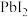 制备钙钛矿。
制备钙钛矿。
(1)晶体 属于
属于_______ 。
A.离子晶体 B.分子晶体 C.共价晶体
(2)设计实验比较 在
在 、水中的溶解性:
、水中的溶解性:_______ 。
(3)制备 的过程如下所示:
的过程如下所示: 。
。
①Ⅰ中, 的沸点高于
的沸点高于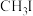 的沸点,原因是
的沸点,原因是 分子存在
分子存在_______ 。
②Ⅱ中,由于 分子中的
分子中的_______ (填元素符号)具有孤电子对,容易与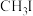 反应生成盐
反应生成盐 。
。
(4)钙钛矿的稳定性受空气中 、
、 、紫外线等因素的影响。
、紫外线等因素的影响。
ⅰ.
ⅱ.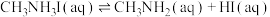
研究发现,一旦生成HI,钙钛矿的分解程度就会增大,请结合离子方程式和化学平衡移动原理解释:_______ 。
(5)在钙钛矿中引入有机物M能抑制离子扩散,增加其稳定性。M的逆合成分析如图:

①羧酸A的结构简式为_______ 。
②M中官能团的名称:_______ 。该分子含有手性碳的个数为_______ 。
③以乙醇为起始原料,选用必要的无机试剂合成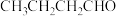 ,写出合成路线
,写出合成路线_______ 。(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
 是一种新型半导体材料,用于制造太阳能电池。可用
是一种新型半导体材料,用于制造太阳能电池。可用 、
、 、
、 、
、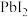 制备钙钛矿。
制备钙钛矿。(1)晶体
 属于
属于A.离子晶体 B.分子晶体 C.共价晶体
(2)设计实验比较
 在
在 、水中的溶解性:
、水中的溶解性:(3)制备
 的过程如下所示:
的过程如下所示: 。
。①Ⅰ中,
 的沸点高于
的沸点高于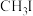 的沸点,原因是
的沸点,原因是 分子存在
分子存在②Ⅱ中,由于
 分子中的
分子中的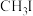 反应生成盐
反应生成盐 。
。(4)钙钛矿的稳定性受空气中
 、
、 、紫外线等因素的影响。
、紫外线等因素的影响。ⅰ.

ⅱ.
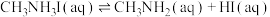
研究发现,一旦生成HI,钙钛矿的分解程度就会增大,请结合离子方程式和化学平衡移动原理解释:
(5)在钙钛矿中引入有机物M能抑制离子扩散,增加其稳定性。M的逆合成分析如图:

①羧酸A的结构简式为
②M中官能团的名称:
③以乙醇为起始原料,选用必要的无机试剂合成
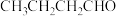 ,写出合成路线
,写出合成路线
您最近一年使用:0次
6 . 锂在有机合成、电池等领域中有重要的作用。
I. 的制备和应用如下图所示。
的制备和应用如下图所示。
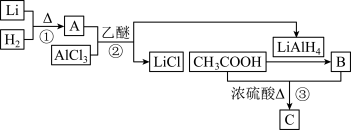
(1)锂元素在元素周期表中的位置_______________________ 。
(2)写出A的电子式___________________________ 。
(3) 是有机合成中常用的还原剂,试写出反应③的化学方程式
是有机合成中常用的还原剂,试写出反应③的化学方程式_________________ 。
II.磷酸亚铁锂是新型锂离子电池的首选电极材料,是以铁棒为阳极,石墨为阴极,电解磷酸二氢铵、氯化锂混合溶液,析出磷酸亚铁锂沉淀,在800℃左右、惰性气体氛围中煅烧制得。在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
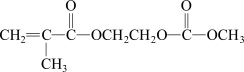
请回答下列问题:
(4)制备磷酸亚铁锂必须在惰性气体氛围中进行,其原因是_______________ 。
(5)阳极生成磷酸亚铁锂的电极反应式为___________________ 。
(6)写出M与足量氢氧化钠溶液反应的化学方程式_____________________ 。
(7)该电池充电时阳极的磷酸亚铁锂生成磷酸铁,则放电时正极的电极反应式为___________ 。
I.
 的制备和应用如下图所示。
的制备和应用如下图所示。
(1)锂元素在元素周期表中的位置
(2)写出A的电子式
(3)
 是有机合成中常用的还原剂,试写出反应③的化学方程式
是有机合成中常用的还原剂,试写出反应③的化学方程式II.磷酸亚铁锂是新型锂离子电池的首选电极材料,是以铁棒为阳极,石墨为阴极,电解磷酸二氢铵、氯化锂混合溶液,析出磷酸亚铁锂沉淀,在800℃左右、惰性气体氛围中煅烧制得。在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
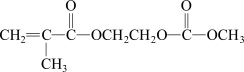
请回答下列问题:
(4)制备磷酸亚铁锂必须在惰性气体氛围中进行,其原因是
(5)阳极生成磷酸亚铁锂的电极反应式为
(6)写出M与足量氢氧化钠溶液反应的化学方程式
(7)该电池充电时阳极的磷酸亚铁锂生成磷酸铁,则放电时正极的电极反应式为
您最近一年使用:0次
2019-04-29更新
|
313次组卷
|
2卷引用:【区级联考】天津市和平区2019届高三下学期二模考试化学试题
解题方法
7 . 药物Targretin(F)能治疗顽固性皮肤T-细胞淋巴瘤,其合成路线如下图所示:

(1)反应①、②的反应类型分别是_________ 。
(2)反应④的化学方程式:_______________ 。
(3)E的结构简式是_____________________ 。
(4)如何检验D中的官能团________ 。
(5)F的分子式是C24H28O2。F中含有的官能团:_______ 。
(6)写出满足下列条件A的两种同分异构体的结构简式(不考虑-O-O-或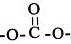 结构):
结构):_______________ 。
a.苯环上的一氯代物有两种 b.既能发生银镜反应又能发生水解反应
(7)已知: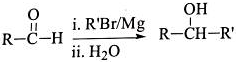 (R、R′为烃基))以HOCH2CH2OH为原料,选用必要的无机试剂合成
(R、R′为烃基))以HOCH2CH2OH为原料,选用必要的无机试剂合成 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。______________________________ 。

(1)反应①、②的反应类型分别是
(2)反应④的化学方程式:
(3)E的结构简式是
(4)如何检验D中的官能团
(5)F的分子式是C24H28O2。F中含有的官能团:
(6)写出满足下列条件A的两种同分异构体的结构简式(不考虑-O-O-或
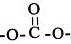 结构):
结构):a.苯环上的一氯代物有两种 b.既能发生银镜反应又能发生水解反应
(7)已知:
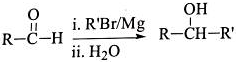 (R、R′为烃基))以HOCH2CH2OH为原料,选用必要的无机试剂合成
(R、R′为烃基))以HOCH2CH2OH为原料,选用必要的无机试剂合成 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
您最近一年使用:0次
名校
解题方法
8 . A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大。A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一。请用化学用语回答下列问题:
(1)F在元素周期表中的位置为_______________ 。
(2)常温下,液态的B2A4与气态的BC2两者发生反应生成无毒物质,16g B2A4发生反应放热akJ,该反应的热化学方程式为____________________________________________ 。
(3)D2E溶液在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色,H的电子式为_________________ 。写出在空气中长期放置生成H的化学反应方程式为:___________________________________ 。H的溶液与稀硫酸反应产生的现象为____________________________________ 。
(4)化学家发现一种化学式为A4B4的离子化合物,一定条件下1mol 熔融A4B4电离生成两种离子各1mol,则该物质熔融时的电离方程式为____________________________________ 。
(5)向30mL某浓度由A、B、C、D中三种元素形成的一元强碱溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。则曲线Y表明M中的溶质为_______________ ;原NaOH溶液的物质的量浓度为____________ ;由曲线X、Y可知,两次实验通入的CO2的体积比为_________ 。

(1)F在元素周期表中的位置为
(2)常温下,液态的B2A4与气态的BC2两者发生反应生成无毒物质,16g B2A4发生反应放热akJ,该反应的热化学方程式为
(3)D2E溶液在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色,H的电子式为
(4)化学家发现一种化学式为A4B4的离子化合物,一定条件下1mol 熔融A4B4电离生成两种离子各1mol,则该物质熔融时的电离方程式为
(5)向30mL某浓度由A、B、C、D中三种元素形成的一元强碱溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。则曲线Y表明M中的溶质为

您最近一年使用:0次
2017-05-21更新
|
281次组卷
|
2卷引用:天津市和平区2017届高三第三次质量调查(三模)化学试题
解题方法
9 . 相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。

已知:
I.
II. (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
(1)X的分子中最多有______ 个原子共面。
(2)H的结构简式是_____________________________ 。
(3)反应③、④的类型是_______________ ;__________________ 。
(4)反应⑤的化学方程式是_____________________________ 。
(5)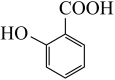 有多种同分异构体,试写出所有苯环上含有1个醛基和2个羟基,且核磁共振氢谱显示为4组峰的芳香族化合物的结构简式
有多种同分异构体,试写出所有苯环上含有1个醛基和2个羟基,且核磁共振氢谱显示为4组峰的芳香族化合物的结构简式____________________ 。
(6)请用合成反应流程图表示出由A和其他无机物(溶剂任选)合成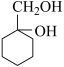 最合理的方案。在合成路线流程图的方框中填出相应的物质,并在括号注明反应条件
最合理的方案。在合成路线流程图的方框中填出相应的物质,并在括号注明反应条件______ 。

已知:
I.
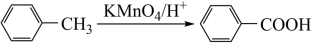
II.
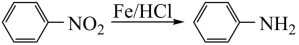 (苯胺,易被氧化)
(苯胺,易被氧化)请根据所学知识与本题所给信息回答下列问题:
(1)X的分子中最多有
(2)H的结构简式是
(3)反应③、④的类型是
(4)反应⑤的化学方程式是
(5)
 有多种同分异构体,试写出所有苯环上含有1个醛基和2个羟基,且核磁共振氢谱显示为4组峰的芳香族化合物的结构简式
有多种同分异构体,试写出所有苯环上含有1个醛基和2个羟基,且核磁共振氢谱显示为4组峰的芳香族化合物的结构简式(6)请用合成反应流程图表示出由A和其他无机物(溶剂任选)合成
 最合理的方案。在合成路线流程图的方框中填出相应的物质,并在括号注明反应条件
最合理的方案。在合成路线流程图的方框中填出相应的物质,并在括号注明反应条件
您最近一年使用:0次
10 . 肉桂酸甲酯常用于调制具有草莓、葡萄、樱桃等香味的食用香精。肉桂酸甲酯属于芳香族化合物,苯环上只有一个取代基,能发生加聚反应和水解反应。测得肉桂酸甲酯的摩尔质量为162g•mol﹣1,只含碳、氢、氧三种元素,且原子个数之比为5:5:1,其核磁共振氢谱有6个吸收峰,其面积之比为1:2:2:1:1:3请回答下列问题:
(1)肉桂酸甲酯所有可能的结构简式是_____ 。
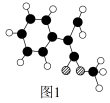
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如图1所示 (图中球与球之间连线表示单键或双键)。G的结构简式为_____ 。
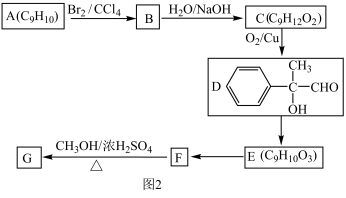
(3)以芳香烃A为原料合成G的路线如图2所示。
①在图A分子中共平面的原子最多有_____ 个。
②E→F的反应类型是_____ ,F→G的化学方程式为_____ 。
③写出同时符合下列条件的F的同分异构体的结构简式 (只写一种):_____ 。
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.在催化剂作用下,1mol该物质与足量氢气充分反应,消耗5mol H2;
ⅲ.不能发生水解反应。
④框图中D到F的转化,先发生催化氧化,后发生消去反应,能不能先发生消去反应,后发生催化氧化?_____ (填“能”或“不能”);理由是_____ 。
(1)肉桂酸甲酯所有可能的结构简式是
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如图1所示 (图中球与球之间连线表示单键或双键)。G的结构简式为


(3)以芳香烃A为原料合成G的路线如图2所示。
①在图A分子中共平面的原子最多有
②E→F的反应类型是
③写出同时符合下列条件的F的同分异构体的结构简式 (只写一种):
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.在催化剂作用下,1mol该物质与足量氢气充分反应,消耗5mol H2;
ⅲ.不能发生水解反应。
④框图中D到F的转化,先发生催化氧化,后发生消去反应,能不能先发生消去反应,后发生催化氧化?
您最近一年使用:0次



