解题方法
1 . 氧钒碱式碳酸铵晶体 [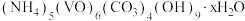 ]是制备多种光、电、磁材料的中间体,难溶于水,昜被氧化、可用
]是制备多种光、电、磁材料的中间体,难溶于水,昜被氧化、可用 与
与 反应制备。科研小组在实验室中对氧钒碱式碳酸铵晶体的制备和组成进行探究。回答下列问题:
反应制备。科研小组在实验室中对氧钒碱式碳酸铵晶体的制备和组成进行探究。回答下列问题:
Ⅰ.制备氧钒碱式碳酸铵晶体的装置和步骤如下。
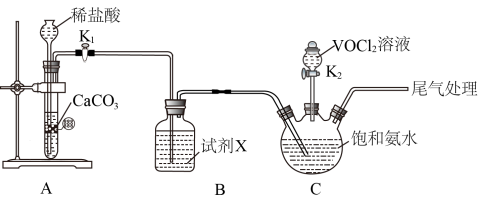
步骤一:按图安装好仪器,添加药品;
步骤二:打开 ,通入足量
,通入足量 ,充分反应后,关闭
,充分反应后,关闭 、打开
、打开 ,向三颈烧瓶中滴加适量
,向三颈烧瓶中滴加适量 溶液;
溶液;
步骤三:C中反应充分进行后,经一系列操作得到产品。
(1)图中盛放 溶液的仪器名称为
溶液的仪器名称为___________ ;试剂X的作用为___________ ; 中V元素的化合价为
中V元素的化合价为___________ 。
(2)步骤二中,通入足量 的作用为
的作用为___________ ;滴加 溶液时,参与反应的
溶液时,参与反应的 与
与 的物质的量之比为
的物质的量之比为___________ 。
Ⅱ.组成测定
(3)测定含钒量(杂质不参加反应):准确称量mg产品,用适量稀硫酸溶解后,依次加入稍过量的酸性 溶液、
溶液、 溶液、尿素,充分反应后,用
溶液、尿素,充分反应后,用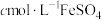 标准溶液滴定(
标准溶液滴定( ),达到滴定终点时消耗标准液的体积为VmL。则加入
),达到滴定终点时消耗标准液的体积为VmL。则加入 溶液的作用为
溶液的作用为___________ ;产品中钒元素的质量分数为___________ (用代数式表示)。
(4)测定结晶水含量:称取纯化后的产品4.26g,充分煅烧后,称得生成 的质量为2.184g,则x=
的质量为2.184g,则x=___________ 。
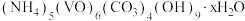 ]是制备多种光、电、磁材料的中间体,难溶于水,昜被氧化、可用
]是制备多种光、电、磁材料的中间体,难溶于水,昜被氧化、可用 与
与 反应制备。科研小组在实验室中对氧钒碱式碳酸铵晶体的制备和组成进行探究。回答下列问题:
反应制备。科研小组在实验室中对氧钒碱式碳酸铵晶体的制备和组成进行探究。回答下列问题:Ⅰ.制备氧钒碱式碳酸铵晶体的装置和步骤如下。

步骤一:按图安装好仪器,添加药品;
步骤二:打开
 ,通入足量
,通入足量 ,充分反应后,关闭
,充分反应后,关闭 、打开
、打开 ,向三颈烧瓶中滴加适量
,向三颈烧瓶中滴加适量 溶液;
溶液;步骤三:C中反应充分进行后,经一系列操作得到产品。
(1)图中盛放
 溶液的仪器名称为
溶液的仪器名称为 中V元素的化合价为
中V元素的化合价为(2)步骤二中,通入足量
 的作用为
的作用为 溶液时,参与反应的
溶液时,参与反应的 与
与 的物质的量之比为
的物质的量之比为Ⅱ.组成测定
(3)测定含钒量(杂质不参加反应):准确称量mg产品,用适量稀硫酸溶解后,依次加入稍过量的酸性
 溶液、
溶液、 溶液、尿素,充分反应后,用
溶液、尿素,充分反应后,用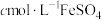 标准溶液滴定(
标准溶液滴定( ),达到滴定终点时消耗标准液的体积为VmL。则加入
),达到滴定终点时消耗标准液的体积为VmL。则加入 溶液的作用为
溶液的作用为(4)测定结晶水含量:称取纯化后的产品4.26g,充分煅烧后,称得生成
 的质量为2.184g,则x=
的质量为2.184g,则x=
您最近一年使用:0次
2023-05-20更新
|
257次组卷
|
3卷引用:河北省张家口市2023届高三高考三模化学试题
2 . 某实验小组采用沉淀滴定法测定碳酸氢钠样品中杂质Cl-的含量,实验步骤如下:
①用天平称取a g碳酸氢钠样品,用蒸馏水溶解,再用足量稀硝酸酸化,配成100 mL待测液;
②用移液管移取20.00 mL待测液于锥形瓶中,并滴加1~2滴指示剂(K2CrO4溶液为指示剂);
③用c mol·L-1 AgNO3标准溶液滴定Cl-,三次滴定结果如下:
已知:常温下Ksp(AgCl)=2×10-10,Ksp(Ag2CrO4)=1×10-12,Ag2CrO4为不溶于水的砖红色沉淀。回答下列问题:
(1)滴定时,AgNO3标准溶液应该装在______ (填“酸式”或“碱式”)滴定管中。
(2)到达滴定终点的标志是______ 。
(3)当Cl-恰好完全沉淀即溶液中残余c(Cl-)=1.0×10-5 mol·L-1,则此时溶液中的c(CrO )为
)为______ mol·L-1。
(4)根据上述数据计算碳酸氢钠样品中杂质Cl-的质量分数为______ 。
(5)已知2AgCl(s)+CrO (aq)⇌2Cl-(aq)+Ag2CrO4(s),则常温下该反应的平衡常数为
(aq)⇌2Cl-(aq)+Ag2CrO4(s),则常温下该反应的平衡常数为______ 。
(6)误差分析(填“偏高”、“偏低”、“无影响”):
①盛放AgNO3标准溶液的滴定管水洗后未用标准液润洗,则Cl-的含量______ ;
②锥形瓶水洗后未干燥,则Cl-的含量______ ;
③滴定前仰视读数,滴定后俯视读数,则Cl-的含量______ ;
①用天平称取a g碳酸氢钠样品,用蒸馏水溶解,再用足量稀硝酸酸化,配成100 mL待测液;
②用移液管移取20.00 mL待测液于锥形瓶中,并滴加1~2滴指示剂(K2CrO4溶液为指示剂);
③用c mol·L-1 AgNO3标准溶液滴定Cl-,三次滴定结果如下:
| V(待测液)/mL | 20.00 | 20.00 | 20.00 |
| V(AgNO3)/mL | 19.98 | 20.00 | 20.02 |
(1)滴定时,AgNO3标准溶液应该装在
(2)到达滴定终点的标志是
(3)当Cl-恰好完全沉淀即溶液中残余c(Cl-)=1.0×10-5 mol·L-1,则此时溶液中的c(CrO
 )为
)为(4)根据上述数据计算碳酸氢钠样品中杂质Cl-的质量分数为
(5)已知2AgCl(s)+CrO
 (aq)⇌2Cl-(aq)+Ag2CrO4(s),则常温下该反应的平衡常数为
(aq)⇌2Cl-(aq)+Ag2CrO4(s),则常温下该反应的平衡常数为(6)误差分析(填“偏高”、“偏低”、“无影响”):
①盛放AgNO3标准溶液的滴定管水洗后未用标准液润洗,则Cl-的含量
②锥形瓶水洗后未干燥,则Cl-的含量
③滴定前仰视读数,滴定后俯视读数,则Cl-的含量
您最近一年使用:0次
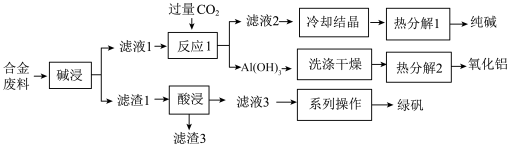
3 . 为探索工业废料的再利用,某化学兴趣小组用含有铝、铁和铜等合金废料制取纯碱、氧化铝和绿矾(FeSO4·7H2O),其工艺流程如下图。
(1)滤液1中含有的阴离子有_______ 。
(2)“反应1”中得到Al(OH)3的离子方程式是_______ 。
(3)滤液3长期露置于空气中可能会引入杂质_______ (填离子符号),验证是否存在该杂质离子的灵敏试剂是_______ (填试剂名称)。
(4)若有ag合金废料,热分解2得到的Al2O3的质量为bg,则合金废料中Al的质量分数是_______ ;Al与碱液的反应中氧化剂是_______ ,并写出该氧化剂的电子式是_______ 。
(1)滤液1中含有的阴离子有
(2)“反应1”中得到Al(OH)3的离子方程式是
(3)滤液3长期露置于空气中可能会引入杂质
(4)若有ag合金废料,热分解2得到的Al2O3的质量为bg,则合金废料中Al的质量分数是
您最近一年使用:0次
4 .  是一种重要的运输氢的材料,通常情况下,
是一种重要的运输氢的材料,通常情况下,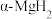 为金红石型四方晶体结构,其晶胞结构如图所示(晶胞参数:
为金红石型四方晶体结构,其晶胞结构如图所示(晶胞参数: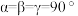 )。下列说法错误的是
)。下列说法错误的是
 是一种重要的运输氢的材料,通常情况下,
是一种重要的运输氢的材料,通常情况下,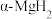 为金红石型四方晶体结构,其晶胞结构如图所示(晶胞参数:
为金红石型四方晶体结构,其晶胞结构如图所示(晶胞参数: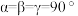 )。下列说法错误的是
)。下列说法错误的是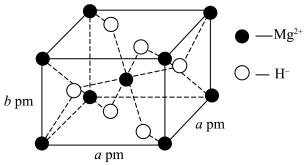
A. 的配位数为3 的配位数为3 |
B. 位于 位于 围成的八面体空隙中 围成的八面体空隙中 |
| C.该晶体储氢质量分数约为66.7% |
D.该晶体密度为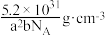 |
您最近一年使用:0次
解题方法
5 . 1869年,俄国化学家门捷列夫制作了第一张元素周期表。下表是元素周期表的一部分,表中所列的字母分别代表某化学元素。回答下列问题:___________ (填化学式),参与反应的e、f、g的质量比是___________ 。
(2)g和j形成的化合物溶液中滴加氨水至过量,看到的现象是___________ 。
(3)a与b形成的化合物M中a的质量分数为25%,写出该化合物M的结构式___________ 。
(4)h、i、j的简单氢化物的稳定性最弱的是___________ (填化学式)。
(5)火箭发动机曾经利用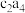 作燃料,
作燃料,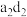 作助燃剂,产物环保无污染,写出二者反应的化学方程式
作助燃剂,产物环保无污染,写出二者反应的化学方程式___________ 。
(6)设计实验证明非金属性j>k:___________ 。
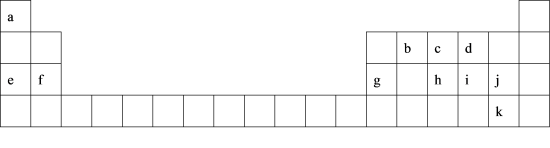
(2)g和j形成的化合物溶液中滴加氨水至过量,看到的现象是
(3)a与b形成的化合物M中a的质量分数为25%,写出该化合物M的结构式
(4)h、i、j的简单氢化物的稳定性最弱的是
(5)火箭发动机曾经利用
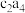 作燃料,
作燃料,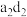 作助燃剂,产物环保无污染,写出二者反应的化学方程式
作助燃剂,产物环保无污染,写出二者反应的化学方程式(6)设计实验证明非金属性j>k:
您最近一年使用:0次
2024-08-26更新
|
36次组卷
|
2卷引用:河北省张家口市2023-2024学年高一上学期1月期末化学试题
6 . 下列关于有机物的说法正确的是
| A.质量分数为75%的乙醇溶液杀菌消毒效果最好 |
| B.淀粉水解液中加入新制的氢氧化铜,加热,未出现砖红色沉淀,说明淀粉未发生水解 |
| C.油脂在酸性条件下的水解反应也称为皂化反应 |
| D.蛋白质最终水解生成的氨基酸具有两性 |
您最近一年使用:0次
7 . 钛白粉(主要成分 )是目前世界上被认为性能最好的白色颜料,其人均消费量也成为一个国家经济发展的重要指标。利用钛铁矿(主要成分
)是目前世界上被认为性能最好的白色颜料,其人均消费量也成为一个国家经济发展的重要指标。利用钛铁矿(主要成分 ,还有
,还有 、
、 、
、 等杂质)为原料,通过硫酸法和氯化法两种生产工艺制备钛白粉的流程如图所示,请回答下列问题:
等杂质)为原料,通过硫酸法和氯化法两种生产工艺制备钛白粉的流程如图所示,请回答下列问题:

已知:“酸溶”后钛主要以 形式存在,
形式存在, 在80°C左右水解生成
在80°C左右水解生成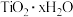
(1) 中
中 的化合价为
的化合价为___________ 。
(2)“酸溶”时主要成分发生反应的离子方程式为___________ ;废渣的主要成分为___________ 。
(3)“还原”时试剂X应选择合适的试剂是___________ ;常温下溶解度:
__________ 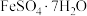 (填“大于”或“小于”)。
(填“大于”或“小于”)。
(4)“氧化”时发生的主要反应化学方程式为___________ 。
(5)以上两种工艺流程中,循环使用的物质有___________ ;请说出方法一优于方法二的理由___________ (写出一条即可)。
(6)若钛铁矿中 的质量分数约为19%,实验室用100g此种铁矿石利用方法一得到精
的质量分数约为19%,实验室用100g此种铁矿石利用方法一得到精 mg,则Ti元素的回收率为
mg,则Ti元素的回收率为___________ %(用含m的计算式表示)。
 )是目前世界上被认为性能最好的白色颜料,其人均消费量也成为一个国家经济发展的重要指标。利用钛铁矿(主要成分
)是目前世界上被认为性能最好的白色颜料,其人均消费量也成为一个国家经济发展的重要指标。利用钛铁矿(主要成分 ,还有
,还有 、
、 、
、 等杂质)为原料,通过硫酸法和氯化法两种生产工艺制备钛白粉的流程如图所示,请回答下列问题:
等杂质)为原料,通过硫酸法和氯化法两种生产工艺制备钛白粉的流程如图所示,请回答下列问题:
已知:“酸溶”后钛主要以
 形式存在,
形式存在, 在80°C左右水解生成
在80°C左右水解生成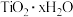
(1)
 中
中 的化合价为
的化合价为(2)“酸溶”时主要成分发生反应的离子方程式为
(3)“还原”时试剂X应选择合适的试剂是

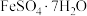 (填“大于”或“小于”)。
(填“大于”或“小于”)。(4)“氧化”时发生的主要反应化学方程式为
(5)以上两种工艺流程中,循环使用的物质有
(6)若钛铁矿中
 的质量分数约为19%,实验室用100g此种铁矿石利用方法一得到精
的质量分数约为19%,实验室用100g此种铁矿石利用方法一得到精 mg,则Ti元素的回收率为
mg,则Ti元素的回收率为
您最近一年使用:0次
8 . 下列有关金属及其化合物的说法正确的是
| A.FeSO4溶液若变质,可加入Cu复原 |
| B.FeO不稳定,在空气中受热迅速转化为Fe2O3 |
| C.金属元素在自然界中都以化合态形式存在 |
| D.将mg组成不同的铝钠合金分别投入足量盐酸中,铝的质量分数越大,放出H2越多 |
您最近一年使用:0次
名校
解题方法
9 . 氯化亚铜广泛用于有机合成、杀菌和化学分析,它是一种白色固体,难溶于水和乙醇,可溶于氯离子浓度较大的体系,在潮湿空气中易水解和氧化。学习小组在实验室中制备CuCl并测定产品纯度,进行如下实验探究。回答下列问题:
制备CuCl的反应、装置示意图和实验步骤如下。
反应:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO
溶液中存在:CuCl+2Cl- [CuCl3]2-(茶褐色)
[CuCl3]2-(茶褐色)
装置:

实验步骤:
Ⅰ.安装好装置,检验装置的气密性,添加药品;
Ⅱ.打开K,向装置中通入一段时间N2;
Ⅲ.关闭K,向三颈烧瓶中滴入70%硫酸,向B中混合溶液内通入SO2;
Ⅳ.B中充分反应后,向圆底烧瓶中加入适量水稀释,而后过滤、洗涤、干燥,制得产品
(1)步骤Ⅰ中检验装置气密性的方法为___________ 。
(2)仪器a的名称为___________ ;步骤Ⅲ中,为使70%硫酸顺利滴下,仪器a上口玻璃塞___________ (填“需要”或“不需要”)事先打开;本实验选用70%硫酸制备SO2的原因为___________ 。
(3)步骤Ⅳ中,加水稀释的目的为___________ ;洗涤包括酸洗、水洗、醇洗,其中醇洗的目的为___________ 。
(4)测定产品纯度:准确称取m g产品,加入足量FeCl3溶液;充分反应后滴加指示剂,用c mol·L-1 Ce(SO4)2标准溶液滴定生成的Fe2+(还原产物为Ce3+),达到终点时消耗V mL标准液。
①产品中加入FeCl3溶液时,发生反应的离子方程式为___________ 。
②产品中CuCl的质量分数为___________ 。
制备CuCl的反应、装置示意图和实验步骤如下。
反应:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO

溶液中存在:CuCl+2Cl-
 [CuCl3]2-(茶褐色)
[CuCl3]2-(茶褐色)装置:

实验步骤:
Ⅰ.安装好装置,检验装置的气密性,添加药品;
Ⅱ.打开K,向装置中通入一段时间N2;
Ⅲ.关闭K,向三颈烧瓶中滴入70%硫酸,向B中混合溶液内通入SO2;
Ⅳ.B中充分反应后,向圆底烧瓶中加入适量水稀释,而后过滤、洗涤、干燥,制得产品
(1)步骤Ⅰ中检验装置气密性的方法为
(2)仪器a的名称为
(3)步骤Ⅳ中,加水稀释的目的为
(4)测定产品纯度:准确称取m g产品,加入足量FeCl3溶液;充分反应后滴加指示剂,用c mol·L-1 Ce(SO4)2标准溶液滴定生成的Fe2+(还原产物为Ce3+),达到终点时消耗V mL标准液。
①产品中加入FeCl3溶液时,发生反应的离子方程式为
②产品中CuCl的质量分数为
您最近一年使用:0次
2023-07-28更新
|
115次组卷
|
3卷引用:河北省张家口市2022-2023学年高三上学期期末考试化学试题
名校
10 . 三氯化铬(CrCl3)可用作媒染剂和催化剂,易水解,650℃以上升华。某学习小组在实验室中用Cr2O3和CCl4制备无水CrCl3并测定产品纯度,进行如图实验探究。回答下列问题:
(1)制备无水CrCl3
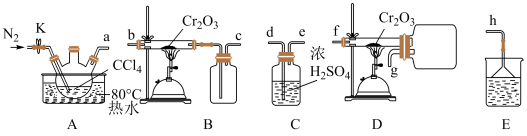
①选择合适的装置,按气流方向,合理的连接顺序为______ (用小写字母填空)。
②实验开始时,点燃酒精喷灯适合在水浴加热之______ (填“前”或“后”)。
③该实验开始前,先通入一段时间N2的作用为______ 。
④已知制备CrCl3时同时生成的气体COCl2易水解,则制备CrCl3反应的化学方程式为______ ,尾气处理时适合选用的试剂为______ (填试剂名称)。
(2)测定产品纯度(杂质不参加反应)
已知:CrO (黄色,碱性)
(黄色,碱性) Cr2O
Cr2O (橙色,酸性)
(橙色,酸性)
准确称取mg产品,温水溶解后稀释至250mL,量取25.00mL溶液加入锥形瓶中,向其中加入足量Na2O2充分反应;将反应后溶液加硫酸酸化至橙色,煮沸、冷却后加入足量KI溶液;滴加淀粉作指示剂,用cmol•L-1Na2S2O3标准溶液滴定(2S2O +I2=S4O
+I2=S4O +2I-),达到滴定终点时消耗标准液的体积为VmL。
+2I-),达到滴定终点时消耗标准液的体积为VmL。
①准确量取25.00mL溶液所用仪器名称为______ 。
②硫酸酸化的主要作用为______ 。
③反应后溶液煮沸的目的为______ 。
④产品中CrCl3的质量分数为______ 。
(1)制备无水CrCl3

①选择合适的装置,按气流方向,合理的连接顺序为
②实验开始时,点燃酒精喷灯适合在水浴加热之
③该实验开始前,先通入一段时间N2的作用为
④已知制备CrCl3时同时生成的气体COCl2易水解,则制备CrCl3反应的化学方程式为
(2)测定产品纯度(杂质不参加反应)
已知:CrO
 (黄色,碱性)
(黄色,碱性) Cr2O
Cr2O (橙色,酸性)
(橙色,酸性)准确称取mg产品,温水溶解后稀释至250mL,量取25.00mL溶液加入锥形瓶中,向其中加入足量Na2O2充分反应;将反应后溶液加硫酸酸化至橙色,煮沸、冷却后加入足量KI溶液;滴加淀粉作指示剂,用cmol•L-1Na2S2O3标准溶液滴定(2S2O
 +I2=S4O
+I2=S4O +2I-),达到滴定终点时消耗标准液的体积为VmL。
+2I-),达到滴定终点时消耗标准液的体积为VmL。①准确量取25.00mL溶液所用仪器名称为
②硫酸酸化的主要作用为
③反应后溶液煮沸的目的为
④产品中CrCl3的质量分数为
您最近一年使用:0次
2023-04-25更新
|
459次组卷
|
2卷引用:河北省张家口市2022-2023学年高三一模化学试题



