1 . 下列实验中的颜色变化与氧化还原反应有关的是
A. 通入品红溶液中,溶液由红色变为无色 通入品红溶液中,溶液由红色变为无色 |
| B.KI溶液滴入AgCl浊液中,沉淀由白色变为黄色 |
C.稀硫酸滴入 溶液中,溶液由黄色变为橙色 溶液中,溶液由黄色变为橙色 |
| D.苯酚长时间放置在空气中,晶体由无色变为粉红色 |
您最近一年使用:0次
2 . 甲醇是最为常见、应用场景最为广泛的基础化学品之一,甲醇与乙烯、丙烯和氨是用于生产所有其他化学品的四种关键基础化学品之一、回答下列问题:
(1)已知:①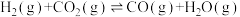
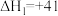 kJ⋅mol
kJ⋅mol
②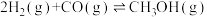
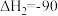 kJ⋅mol
kJ⋅mol
则反应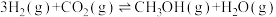 的
的
_______ kJ⋅mol 。
。
(2)常温常压下利用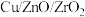 催化剂实现二氧化碳加氢制甲醇的反应历程和能量变化如图所示(其中吸附在催化剂表面上的粒子用*标注)。
催化剂实现二氧化碳加氢制甲醇的反应历程和能量变化如图所示(其中吸附在催化剂表面上的粒子用*标注)。_______ 个基元反应,决速步的反应方程式为_______ 。
(3)以起始投料比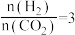 时发生反应
时发生反应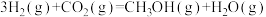 ,在不同条件下达到平衡。设体系中
,在不同条件下达到平衡。设体系中 的平衡转化率为
的平衡转化率为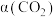 ,在恒温
,在恒温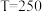 ℃时
℃时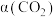 随压强p的变化以及在恒压
随压强p的变化以及在恒压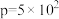 kPa时
kPa时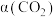 随温度T的变化如图所示。
随温度T的变化如图所示。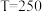 ℃的曲线是
℃的曲线是_______ (填“a”或“b”),理由是_______ 。
②在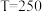 ℃、
℃、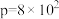 kPa条件下,反应经过、10 min达到平衡。0~10 min内,
kPa条件下,反应经过、10 min达到平衡。0~10 min内, 的平均反应速率为
的平均反应速率为_______  。(保留1位小数),M点时该反应的压强平衡常数
。(保留1位小数),M点时该反应的压强平衡常数
_______ 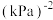 (列出计算表达式)。
(列出计算表达式)。
(4) 和
和 以物质的量为3∶1发生主反应
以物质的量为3∶1发生主反应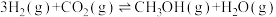 ,反应过程中发生的副反应为
,反应过程中发生的副反应为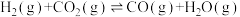 ,其他条件相同时,在铜基催化剂(
,其他条件相同时,在铜基催化剂(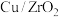 )作用下,不同温度对
)作用下,不同温度对 的转化率和
的转化率和 的选择性的影响如图所示[
的选择性的影响如图所示[ 的选择性
的选择性 ]。
]。_______ 。
②温度高于260℃时, 的平衡转化率变化的原因是
的平衡转化率变化的原因是_______ 。
③由图2可知,温度相同时 的选择性的实验值略高于平衡值,原因是
的选择性的实验值略高于平衡值,原因是_______ (从化学反应速率的角度解释)。
(1)已知:①
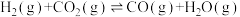
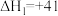 kJ⋅mol
kJ⋅mol
②
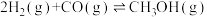
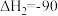 kJ⋅mol
kJ⋅mol
则反应
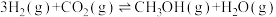 的
的
 。
。(2)常温常压下利用
 催化剂实现二氧化碳加氢制甲醇的反应历程和能量变化如图所示(其中吸附在催化剂表面上的粒子用*标注)。
催化剂实现二氧化碳加氢制甲醇的反应历程和能量变化如图所示(其中吸附在催化剂表面上的粒子用*标注)。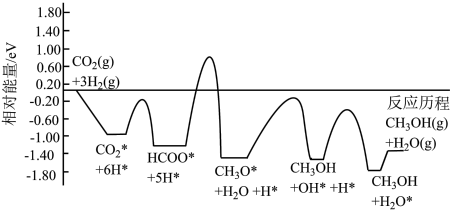
(3)以起始投料比
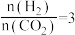 时发生反应
时发生反应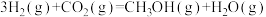 ,在不同条件下达到平衡。设体系中
,在不同条件下达到平衡。设体系中 的平衡转化率为
的平衡转化率为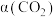 ,在恒温
,在恒温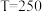 ℃时
℃时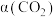 随压强p的变化以及在恒压
随压强p的变化以及在恒压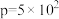 kPa时
kPa时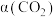 随温度T的变化如图所示。
随温度T的变化如图所示。
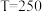 ℃的曲线是
℃的曲线是②在
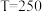 ℃、
℃、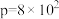 kPa条件下,反应经过、10 min达到平衡。0~10 min内,
kPa条件下,反应经过、10 min达到平衡。0~10 min内, 的平均反应速率为
的平均反应速率为 。(保留1位小数),M点时该反应的压强平衡常数
。(保留1位小数),M点时该反应的压强平衡常数
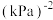 (列出计算表达式)。
(列出计算表达式)。(4)
 和
和 以物质的量为3∶1发生主反应
以物质的量为3∶1发生主反应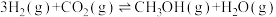 ,反应过程中发生的副反应为
,反应过程中发生的副反应为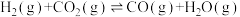 ,其他条件相同时,在铜基催化剂(
,其他条件相同时,在铜基催化剂(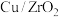 )作用下,不同温度对
)作用下,不同温度对 的转化率和
的转化率和 的选择性的影响如图所示[
的选择性的影响如图所示[ 的选择性
的选择性 ]。
]。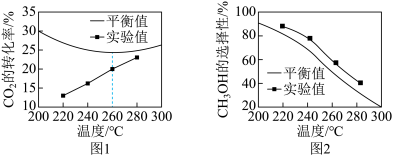
②温度高于260℃时,
 的平衡转化率变化的原因是
的平衡转化率变化的原因是③由图2可知,温度相同时
 的选择性的实验值略高于平衡值,原因是
的选择性的实验值略高于平衡值,原因是
您最近一年使用:0次
2024-05-31更新
|
115次组卷
|
2卷引用:2024届河北省承德市部分示范高中高三下学期三模化学试题
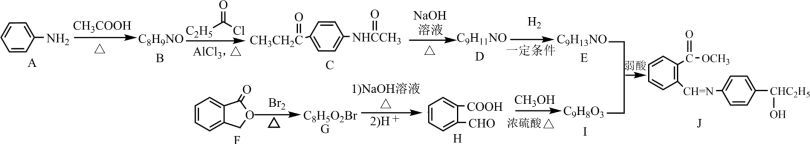
3 . 有机物J是治疗脑血栓的药物。J的一种合成路线如下: R′CH=NR″。
R′CH=NR″。
③同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮。
回答下列问题:
(1)A的化学名称是_______ ,D中官能团的名称是_______ 。
(2)由H生成I的反应类型为_______ J分子中有_______ 个手性碳原子。
(3)G的结构简式为_______ 。
(4)I+E→J的化学方程式为_______ 。
(5)在Ⅰ的同分异构体中,同时满足下列条件的共有_______ 种(不考虑立体异构)。
①含有苯环且苯环上有2个取代基。
②能发生银镜反应,且1 mol该化合物与足量的银氨溶液反应生成4molAg。
其中,核磁共振氢谱显示为6组峰,且峰面积比为2∶2∶1∶1∶1∶1的同分异构体的结构简式为_______ 。
(6)设计由甲苯和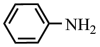 制备
制备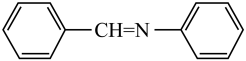 的合成路线:
的合成路线:______ (无机试剂任选)。
已知:①
 R′CH=NR″。
R′CH=NR″。③同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮。
回答下列问题:
(1)A的化学名称是
(2)由H生成I的反应类型为
(3)G的结构简式为
(4)I+E→J的化学方程式为
(5)在Ⅰ的同分异构体中,同时满足下列条件的共有
①含有苯环且苯环上有2个取代基。
②能发生银镜反应,且1 mol该化合物与足量的银氨溶液反应生成4molAg。
其中,核磁共振氢谱显示为6组峰,且峰面积比为2∶2∶1∶1∶1∶1的同分异构体的结构简式为
(6)设计由甲苯和
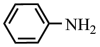 制备
制备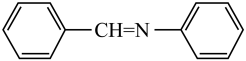 的合成路线:
的合成路线:
您最近一年使用:0次
2024-05-30更新
|
207次组卷
|
2卷引用:2024届河北省承德市部分示范高中高三下学期三模化学试题
解题方法
4 . 下列化学用语表示错误的是
A.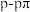 键的电子云形状为 键的电子云形状为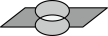 |
B.基态镓原子的电子排布式为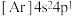 |
C. 的VSEPR模型为 的VSEPR模型为 |
D.过氧化钠的电子式为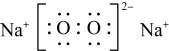 |
您最近一年使用:0次
5 . 雾霾主要由 、
、 和可吸入颗粒物这三项组成,它们与雾气结合在一起,让天空变得阴沉灰暗。利用乙醇燃料电池(电解质溶液为稀硫酸,a、b为该燃料电池的两极)电解,可将雾霾中的
和可吸入颗粒物这三项组成,它们与雾气结合在一起,让天空变得阴沉灰暗。利用乙醇燃料电池(电解质溶液为稀硫酸,a、b为该燃料电池的两极)电解,可将雾霾中的 、NO转化为
、NO转化为 ,电解原理如图所示。下列说法错误的是
,电解原理如图所示。下列说法错误的是
 、
、 和可吸入颗粒物这三项组成,它们与雾气结合在一起,让天空变得阴沉灰暗。利用乙醇燃料电池(电解质溶液为稀硫酸,a、b为该燃料电池的两极)电解,可将雾霾中的
和可吸入颗粒物这三项组成,它们与雾气结合在一起,让天空变得阴沉灰暗。利用乙醇燃料电池(电解质溶液为稀硫酸,a、b为该燃料电池的两极)电解,可将雾霾中的 、NO转化为
、NO转化为 ,电解原理如图所示。下列说法错误的是
,电解原理如图所示。下列说法错误的是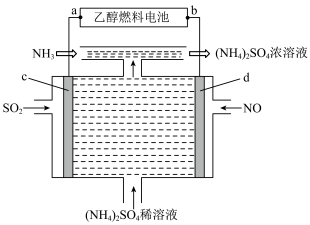
A.b电极的电极反应式为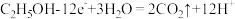 |
B.不考虑气体的溶解性和损耗,电解过程中,消耗 与NO的物质的量之比为5∶2 与NO的物质的量之比为5∶2 |
C.电解的总反应方程式为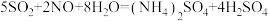 |
D.若电解过程中的能量损耗不计,当消耗1 mol乙醇时,为实现产量最大化,通入的 的物质的量为9.2 mol 的物质的量为9.2 mol |
您最近一年使用:0次
2024-05-29更新
|
85次组卷
|
2卷引用:2024届河北省承德市部分示范高中高三下学期三模化学试题
解题方法
6 . 一种抗癌新药的分子结构如图所示。下列说法正确的是

A.C、N、O元素的第一电离能由小到大的顺序为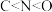 |
| B.该化合物的一氯代物有10种 |
C.分子中碳原子采取 、 、 杂化,氮原子和硒原子均采取 杂化,氮原子和硒原子均采取 杂化 杂化 |
D. 的键角小于 的键角小于 的键角 的键角 |
您最近一年使用:0次
2024-05-28更新
|
145次组卷
|
2卷引用:2024届河北省承德市部分示范高中高三下学期三模化学试题
解题方法
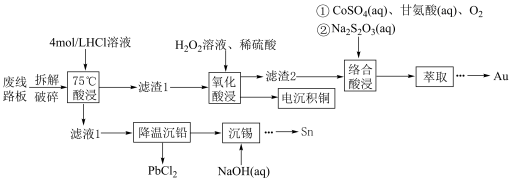
7 . 废旧手机的废线路板中富含Cu、Sn、Ni、Pb等金属和少量Ag、Au,具有较高的回收价值,其中部分金属的回收工艺流程如下: 微溶于水,可与
微溶于水,可与 结合生成
结合生成 配离子:
配离子: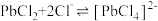 。
。
②25℃时,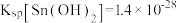 ,
,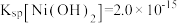 。
。
回答下列问题:
(1)“拆解破碎”的目的是_______ 。
(2)“75℃酸浸”中,金属Sn与盐酸反应的离子方程式为_______ ,选用浓度较大的4 mol·L 盐酸可提高铅元素的浸出率,理由是
盐酸可提高铅元素的浸出率,理由是_______ (从平衡移动角度分析)。
(3)“滤渣1”的主要成分是_______ (填化学式),“氧化酸浸”中,生成Cu²⁺反应的离子方程式为_______ 。
(4) 的排放标准为
的排放标准为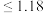 mg·L
mg·L 。“沉锡”残余液排放前应调节溶液的pH范围为
。“沉锡”残余液排放前应调节溶液的pH范围为_____ 。
(5)“络合酸浸”中,Co2+作催化剂,催化Au浸出,化学方程式为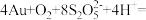
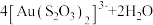 ,其反应过程按如下步骤进行:
,其反应过程按如下步骤进行:
① 先与甘氨酸根(简写为
先与甘氨酸根(简写为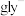 )形成配合物
)形成配合物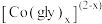 (
(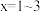 )。
)。
②在氧气作用下,Co(Ⅱ)被氧化成Co(Ⅲ):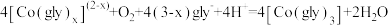 。
。
③Au溶解。
④加入硫代硫酸钠溶液,发生反应: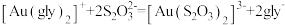 。
。
步骤③Au溶解的离子方程式为_______ 。
(6)锡有白锡和灰锡两种单质。白锡晶体中锡原子的堆积方式如图所示,该六棱柱底边边长为a pm,高为c pm,阿伏加德罗常数的值为 ,白锡晶体的密度为
,白锡晶体的密度为_______  (列出计算式)。
(列出计算式)。
 微溶于水,可与
微溶于水,可与 结合生成
结合生成 配离子:
配离子: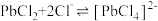 。
。②25℃时,
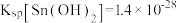 ,
,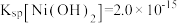 。
。回答下列问题:
(1)“拆解破碎”的目的是
(2)“75℃酸浸”中,金属Sn与盐酸反应的离子方程式为
 盐酸可提高铅元素的浸出率,理由是
盐酸可提高铅元素的浸出率,理由是(3)“滤渣1”的主要成分是
(4)
 的排放标准为
的排放标准为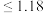 mg·L
mg·L 。“沉锡”残余液排放前应调节溶液的pH范围为
。“沉锡”残余液排放前应调节溶液的pH范围为(5)“络合酸浸”中,Co2+作催化剂,催化Au浸出,化学方程式为
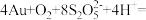
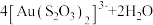 ,其反应过程按如下步骤进行:
,其反应过程按如下步骤进行:①
 先与甘氨酸根(简写为
先与甘氨酸根(简写为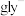 )形成配合物
)形成配合物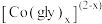 (
(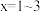 )。
)。②在氧气作用下,Co(Ⅱ)被氧化成Co(Ⅲ):
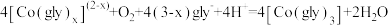 。
。③Au溶解。
④加入硫代硫酸钠溶液,发生反应:
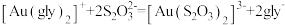 。
。步骤③Au溶解的离子方程式为
(6)锡有白锡和灰锡两种单质。白锡晶体中锡原子的堆积方式如图所示,该六棱柱底边边长为a pm,高为c pm,阿伏加德罗常数的值为
 ,白锡晶体的密度为
,白锡晶体的密度为 (列出计算式)。
(列出计算式)。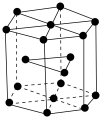
您最近一年使用:0次
2024-05-28更新
|
83次组卷
|
2卷引用:2024届河北省承德市部分示范高中高三下学期三模化学试题
解题方法
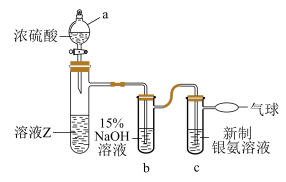
8 . 甲醛在石油化工、医药、轻纺、生物化工以及能源、交通运输等行业均有广泛用途。实验小组设计实验制备甲醛,并进行相关性质的探究。回答下列问题:
Ⅰ.制备甲醛
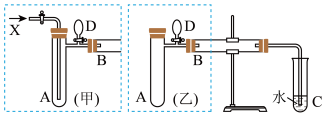
实验室利用甲醇、空气(或氧气)和铜(或利用甲醇和氧化铜)制备甲醛。如图是两个学生设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如(甲)和(乙)所示。
(1)从原子轨道重叠方式分类,甲醛分子中的H-C键是_______ σ键。
(2)若按(甲)装置进行实验,则通入A管的X是_______ (填名称)。若按(乙)装置进行实验,B管中发生反应的化学方程式为_______ 。
Ⅱ.探究甲醛与新制 反应的产物
反应的产物
取 溶液、过量的NaOH溶液和甲醛溶液于烧瓶中,控制温度为40~50℃回流1h,收集到大量气体Y,烧瓶中有红色沉淀生成,同时得到溶液Z。
溶液、过量的NaOH溶液和甲醛溶液于烧瓶中,控制温度为40~50℃回流1h,收集到大量气体Y,烧瓶中有红色沉淀生成,同时得到溶液Z。
(3)实验小组猜想气体产物Y可能是CO、 、
、 中的一种。为确定气体成分,利用下列装置验证猜想(已知:CO可将银氨溶液还原成黑色粉末银单质)。
中的一种。为确定气体成分,利用下列装置验证猜想(已知:CO可将银氨溶液还原成黑色粉末银单质)。__________ (按气流方向填写装置标号,有些装置可重复使用)。
②实验证明气体产物Y为 ,没有
,没有 和CO,则实验观察到装置A、C、D、E中的现象为
和CO,则实验观察到装置A、C、D、E中的现象为_______ 。
(4)在探究溶液Z中甲醛的氧化产物时,发现未生成 。为了进一步确定甲醛是否被氧化为HCOONa,进行如图实验(夹持装置和加热装置已省略,已知:
。为了进一步确定甲醛是否被氧化为HCOONa,进行如图实验(夹持装置和加热装置已省略,已知: )。
)。_______ (填标号)。
A.氧化性 B.强酸性 C.还原性 D.脱水性
②c中银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为_______ 。
(5)通过定量测定发现,甲醛与新制 反应中生成的红色沉淀主要为Cu,且Cu的物质的量和气体Y的相等,则该条件下甲醛与新制
反应中生成的红色沉淀主要为Cu,且Cu的物质的量和气体Y的相等,则该条件下甲醛与新制 、NaOH溶液反应生成Cu和气体Y的化学方程式为
、NaOH溶液反应生成Cu和气体Y的化学方程式为_______ 。
(6)甲醛被称为室内污染“第一杀手”。室内甲醛的含量可以通过传感器来监测。一种燃料电池型甲醛气体传感器的工作原理如图所示。国家标准是室内甲醛不能超过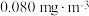 ,传感器在
,传感器在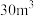 室内空间测定,电路中有
室内空间测定,电路中有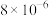 mol电子通过,该室内甲醛含量为
mol电子通过,该室内甲醛含量为_______ 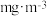 。
。
Ⅰ.制备甲醛
实验室利用甲醇、空气(或氧气)和铜(或利用甲醇和氧化铜)制备甲醛。如图是两个学生设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如(甲)和(乙)所示。
| 物质 | 沸点/℃ | 水溶性 |
| 甲醇 | 65 | 混溶 |
| 甲醛 | -21 | 混溶 |
(1)从原子轨道重叠方式分类,甲醛分子中的H-C键是
(2)若按(甲)装置进行实验,则通入A管的X是
Ⅱ.探究甲醛与新制
 反应的产物
反应的产物取
 溶液、过量的NaOH溶液和甲醛溶液于烧瓶中,控制温度为40~50℃回流1h,收集到大量气体Y,烧瓶中有红色沉淀生成,同时得到溶液Z。
溶液、过量的NaOH溶液和甲醛溶液于烧瓶中,控制温度为40~50℃回流1h,收集到大量气体Y,烧瓶中有红色沉淀生成,同时得到溶液Z。(3)实验小组猜想气体产物Y可能是CO、
 、
、 中的一种。为确定气体成分,利用下列装置验证猜想(已知:CO可将银氨溶液还原成黑色粉末银单质)。
中的一种。为确定气体成分,利用下列装置验证猜想(已知:CO可将银氨溶液还原成黑色粉末银单质)。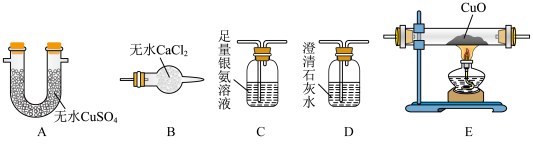
②实验证明气体产物Y为
 ,没有
,没有 和CO,则实验观察到装置A、C、D、E中的现象为
和CO,则实验观察到装置A、C、D、E中的现象为(4)在探究溶液Z中甲醛的氧化产物时,发现未生成
 。为了进一步确定甲醛是否被氧化为HCOONa,进行如图实验(夹持装置和加热装置已省略,已知:
。为了进一步确定甲醛是否被氧化为HCOONa,进行如图实验(夹持装置和加热装置已省略,已知: )。
)。
A.氧化性 B.强酸性 C.还原性 D.脱水性
②c中银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为
(5)通过定量测定发现,甲醛与新制
 反应中生成的红色沉淀主要为Cu,且Cu的物质的量和气体Y的相等,则该条件下甲醛与新制
反应中生成的红色沉淀主要为Cu,且Cu的物质的量和气体Y的相等,则该条件下甲醛与新制 、NaOH溶液反应生成Cu和气体Y的化学方程式为
、NaOH溶液反应生成Cu和气体Y的化学方程式为(6)甲醛被称为室内污染“第一杀手”。室内甲醛的含量可以通过传感器来监测。一种燃料电池型甲醛气体传感器的工作原理如图所示。国家标准是室内甲醛不能超过
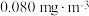 ,传感器在
,传感器在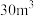 室内空间测定,电路中有
室内空间测定,电路中有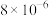 mol电子通过,该室内甲醛含量为
mol电子通过,该室内甲醛含量为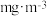 。
。
您最近一年使用:0次
2024-05-28更新
|
137次组卷
|
2卷引用:2024届河北省承德市部分示范高中高三下学期三模化学试题
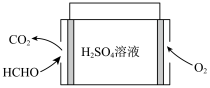
9 .  是一种二元弱酸。常温下,向20 mL 0.1 mol⋅L
是一种二元弱酸。常温下,向20 mL 0.1 mol⋅L
 溶液中滴加同浓度的NaOH溶液,溶液中
溶液中滴加同浓度的NaOH溶液,溶液中 [Y表示
[Y表示 或
或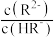 ]与溶液pH的变化关系如图所示。下列叙述正确的是
]与溶液pH的变化关系如图所示。下列叙述正确的是
 是一种二元弱酸。常温下,向20 mL 0.1 mol⋅L
是一种二元弱酸。常温下,向20 mL 0.1 mol⋅L
 溶液中滴加同浓度的NaOH溶液,溶液中
溶液中滴加同浓度的NaOH溶液,溶液中 [Y表示
[Y表示 或
或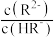 ]与溶液pH的变化关系如图所示。下列叙述正确的是
]与溶液pH的变化关系如图所示。下列叙述正确的是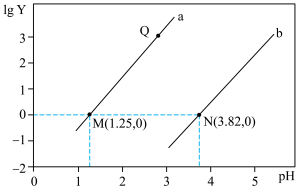
A.直线a表示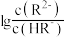 与pH的变化关系 与pH的变化关系 |
B.Q点溶液中,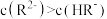 |
C.常温下,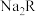 的水解常数 的水解常数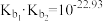 |
D.N点溶液中,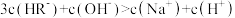 |
您最近一年使用:0次
2024-05-28更新
|
111次组卷
|
2卷引用:2024届河北省承德市部分示范高中高三下学期三模化学试题
10 .  为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.足量的Zn与一定量的浓硫酸反应产生2.24 L气体(标准状况),转移的电子数为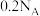 |
B.7.8 g 和 和 的混合物中含有的离子数大于 的混合物中含有的离子数大于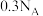 |
C.1L0.1 mol·L NaF溶液中含有的 NaF溶液中含有的 数为 数为 |
D.12 g金刚石中含有的共价键数为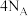 |
您最近一年使用:0次



