1 . 下列元素相关基态粒子的电子排布式中,前者一定是金属元素,后者一定是非金属元素的是
A. 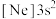 | B.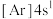 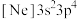 |
C. 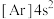 | D. 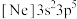 |
您最近一年使用:0次
2024-02-25更新
|
150次组卷
|
14卷引用:山西省平遥中学校2018-2019学年高二下学期第二次月考化学试题
山西省平遥中学校2018-2019学年高二下学期第二次月考化学试题宁夏吴忠市2017-2018学年高二人教版选修3化学同步练习:第1章 原子结构与性质综合练习1河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1【全国百强校】河北省武邑中学2017-2018学年高二下学期期末考试化学试题云南省盐津县第一中学2018-2019学年高二上学期12月份考试化学试题吉林省松原市扶余市第一中学2019-2020学年高二下学期期中考试化学试题广西壮族自治区北海市2019-2020学年高二下学期期末教学质量检测化学试题山西省运城市2019-2020学年高二下学期期末测试化学试题(已下线)模块同步卷02 原子结构与元素的性质-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)河南省辉县市一中2020-2021学年高二(培优班)下学期第二次阶段性考试化学试题海南省儋州川绵中学2021-2022学年高二下学期第一次月考化学试题广东省惠州市惠东县惠东荣超中学2021-2022学年高二下学期期中考试 化学试题(已下线)1.1.2 构造原理与电子排布式、电子云与原子轨道课堂例题广东梅州五华县中英文实验学校2023-2024学年高二下学期3月考试化学试题
解题方法
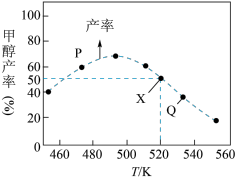
2 . 在体积为1L的恒容容器中,用CO2和H2合成甲醇CO2(g)+3H2(g) CH3OH(g)+H2O(g)。相同时间内不同的温度下,将1mol CO2和3mol H2在反应器中反应,测定CH3OH的产率与温度的关系如图所示。下列说法正确的是
CH3OH(g)+H2O(g)。相同时间内不同的温度下,将1mol CO2和3mol H2在反应器中反应,测定CH3OH的产率与温度的关系如图所示。下列说法正确的是
 CH3OH(g)+H2O(g)。相同时间内不同的温度下,将1mol CO2和3mol H2在反应器中反应,测定CH3OH的产率与温度的关系如图所示。下列说法正确的是
CH3OH(g)+H2O(g)。相同时间内不同的温度下,将1mol CO2和3mol H2在反应器中反应,测定CH3OH的产率与温度的关系如图所示。下列说法正确的是
| A.图中X点v(正)=v(逆) |
| B.该反应是吸热反应 |
| C.图中P点所示条件下,延长反应时间不能提高CH3OH的产率 |
| D.520K下,X点所对应甲醇的产率50%,则平衡常数K=1/3 |
您最近一年使用:0次
3 . 常温下,将稀盐酸滴加到等浓度的AOH溶液中,测得混合液的pH和lg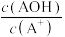 的关系如图所示,其中a点表示未加盐酸时的数据,e点表示HCl和AOH恰好完全反应时的数据。下列说法不正确的是
的关系如图所示,其中a点表示未加盐酸时的数据,e点表示HCl和AOH恰好完全反应时的数据。下列说法不正确的是
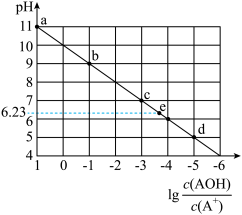
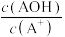 的关系如图所示,其中a点表示未加盐酸时的数据,e点表示HCl和AOH恰好完全反应时的数据。下列说法不正确的是
的关系如图所示,其中a点表示未加盐酸时的数据,e点表示HCl和AOH恰好完全反应时的数据。下列说法不正确的是
| A.AOH的电离平衡常数为10-4 | B.c点溶液中 |
C.e点溶液中 | D.b点和d点水的电离程度相等 |
您最近一年使用:0次
解题方法
4 . 硫酸锰是一种重要的化工中间体。一种以高硫锰矿(主要成分为含锰化合物及FeS)与氧化锰矿(主要成分为 等锰的氧化物)为原料制备硫酸锰的工艺流程和金属离子在水溶液中沉淀的pH范围(25℃)如下:
等锰的氧化物)为原料制备硫酸锰的工艺流程和金属离子在水溶液中沉淀的pH范围(25℃)如下:

已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO;②c(离子)≤10-5mol/L时,离子沉淀完全。
(1)“混合焙烧”时一般会将原料粉碎,这样做的主要目的是___________ 。
(2)若试剂a为MnO2,则氧化步骤发生反应的离子方程式为___________ ,若省略“氧化”步骤,造成的影响是___________ 。
(3)“中和除杂”时,应控制溶液的pH范围是___________ 。
(4)“氟化除杂”后,溶液中c(F-)浓度为0.04 ,则溶液中c(Mg2+)和c(Ca2+)的比值=
,则溶液中c(Mg2+)和c(Ca2+)的比值=______ 。[已知:Ksp(MgF2)=6.4×10-10;Ksp(CaF2)=3.6×10-12]。
 等锰的氧化物)为原料制备硫酸锰的工艺流程和金属离子在水溶液中沉淀的pH范围(25℃)如下:
等锰的氧化物)为原料制备硫酸锰的工艺流程和金属离子在水溶液中沉淀的pH范围(25℃)如下:
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 1.9 | 7.6 | 7.3 | 3.0 |
| 完全沉淀的pH | 3.2 | 9.6 | 9.3 | 5.2 |
(1)“混合焙烧”时一般会将原料粉碎,这样做的主要目的是
(2)若试剂a为MnO2,则氧化步骤发生反应的离子方程式为
(3)“中和除杂”时,应控制溶液的pH范围是
(4)“氟化除杂”后,溶液中c(F-)浓度为0.04
 ,则溶液中c(Mg2+)和c(Ca2+)的比值=
,则溶液中c(Mg2+)和c(Ca2+)的比值=
您最近一年使用:0次
5 . 草酸(H2C2O4)是一种还原性的二元弱酸(常温下,草酸的电离常数K1=5.4x10-2,K2=5.4x10-5 ),主要存在于菠菜等植物中。
(1)常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,滴定曲线如图,图中c点所示溶液中: 2c( )+2c(
)+2c( )+2c(H2C2O4)=c(Na+)
)+2c(H2C2O4)=c(Na+)

则a点所示溶液中各离子的浓度由大到小的顺序为___________ 。
(2) 中碳元素的化合价是+3价,推测其有还原性。为了验证
中碳元素的化合价是+3价,推测其有还原性。为了验证 与Fe2+ 的还原性强弱,某小组同学进行了如下实验:向10mL 0.5mol•L-1 FeCl3溶液中缓慢加入0.5mol•L-1 K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
与Fe2+ 的还原性强弱,某小组同学进行了如下实验:向10mL 0.5mol•L-1 FeCl3溶液中缓慢加入0.5mol•L-1 K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
资料:三水三草酸合铁酸钾[K3Fe(C2O4)3•3H2O]为翠绿色晶体,Fe3++3 =[Fe(C2O4)3]3- K=1.6×1020
=[Fe(C2O4)3]3- K=1.6×1020
①该小组同学学并未检出反应后的溶液中有Fe2+,从反应原理的角度解释 和Fe3+ 未发生氧化还原反应的可能的原因是
和Fe3+ 未发生氧化还原反应的可能的原因是___________ 。
② 经进一步研究分析,同学们改进了实验方案。设计了如图所示的装置,验证了 的还原性强于Fe2+。
的还原性强于Fe2+。

i.闭合K,电流计指针偏转,一段时间后,取少许左侧溶液,滴加_______ 溶液(填化学式),生成蓝色沉淀,证明左池有Fe2+生成。
ii.写出右池电极反应式:___________ 。
iii.该装置的优点是___________ 。
(1)常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,滴定曲线如图,图中c点所示溶液中: 2c(
 )+2c(
)+2c( )+2c(H2C2O4)=c(Na+)
)+2c(H2C2O4)=c(Na+)
则a点所示溶液中各离子的浓度由大到小的顺序为
(2)
 中碳元素的化合价是+3价,推测其有还原性。为了验证
中碳元素的化合价是+3价,推测其有还原性。为了验证 与Fe2+ 的还原性强弱,某小组同学进行了如下实验:向10mL 0.5mol•L-1 FeCl3溶液中缓慢加入0.5mol•L-1 K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
与Fe2+ 的还原性强弱,某小组同学进行了如下实验:向10mL 0.5mol•L-1 FeCl3溶液中缓慢加入0.5mol•L-1 K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。资料:三水三草酸合铁酸钾[K3Fe(C2O4)3•3H2O]为翠绿色晶体,Fe3++3
 =[Fe(C2O4)3]3- K=1.6×1020
=[Fe(C2O4)3]3- K=1.6×1020①该小组同学学并未检出反应后的溶液中有Fe2+,从反应原理的角度解释
 和Fe3+ 未发生氧化还原反应的可能的原因是
和Fe3+ 未发生氧化还原反应的可能的原因是② 经进一步研究分析,同学们改进了实验方案。设计了如图所示的装置,验证了
 的还原性强于Fe2+。
的还原性强于Fe2+。
i.闭合K,电流计指针偏转,一段时间后,取少许左侧溶液,滴加
ii.写出右池电极反应式:
iii.该装置的优点是
您最近一年使用:0次
6 . 某小组同学对比Na2CO3和NaHCO3的性质,进行了如下实验。
(1)向相同体积、相同浓度的Na2CO3和NaHCO3溶液中分别滴加0.1mol•L-1的盐酸,溶液pH变化如下。
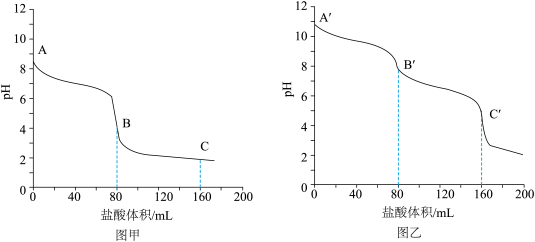
①图____ (填“甲”或“乙”)是NaHCO3的滴定曲线。
②A´—B´发生反应的离子方程式为___________ 。
③下列说法正确的是_________ (填序号)。
a.Na2CO3和NaHCO3溶液中加入饱和石灰水,均有沉淀生成
b.A和A´对应溶液中:c(Na+)+c(H+)=2c( )+c(
)+c( )+c(OH-)
)+c(OH-)
c.B和B´对应溶液中:水的电离程度前者大
d.C和C´对应溶液中:NaCl的物质的量相等
(2)向1mol•L-1的Na2CO3和NaHCO3溶液中分别滴加少量FeCl2溶液,均产生白色沉淀。
查阅资料:i.1mol•L-1的NaHCO3溶液中,c( )=1×10-2mol•L-1,c(OH-)=2×10-6mol•L-1
)=1×10-2mol•L-1,c(OH-)=2×10-6mol•L-1
ii.25℃时,Ksp(FeCO3)=3.2×10-11,Ksp[Fe(OH)2]=5.0×10-17
通过计算判断NaHCO3与FeCl2反应产生的沉淀是FeCO3,还是Fe(OH)2?_______ (要求有计算过程)。
(1)向相同体积、相同浓度的Na2CO3和NaHCO3溶液中分别滴加0.1mol•L-1的盐酸,溶液pH变化如下。

①图
②A´—B´发生反应的离子方程式为
③下列说法正确的是
a.Na2CO3和NaHCO3溶液中加入饱和石灰水,均有沉淀生成
b.A和A´对应溶液中:c(Na+)+c(H+)=2c(
 )+c(
)+c( )+c(OH-)
)+c(OH-)c.B和B´对应溶液中:水的电离程度前者大
d.C和C´对应溶液中:NaCl的物质的量相等
(2)向1mol•L-1的Na2CO3和NaHCO3溶液中分别滴加少量FeCl2溶液,均产生白色沉淀。
查阅资料:i.1mol•L-1的NaHCO3溶液中,c(
 )=1×10-2mol•L-1,c(OH-)=2×10-6mol•L-1
)=1×10-2mol•L-1,c(OH-)=2×10-6mol•L-1ii.25℃时,Ksp(FeCO3)=3.2×10-11,Ksp[Fe(OH)2]=5.0×10-17
通过计算判断NaHCO3与FeCl2反应产生的沉淀是FeCO3,还是Fe(OH)2?
您最近一年使用:0次
解题方法
7 . 我国化学家研究的一种新型光催化剂(碳纳米点/氮化碳)可以利用太阳光高效实现分解水,其原理如图所示,下列说法不正确的是
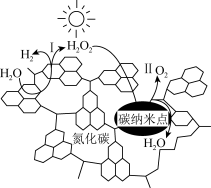

| A.碳纳米纳米点和氮化碳均为新型无机非金属材料 |
| B.若反应Ⅱ是放热反应,则反应Ⅰ一定是吸热反应 |
| C.反应Ⅰ和反应Ⅱ均存在O-H键的断裂 |
D.总反应为H2O2  H2+O2 H2+O2 |
您最近一年使用:0次
解题方法
8 . 硫氰化钾(KSCN)是一种用途广泛的化学药品,可用于合成树脂、杀虫杀菌剂、芥子油、硫脲类和药物等;也用于配制硫氰酸盐溶液,检验Fe3+、Cu2+ 和Ag+ 等。实验室模拟工业制备硫氰化钾的实验装置如图所示:
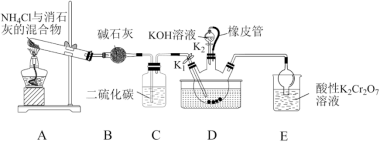
已知:① NH3不溶于CS2,CS2密度比水大且不溶于水。
② 三颈烧瓶内盛放:CS2、水和催化剂。
③ CS2+3NH3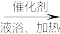 NH4SCN+NH4HS,NH4SCN+KOH
NH4SCN+NH4HS,NH4SCN+KOH KSCN+NH3↑+H2O。NH4SCN在高于170℃易分解,NH4HS在105℃就会完全分解。
KSCN+NH3↑+H2O。NH4SCN在高于170℃易分解,NH4HS在105℃就会完全分解。
回答下列问题:
(1)装置E的作用是吸收尾气,防止污染环境,写出吸收NH3时反应的的离子方程式___________ 。(已知: 被还原为Cr3+)。
被还原为Cr3+)。
(2)三颈烧瓶内盛放有CS2、水和催化剂,三颈烧瓶中的导气管口必须伸入CS2液面下,目的是___________ 。
(3)制备硫氰化钾晶体:①打开K1,加热装置A、D,缓缓地向装置D中充入气体。②一段时间后熄灭A处的酒精灯,关闭K1,保持三颈烧瓶内液温为105℃一段时间。③打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液。④反应结束后,先滤去三颈烧瓶中的固体催化剂,再减压___________ 、冷却结晶、过滤、洗涤、干燥,得到硫氰化钾晶体。
(4)测定晶体中KSCN的含量:称取6.0g样品,配成500mL溶液,量取25.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液作指示剂,用0.1000mol/LAgNO3标准溶液滴定[已知:滴定时发生反应的离子方程式:SCN-+Ag+=AgSCN↓(白色)],重复上述滴定操作2~3次,记录数据如下。
请完成下列问题:
①滴定达到终点现象为_________ 。
②晶体中KSCN的质量分数为________ 。

已知:① NH3不溶于CS2,CS2密度比水大且不溶于水。
② 三颈烧瓶内盛放:CS2、水和催化剂。
③ CS2+3NH3
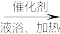 NH4SCN+NH4HS,NH4SCN+KOH
NH4SCN+NH4HS,NH4SCN+KOH KSCN+NH3↑+H2O。NH4SCN在高于170℃易分解,NH4HS在105℃就会完全分解。
KSCN+NH3↑+H2O。NH4SCN在高于170℃易分解,NH4HS在105℃就会完全分解。回答下列问题:
(1)装置E的作用是吸收尾气,防止污染环境,写出吸收NH3时反应的的离子方程式
 被还原为Cr3+)。
被还原为Cr3+)。(2)三颈烧瓶内盛放有CS2、水和催化剂,三颈烧瓶中的导气管口必须伸入CS2液面下,目的是
(3)制备硫氰化钾晶体:①打开K1,加热装置A、D,缓缓地向装置D中充入气体。②一段时间后熄灭A处的酒精灯,关闭K1,保持三颈烧瓶内液温为105℃一段时间。③打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液。④反应结束后,先滤去三颈烧瓶中的固体催化剂,再减压
(4)测定晶体中KSCN的含量:称取6.0g样品,配成500mL溶液,量取25.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液作指示剂,用0.1000mol/LAgNO3标准溶液滴定[已知:滴定时发生反应的离子方程式:SCN-+Ag+=AgSCN↓(白色)],重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | AgNO3溶液的浓度(mol/L) | 滴定完成时,AgNO3溶液滴入的体积(mL) | 待测溶液的体积(mL) |
| 1 | 0.1000 | 23.94 | 25.00 |
| 2 | 0.1000 | 24.06 | 25.00 |
| 3 | 0.1000 | 26.80 | 25.00 |
①滴定达到终点现象为
②晶体中KSCN的质量分数为
您最近一年使用:0次
解题方法
9 . 燃料电池为现代能源利用的新形式。下图为(Fe3+/Fe2+)/甲醇燃料电池,放电结束后通入空气可使Fe3+再生。下列说法不正确的是
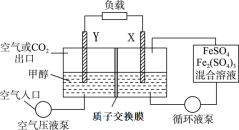

| A.X是电池的正极 |
| B.Y极的反应为CH3OH+H2O-6e−=CO2↑+6H+ |
| C.每转移1mol电子,就有1mol H+从左池移向右池 |
| D.通入空气后,电池的电流方向不发生变化 |
您最近一年使用:0次
解题方法
10 . 利用CO2催化加氢可制乙烯,反应为2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH,在两个容积均为1L恒容密闭容器中,分别加入2molCO2、4molH2,分别选用两种催化剂,反应进行相同时间,测得CO2转化率随反应温度的变化如下图所示。下列说法正确的是
C2H4(g)+4H2O(g) ΔH,在两个容积均为1L恒容密闭容器中,分别加入2molCO2、4molH2,分别选用两种催化剂,反应进行相同时间,测得CO2转化率随反应温度的变化如下图所示。下列说法正确的是
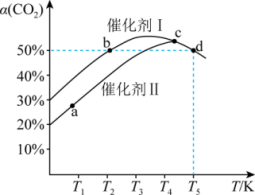
 C2H4(g)+4H2O(g) ΔH,在两个容积均为1L恒容密闭容器中,分别加入2molCO2、4molH2,分别选用两种催化剂,反应进行相同时间,测得CO2转化率随反应温度的变化如下图所示。下列说法正确的是
C2H4(g)+4H2O(g) ΔH,在两个容积均为1L恒容密闭容器中,分别加入2molCO2、4molH2,分别选用两种催化剂,反应进行相同时间,测得CO2转化率随反应温度的变化如下图所示。下列说法正确的是
| A.该反应的ΔH<0 |
| B.使用催化剂I时反应的活化能比使用催化剂II时高 |
| C.b、d两状态下,化学反应速率相等 |
| D.T5温度下,向容器中加入稀有气体,可提高CO2的转化率 |
您最近一年使用:0次



