名校
解题方法
1 . 二苯铬[(C6H6)2Cr]可作烯烃聚合或异丙醇脱氢等反应的催化剂,工业上常用 Cr2O3为原料按如下流程制备二苯铬
下列说法正确的是
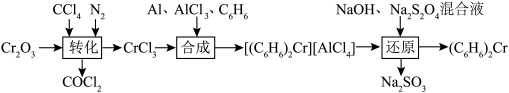
下列说法正确的是
| A.为了向“转化”提供稳定的CCl4气流,可用水浴加热 CCl4并用氮气带出CCl4 |
| B.1mol[(C6H6)2Cr][AlCl4]中含有6NA个配位键(NA表示阿伏加德罗常数的值) |
| C.“还原”中,还需通入一定量N₂,主要目的是防止Na2S2O4被氧化 |
| D.“还原”后,经过滤、蒸馏水洗涤可得到纯净的二苯铬 |
您最近一年使用:0次
2024-05-30更新
|
173次组卷
|
4卷引用:湖南省邵阳市第二中学2024届下学期5月模拟考试(三模)化学试题
2 . 丙烯是一种重要的化工原料,但丙烯的产是仅通过石油的催化裂解反应无法满足工业生产需求。工业上,有如下方法制备丙烯:
Ⅰ.丙烷脱氢法制丙烯:
①丙烷无氧脱氢法: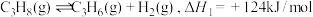
②丙烷氧化脱氢法: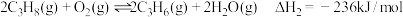
(1)反应②的正反应活化能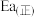
______ 逆反应活化能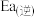 (填“>”或“<”)。
(填“>”或“<”)。
(2)不同压强下,向密闭容器中充入 气体发生反应①,丙烷平衡转化率随温度变化关系如图:在
气体发生反应①,丙烷平衡转化率随温度变化关系如图:在 、
、 条件下,若向密闭容器中充入
条件下,若向密闭容器中充入 和
和 的混合气体,则平衡时丙烷转化率
的混合气体,则平衡时丙烷转化率______ 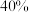 (填“>”或“=”或“<”)。
(填“>”或“=”或“<”)。
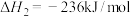 的机理,下列说法正确的是______(填字母)。
的机理,下列说法正确的是______(填字母)。
(4)丙烯是一种燃料,以熔融碳酸盐(用 表示)为电解质,丙烯——空气燃料电池的负极的电极反应式
表示)为电解质,丙烯——空气燃料电池的负极的电极反应式______ 。
Ⅱ.丁烯和乙烯的催化反应制丙烯:
主反应:
副反应: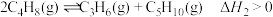
(5)乙烯的电子式为______ 。
(6)某温度下,保持体系总压强为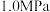 ,按
,按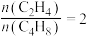 投料,达平衡状态时,
投料,达平衡状态时, 、
、 的转化率分别为
的转化率分别为 、
、 ,则平衡时
,则平衡时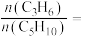
______ ;主反应的压强平衡常数
______ (保留一位小数)。
Ⅰ.丙烷脱氢法制丙烯:
①丙烷无氧脱氢法:
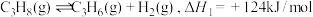
②丙烷氧化脱氢法:
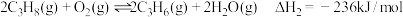
(1)反应②的正反应活化能
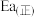
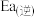 (填“>”或“<”)。
(填“>”或“<”)。(2)不同压强下,向密闭容器中充入
 气体发生反应①,丙烷平衡转化率随温度变化关系如图:在
气体发生反应①,丙烷平衡转化率随温度变化关系如图:在 、
、 条件下,若向密闭容器中充入
条件下,若向密闭容器中充入 和
和 的混合气体,则平衡时丙烷转化率
的混合气体,则平衡时丙烷转化率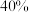 (填“>”或“=”或“<”)。
(填“>”或“=”或“<”)。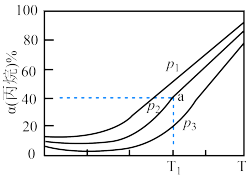

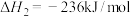 的机理,下列说法正确的是______(填字母)。
的机理,下列说法正确的是______(填字母)。
A.该机理中,有 键、 键、 键的断裂与形成 键的断裂与形成 |
B.若有 参与反应,最终 参与反应,最终 存在于羰基催化剂和 存在于羰基催化剂和 中 中 |
C.若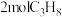 和 和 充分反应,则可制得 充分反应,则可制得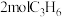 |
| D.为了提高反应的速率和反应物转化率,温度越高越好 |
(4)丙烯是一种燃料,以熔融碳酸盐(用
 表示)为电解质,丙烯——空气燃料电池的负极的电极反应式
表示)为电解质,丙烯——空气燃料电池的负极的电极反应式Ⅱ.丁烯和乙烯的催化反应制丙烯:
主反应:

副反应:
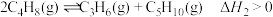
(5)乙烯的电子式为
(6)某温度下,保持体系总压强为
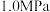 ,按
,按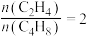 投料,达平衡状态时,
投料,达平衡状态时, 、
、 的转化率分别为
的转化率分别为 、
、 ,则平衡时
,则平衡时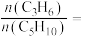

您最近一年使用:0次
名校
解题方法
3 . 请回答下列问题。
(1)染发剂中普遍含有对苯二胺(其化学式为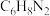 )会使易过敏的人引起发痒、水肿、气喘、胃炎和贫血等症状,另外它还具有致癌作用。因此:慎用染发剂,少染发为好。一个对苯二胺分子中碳氢氮原子最简个数比
)会使易过敏的人引起发痒、水肿、气喘、胃炎和贫血等症状,另外它还具有致癌作用。因此:慎用染发剂,少染发为好。一个对苯二胺分子中碳氢氮原子最简个数比_______ 。
(2)请判断下列物质之间的关系:A.同系物,B.同分异构体。2-甲基丁烷和丁烷_______ ;(填“A”或者“B”)异戊烷和2,2-二甲基丙烷_______ ;(填“A”或者“B”)
(3)单烯烃通式:(链状烯烃只含有一个碳碳双键),其通式为_______ 。
(4)请写出异丁烷的结构简式_______
(5)(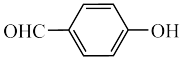 )和(
)和(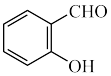 )两种有机物是同分异构体,已知易形成分子间氢键的物质沸点更高,则沸点更低芳香族化合物的命名为
)两种有机物是同分异构体,已知易形成分子间氢键的物质沸点更高,则沸点更低芳香族化合物的命名为_______ 。
(6)① 、②
、② 、③
、③ 三种分子中,键角由大到小的顺序
三种分子中,键角由大到小的顺序_______ 。
(7)苯丙氨酸(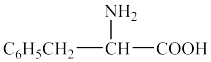 )有多种同分异构体,其中同时符合条件:①有带两个取代基的苯环②有一个硝基直接连接在苯环上的同分异构体有
)有多种同分异构体,其中同时符合条件:①有带两个取代基的苯环②有一个硝基直接连接在苯环上的同分异构体有_______ 种(不考虑立体异构)。
(1)染发剂中普遍含有对苯二胺(其化学式为
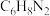 )会使易过敏的人引起发痒、水肿、气喘、胃炎和贫血等症状,另外它还具有致癌作用。因此:慎用染发剂,少染发为好。一个对苯二胺分子中碳氢氮原子最简个数比
)会使易过敏的人引起发痒、水肿、气喘、胃炎和贫血等症状,另外它还具有致癌作用。因此:慎用染发剂,少染发为好。一个对苯二胺分子中碳氢氮原子最简个数比(2)请判断下列物质之间的关系:A.同系物,B.同分异构体。2-甲基丁烷和丁烷
(3)单烯烃通式:(链状烯烃只含有一个碳碳双键),其通式为
(4)请写出异丁烷的结构简式
(5)(
 )和(
)和( )两种有机物是同分异构体,已知易形成分子间氢键的物质沸点更高,则沸点更低芳香族化合物的命名为
)两种有机物是同分异构体,已知易形成分子间氢键的物质沸点更高,则沸点更低芳香族化合物的命名为(6)①
 、②
、② 、③
、③ 三种分子中,键角由大到小的顺序
三种分子中,键角由大到小的顺序(7)苯丙氨酸(
 )有多种同分异构体,其中同时符合条件:①有带两个取代基的苯环②有一个硝基直接连接在苯环上的同分异构体有
)有多种同分异构体,其中同时符合条件:①有带两个取代基的苯环②有一个硝基直接连接在苯环上的同分异构体有
您最近一年使用:0次
4 . 聚酰亚胺是重要的特种工程塑料,广泛应用于航空、纳米、激光等领域,被称为“解决问题的能手”。聚合物 是合成聚酰亚胺的中间体。一种合成聚合物
是合成聚酰亚胺的中间体。一种合成聚合物 的路线图如下:
的路线图如下:
(1) 中官能团的名称是
中官能团的名称是______ , 的反应类型是
的反应类型是______ 。
(2) 苯环上的一氯代物有2种,则
苯环上的一氯代物有2种,则 的化学方程式是
的化学方程式是______
(3)下列有关说法正确的是______ (填字母)。
a.A中所有原子可能共平面
b.B生成C所需试剂是浓硝酸,反应条件是浓硫酸和加热
c.能够用酸性 溶液鉴别
溶液鉴别 、
、
d. 中所有碳原子的杂化方式均为
中所有碳原子的杂化方式均为 杂化
杂化
(4) 的结构简式为
的结构简式为______ 。
(5)同时符合下列条件的B的同分异构体有______ 种。
①含有苯环;②能与 溶液反应生成
溶液反应生成 ;
;
(6)参照上述合成路线,设计由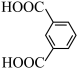 、
、 和
和 制备
制备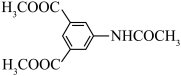 的合成路线:
的合成路线:______ (用流程图表示,无机试剂任选)。
 是合成聚酰亚胺的中间体。一种合成聚合物
是合成聚酰亚胺的中间体。一种合成聚合物 的路线图如下:
的路线图如下:
ⅰ.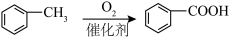
ⅱ.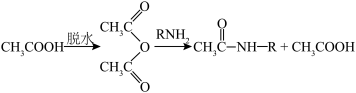 (R代表烃基)
(R代表烃基)
(1)
 中官能团的名称是
中官能团的名称是 的反应类型是
的反应类型是(2)
 苯环上的一氯代物有2种,则
苯环上的一氯代物有2种,则 的化学方程式是
的化学方程式是(3)下列有关说法正确的是
a.A中所有原子可能共平面
b.B生成C所需试剂是浓硝酸,反应条件是浓硫酸和加热
c.能够用酸性
 溶液鉴别
溶液鉴别 、
、
d.
 中所有碳原子的杂化方式均为
中所有碳原子的杂化方式均为 杂化
杂化(4)
 的结构简式为
的结构简式为(5)同时符合下列条件的B的同分异构体有
①含有苯环;②能与
 溶液反应生成
溶液反应生成 ;
;(6)参照上述合成路线,设计由
 、
、 和
和 制备
制备 的合成路线:
的合成路线:
您最近一年使用:0次
5 . 青霉素是一种高效、低毒的抗生素,青霉素的使用增强了人类抵抗细菌性感染的能力。青霉素结构如图所示,下列关于青霉素的说法中正确的是
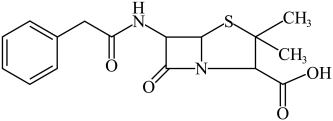
| A.1个青霉素分子中有4个手性C原子 | B.青霉素分子与水分子之间能形成氢键 |
C.青霉素分子中的 原子的杂化类型是 原子的杂化类型是 | D. 青霉素最多能与 青霉素最多能与 反应 反应 |
您最近一年使用:0次
6 . 研究物质性质及物质转化具有重要的价值,根据所学知识回答下列问题:
(1)下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示置换反应的是___________ (填字母)。
①下列应用或事实与胶体的性质有关系的是___________ 。
A.在 溶液中滴加
溶液中滴加 溶液出现红褐色沉淀
溶液出现红褐色沉淀
B.在河流入海处易形成三角洲
C.用石膏或盐卤点制豆腐
②提纯明胶的水溶液和 溶液装置是下列中的
溶液装置是下列中的___________ (填序号)。___________ (填化学式),若该反应生成标准状况下的气体为8.96L,则该反应中转移电子的数目为___________ 。
(4)中国古代著作中有“银针验毒”的记录,其原理为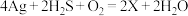 ,则X的化学式是
,则X的化学式是___________ ,其中 在该反应中
在该反应中___________ (填标号)。
A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(1)下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示置换反应的是

①下列应用或事实与胶体的性质有关系的是
A.在
 溶液中滴加
溶液中滴加 溶液出现红褐色沉淀
溶液出现红褐色沉淀B.在河流入海处易形成三角洲
C.用石膏或盐卤点制豆腐
②提纯明胶的水溶液和
 溶液装置是下列中的
溶液装置是下列中的A. B.
B. 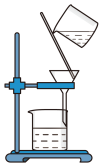 C.
C.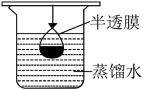
(4)中国古代著作中有“银针验毒”的记录,其原理为
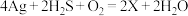 ,则X的化学式是
,则X的化学式是 在该反应中
在该反应中A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
您最近一年使用:0次
名校
解题方法
7 . 温室气体CO2资源化利用的一种途径如下,生成物H和I可用作锂离子电池的电解质。___________ 。
(2)A的聚合物聚乙炔___________ (填有、无)顺反异构。1974年聚乙炔被发现至今,导电高分子科学与技术已有了很大发展。一种理论认为聚乙炔能导电性,和石墨导电原理相似,在聚乙炔中存在着一个巨大的离域大π键,电子可以在整个键上“自由移动”。假如某相对分子质量为40000的聚丙炔满足上述理论,则该聚丙炔的聚合度n= ___________ ,聚丙炔中存在的离域大π键可表示为___________
(3)A与x反应生成B,该反应的原子利用率为100%,则其化学方程式为___________ 。
(4)F到G反应类型为___________ 。
(5)G的同分异构体中满足可以发生水解反应且一种水解产物遇铁离子显紫色条件的有___________ 种。其中核磁共振氢谱有4组峰,且峰面积之比为6:2:1:1的同分异构体的结构简式为___________ 。
(6)选用A的同系物和x为原料,参考上述信息,制备 和
和 。写出该合成路线
。写出该合成路线___________ (无机试剂任选)。

(2)A的聚合物聚乙炔
(3)A与x反应生成B,该反应的原子利用率为100%,则其化学方程式为
(4)F到G反应类型为
(5)G的同分异构体中满足可以发生水解反应且一种水解产物遇铁离子显紫色条件的有
(6)选用A的同系物和x为原料,参考上述信息,制备
 和
和 。写出该合成路线
。写出该合成路线
您最近一年使用:0次
8 . 下列选项正确的是:
| A.K3[Fe(CN)6]溶液滴入FeCl2溶液中:K++Fe2++[Fe(CN)6]3-=KFe[Fe(CN)6]↓,则1molFe2+的配位数是6NA |
B.反应:CH3CO18OH+C2H5OH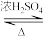 CH3COOC2H5+H218O中, CH3COOC2H5+H218O中,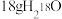 含有的中子数为10 NA 含有的中子数为10 NA |
| C.铅酸蓄电池充电时的阳极反应:Pb2++2H2O-2e-=PbO2+4H+,当线路中通过2NA个电子时,阳极减重64g |
D.将H2S气体通入NaClO溶液出现浑浊的离子方程式:H2S + ClO- = S↓ + Cl- + H2O,若产生的S为S8(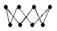 ),则32gS8中含有2NA个孤电子对 ),则32gS8中含有2NA个孤电子对 |
您最近一年使用:0次
名校
解题方法
9 . 按照要求回答问题。
(1)氮化硅是一种性能优异的无机非金属材料,它的熔点高,硬度大,电绝缘性好,化学性质稳定,请写出氮化硅的化学式___________ 。
(2)盛放NaOH溶液的试剂瓶不能用玻璃塞,其原因是(用离子方程式表示):___________ 。工艺师常用___________ (填物质名称)来雕刻玻璃。
(3)硫单质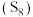 能与碱反应,化学反应:
能与碱反应,化学反应: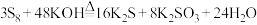 ,反应中氧化剂与还原剂的物质的量之比为
,反应中氧化剂与还原剂的物质的量之比为___________ 。
(4)将12.8 g铜与足量的浓硝酸反应,产生NO和 气体的体积为5.60 L(标况下),则参加反应的硝酸的物质的量为
气体的体积为5.60 L(标况下),则参加反应的硝酸的物质的量为___________ 。
(5)实验室用NaOH浓溶液配制0.1 NaOH溶液500mL,需量取密度为1.4
NaOH溶液500mL,需量取密度为1.4 质量分数为40%的NaOH溶液
质量分数为40%的NaOH溶液___________ mL(保留一位小数),该实验所需的玻璃仪器除玻璃棒、量筒、胶头滴管、烧杯之外,还有___________ 。
(6)化学反应 的能量变化如图所示。已知断开1mol N-H键、1mol
的能量变化如图所示。已知断开1mol N-H键、1mol  键分别需要吸收的能量为391kJ、946kJ。1mol
键分别需要吸收的能量为391kJ、946kJ。1mol  中的化学键断裂要吸收
中的化学键断裂要吸收___________ kJ能量。
(1)氮化硅是一种性能优异的无机非金属材料,它的熔点高,硬度大,电绝缘性好,化学性质稳定,请写出氮化硅的化学式
(2)盛放NaOH溶液的试剂瓶不能用玻璃塞,其原因是(用离子方程式表示):
(3)硫单质
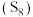 能与碱反应,化学反应:
能与碱反应,化学反应: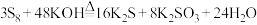 ,反应中氧化剂与还原剂的物质的量之比为
,反应中氧化剂与还原剂的物质的量之比为(4)将12.8 g铜与足量的浓硝酸反应,产生NO和
 气体的体积为5.60 L(标况下),则参加反应的硝酸的物质的量为
气体的体积为5.60 L(标况下),则参加反应的硝酸的物质的量为(5)实验室用NaOH浓溶液配制0.1
 NaOH溶液500mL,需量取密度为1.4
NaOH溶液500mL,需量取密度为1.4 质量分数为40%的NaOH溶液
质量分数为40%的NaOH溶液(6)化学反应
 的能量变化如图所示。已知断开1mol N-H键、1mol
的能量变化如图所示。已知断开1mol N-H键、1mol  键分别需要吸收的能量为391kJ、946kJ。1mol
键分别需要吸收的能量为391kJ、946kJ。1mol  中的化学键断裂要吸收
中的化学键断裂要吸收
您最近一年使用:0次
名校
解题方法
10 . 正定城墙位于河北省石家庄市正定县,是明朝时期的古建筑遗存。下列说法正确的是
| A.正定城墙易受酸雨腐蚀,酸雨是pH<5.6的雨水 |
B.正定城墙的青砖富含 , , 俗称铁红 俗称铁红 |
| C.正定城墙“九省通衢”的石质匾额的主要成分为金属材料 |
| D.长乐门城楼外墙的红色涂料的主要成分为CuO |
您最近一年使用:0次
2024-04-26更新
|
121次组卷
|
2卷引用:湖南省邵阳市邵东市创新高级中学2023-2024学年高一下学期4月期中考试化学试题



