1 . 一定条件下,乙酸酐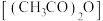 醇解反应
醇解反应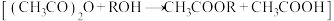 可进行完全,利用此反应定量测定有机醇
可进行完全,利用此反应定量测定有机醇 中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:
中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:
①配制一定浓度的乙酸酐-苯溶液。
②量取一定体积乙酸酐-苯溶液置于锥形瓶中,加入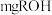 样品,充分反应后,加适量水使剩余乙酸酐完全水解:
样品,充分反应后,加适量水使剩余乙酸酐完全水解: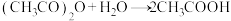 。
。
③加指示剂并用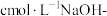 甲醇标准溶液滴定至终点,消耗标准溶液
甲醇标准溶液滴定至终点,消耗标准溶液 。
。
④在相同条件下,量取相同体积的乙酸酐-苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用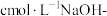 甲醇标准溶液滴定至终点,消耗标准溶液
甲醇标准溶液滴定至终点,消耗标准溶液 。
。 样品中羟基含量(质量分数)计算正确的是
样品中羟基含量(质量分数)计算正确的是
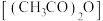 醇解反应
醇解反应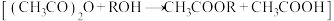 可进行完全,利用此反应定量测定有机醇
可进行完全,利用此反应定量测定有机醇 中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:
中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:①配制一定浓度的乙酸酐-苯溶液。
②量取一定体积乙酸酐-苯溶液置于锥形瓶中,加入
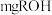 样品,充分反应后,加适量水使剩余乙酸酐完全水解:
样品,充分反应后,加适量水使剩余乙酸酐完全水解: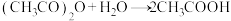 。
。③加指示剂并用
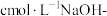 甲醇标准溶液滴定至终点,消耗标准溶液
甲醇标准溶液滴定至终点,消耗标准溶液 。
。④在相同条件下,量取相同体积的乙酸酐-苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用
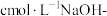 甲醇标准溶液滴定至终点,消耗标准溶液
甲醇标准溶液滴定至终点,消耗标准溶液 。
。 样品中羟基含量(质量分数)计算正确的是
样品中羟基含量(质量分数)计算正确的是A.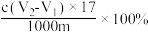 | B.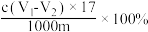 |
C.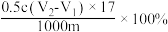 | D.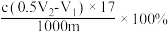 |
您最近一年使用:0次
2023-06-19更新
|
6672次组卷
|
8卷引用:2023年高考山东卷化学真题
2023年高考山东卷化学真题(已下线)2023年高考山东卷化学真题变式题(选择题6-10)(已下线)专题11 化学实验(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题03 化学计量-2023年高考化学真题题源解密(全国通用)(已下线)考点46 定量分析实验(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)陕西省西安市西北工业大学附属中学2023-2024学年高二上学期第一次月考化学试题(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)选择题11-14
2 . 某同学利用Cl2氧化K2MnO4制备KMnO4的装置如下图所示(夹持装置略):
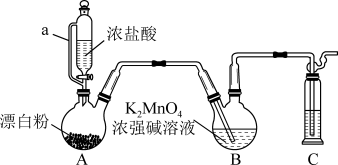
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
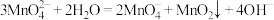
回答下列问题:
(1)装置A中a的作用是______________ ;装置C中的试剂为________________ ;装置A中制备Cl2的化学方程为______________ 。
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是________________ 。
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入___________ (填“酸式”或“碱式”)滴定管中;在规格为50.00mL的滴定管中,若KMnO4溶液起始读数为15.00mL,此时滴定管中KMnO4溶液的实际体积为______________ (填标号)。
A.15.00 mL B.35.00mL C.大于35.00mL D.小于15.00m1
(4)某FeC2O4﹒2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4﹒2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 c mol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含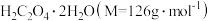 的质量分数表达式为
的质量分数表达式为_________________ 。
下列关于样品组成分析的说法,正确的是__________ (填标号)。
A.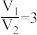 时,样品中一定不含杂质
时,样品中一定不含杂质
B.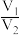 越大,样品中
越大,样品中 含量一定越高
含量一定越高
C.若步骤I中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高

已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
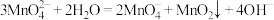
回答下列问题:
(1)装置A中a的作用是
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入
A.15.00 mL B.35.00mL C.大于35.00mL D.小于15.00m1
(4)某FeC2O4﹒2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4﹒2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 c mol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含
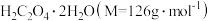 的质量分数表达式为
的质量分数表达式为下列关于样品组成分析的说法,正确的是
A.
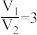 时,样品中一定不含杂质
时,样品中一定不含杂质B.
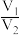 越大,样品中
越大,样品中 含量一定越高
含量一定越高C.若步骤I中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
您最近一年使用:0次
2020-07-11更新
|
9310次组卷
|
27卷引用:2020年山东省高考化学试卷(新高考)
2020年山东省高考化学试卷(新高考)(已下线)专题16 化学实验综合题-2020年高考真题和模拟题化学分项汇编河南省三门峡市第一高级中学2021届高三8月开学考试化学试题江西省高安中学2020-2021学年高二上学期第一次段考化学(A)试题黑龙江省哈尔滨三中2021届高三上学期期中考试化学试题福建省福州市第一中学2021届高三上学期开学质检化学试题(已下线)专题讲座(九) 热点实验综合探究 (精讲)-2021年高考化学一轮复习讲练测(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)重点7 化学实验综合题-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)重点4 物质制备分析-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)重庆市缙云教育联盟2020-2021学年高二下学期期末质量检测化学试题选择性必修1 专题3素养检测(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)山东省济宁市实验中学2022届高三上学期开学考试化学试题山东省临沂市临沭第一中学2022届高三上学期开学考试化学试题(已下线)专题17 综合实验设计、探究和评价-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省潍坊市第一中学2022届高三10月月考化学试题(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)押新高考卷16题 化学实验综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)考点52 定量分析-备战2023年高考化学一轮复习考点帮(全国通用)北京市第二十中学2022-2023学年高三下学期开学检测化学试题(已下线)第一部分 化学综合实验 热点5 物质制备实验与定量测定实验(已下线)专题19 实验综合题
真题
名校
3 . 硒和硫是同一主族元素,二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和一定量的浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3反应的化学方程式:________________________________________ 。
(2)已知:Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O===Se+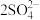 +4H+,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
+4H+,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________________________________ 。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①_____SeO2+_______KI+______HNO3=__________Se+__________I2+__________KNO3+_______H2O
②I2+2Na2S2O3===Na2S4O6+2NaI
配平化学方程①,并标出电子转移的方向和数目。__________
(4)实验中,准确称量SeO2样品0.1500g,消耗了0.2000mol·L-1的Na2S2O3溶液25.00mL,所测样品中SeO2的质量分数为__________ 。
(1)Se和一定量的浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3反应的化学方程式:
(2)已知:Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O===Se+
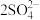 +4H+,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
+4H+,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①_____SeO2+_______KI+______HNO3=__________Se+__________I2+__________KNO3+_______H2O
②I2+2Na2S2O3===Na2S4O6+2NaI
配平化学方程①,并标出电子转移的方向和数目。
(4)实验中,准确称量SeO2样品0.1500g,消耗了0.2000mol·L-1的Na2S2O3溶液25.00mL,所测样品中SeO2的质量分数为
您最近一年使用:0次
2012-11-23更新
|
1465次组卷
|
16卷引用:2012年上海市高考化学试题
2012年上海市高考化学试题(已下线)2013届浙江省乐清市第二中学高三第一次月考化学试卷(已下线)2012-2013学年湖北省部分重点中学高一秋季期中联考化学试卷(已下线)2013-2014黑龙江省鹤岗一中高二下学期期末考试化学试卷2016届山东省枣庄市第二中学高三9月阶段性学情检测化学试题2016届重庆市万州二中高三上学期9月月考化学试卷2016届江西省高安市第二中学高三上学期第二次段考化学试卷2016届山西省晋中市四校高三上学期期中联考化学试卷2016届山西平遥中学等重点中学高三第三次练兵化学试卷2016届辽宁省实验中学分校高三上期中测试理综化学试卷2017届湖北省荆州中学高三上学期8月摸底化学试卷2018届高三一轮复习化学:考点14-氧化还原反应的计算山东省济宁市微山县第二中学2018届高三上学期第一次月考化学试题安徽省合肥市第六中学2017-2018学年高一上学期期中考试化学试题北京市第二十中学2018届高三10月月考化学试题吉林省白城市通榆县第一中学2020届高三上学期第一次月考化学试题
4 . 黄金按质量分数分级,纯金为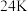 。
。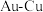 合金的三种晶胞结构如图,Ⅱ和Ⅲ是立方晶胞。下列说法错误的是
合金的三种晶胞结构如图,Ⅱ和Ⅲ是立方晶胞。下列说法错误的是
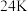 。
。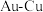 合金的三种晶胞结构如图,Ⅱ和Ⅲ是立方晶胞。下列说法错误的是
合金的三种晶胞结构如图,Ⅱ和Ⅲ是立方晶胞。下列说法错误的是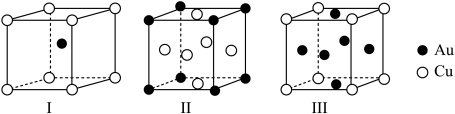
A.I为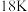 金 金 |
B.Ⅱ中 的配位数是12 的配位数是12 |
C.Ⅲ中最小核间距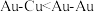 |
D.I、Ⅱ、Ⅲ中, 与 与 原子个数比依次为 原子个数比依次为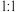 、 、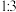 、 、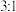 |
您最近一年使用:0次
真题
5 .  气氛下,
气氛下,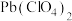 溶液中含铅物种的分布如图。纵坐标(
溶液中含铅物种的分布如图。纵坐标( )为组分中铅占总铅的质量分数。已知
)为组分中铅占总铅的质量分数。已知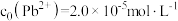 ,
,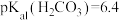 、
、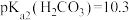 ,
,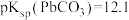 。下列说法错误的是
。下列说法错误的是
 气氛下,
气氛下,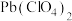 溶液中含铅物种的分布如图。纵坐标(
溶液中含铅物种的分布如图。纵坐标( )为组分中铅占总铅的质量分数。已知
)为组分中铅占总铅的质量分数。已知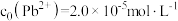 ,
,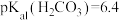 、
、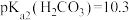 ,
,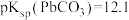 。下列说法错误的是
。下列说法错误的是
A. 时,溶液中 时,溶液中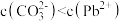 |
B.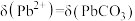 时, 时,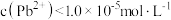 |
C. 时, 时,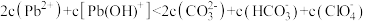 |
D. 时,溶液中加入少量 时,溶液中加入少量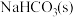 , , 会溶解 会溶解 |
您最近一年使用:0次
真题
解题方法
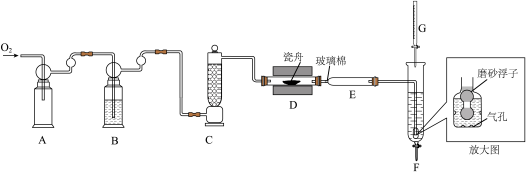
6 . 利用“燃烧—碘酸钾滴定法”测定钢铁中硫含量的实验装置如下图所示(夹持装置略)。
①加样,将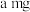 样品加入管式炉内瓷舟中(瓷舟两端带有气孔且有盖),聚四氟乙烯活塞滴定管G内预装
样品加入管式炉内瓷舟中(瓷舟两端带有气孔且有盖),聚四氟乙烯活塞滴定管G内预装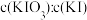 略小于
略小于 的
的 碱性标准溶液,吸收管F内盛有盐酸酸化的淀粉水溶液。向F内滴入适量
碱性标准溶液,吸收管F内盛有盐酸酸化的淀粉水溶液。向F内滴入适量 碱性标准溶液,发生反应:
碱性标准溶液,发生反应: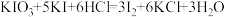 ,使溶液显浅蓝色。
,使溶液显浅蓝色。
②燃烧:按一定流速通入 ,一段时间后,加热并使样品燃烧。
,一段时间后,加热并使样品燃烧。
③滴定:当F内溶液浅蓝色消退时(发生反应: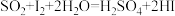 ),立即用
),立即用 碱性标准溶液滴定至浅蓝色复现。随
碱性标准溶液滴定至浅蓝色复现。随 不断进入F,滴定过程中溶液颜色“消退-变蓝”不断变换,直至终点。
不断进入F,滴定过程中溶液颜色“消退-变蓝”不断变换,直至终点。
回答下列问题:
(1)取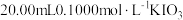 的碱性溶液和一定量的
的碱性溶液和一定量的 固体,配制
固体,配制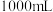
 碱性标准溶液,下列仪器必须用到的是_______(填标号)。
碱性标准溶液,下列仪器必须用到的是_______(填标号)。
(2)装置B和C的作用是充分干燥 ,B中的试剂为
,B中的试剂为_______ 。装置F中通气管末端多孔玻璃泡内置一密度小于水的磨砂浮子(见放大图),目的是_______ 。
(3)该滴定实验达终点的现象是_______ ;滴定消耗 碱性标准溶液
碱性标准溶液 ,样品中硫的质量分数是
,样品中硫的质量分数是_______ (用代数式表示)。
(4)若装置D中瓷舟未加盖,会因燃烧时产生粉尘而促进 的生成,粉尘在该过程中的作用是
的生成,粉尘在该过程中的作用是_______ ;若装置E冷却气体不充分,可能导致测定结果偏大,原因是_______ ;若滴定过程中,有少量 不经
不经 直接将
直接将 氧化成
氧化成 ,测定结果会
,测定结果会_______ (填“偏大”“偏小”或“不变”)。
①加样,将
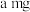 样品加入管式炉内瓷舟中(瓷舟两端带有气孔且有盖),聚四氟乙烯活塞滴定管G内预装
样品加入管式炉内瓷舟中(瓷舟两端带有气孔且有盖),聚四氟乙烯活塞滴定管G内预装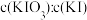 略小于
略小于 的
的 碱性标准溶液,吸收管F内盛有盐酸酸化的淀粉水溶液。向F内滴入适量
碱性标准溶液,吸收管F内盛有盐酸酸化的淀粉水溶液。向F内滴入适量 碱性标准溶液,发生反应:
碱性标准溶液,发生反应: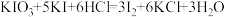 ,使溶液显浅蓝色。
,使溶液显浅蓝色。②燃烧:按一定流速通入
 ,一段时间后,加热并使样品燃烧。
,一段时间后,加热并使样品燃烧。③滴定:当F内溶液浅蓝色消退时(发生反应:
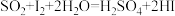 ),立即用
),立即用 碱性标准溶液滴定至浅蓝色复现。随
碱性标准溶液滴定至浅蓝色复现。随 不断进入F,滴定过程中溶液颜色“消退-变蓝”不断变换,直至终点。
不断进入F,滴定过程中溶液颜色“消退-变蓝”不断变换,直至终点。回答下列问题:
(1)取
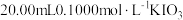 的碱性溶液和一定量的
的碱性溶液和一定量的 固体,配制
固体,配制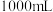
 碱性标准溶液,下列仪器必须用到的是_______(填标号)。
碱性标准溶液,下列仪器必须用到的是_______(填标号)。| A.玻璃棒 | B. 锥形瓶 锥形瓶 | C. 容量瓶 容量瓶 | D.胶头滴管 |
(2)装置B和C的作用是充分干燥
 ,B中的试剂为
,B中的试剂为(3)该滴定实验达终点的现象是
 碱性标准溶液
碱性标准溶液 ,样品中硫的质量分数是
,样品中硫的质量分数是(4)若装置D中瓷舟未加盖,会因燃烧时产生粉尘而促进
 的生成,粉尘在该过程中的作用是
的生成,粉尘在该过程中的作用是 不经
不经 直接将
直接将 氧化成
氧化成 ,测定结果会
,测定结果会
您最近一年使用:0次
7 .  是一种用途广泛的磁性材料,以
是一种用途广泛的磁性材料,以 为原料制备
为原料制备 并获得副产物
并获得副产物 水合物的工艺如下。
水合物的工艺如下。 时各物质溶度积见下表:
时各物质溶度积见下表:
回答下列问题:
(1) 中
中 元素的化合价是
元素的化合价是 和
和_______ 。 的核外电子排布式为
的核外电子排布式为_______ 。
(2)反应釜1中的反应需在隔绝空气条件下进行,其原因是_______ 。
(3)反应釜2中,加入 和分散剂的同时通入空气。
和分散剂的同时通入空气。
①反应的离子方程式为_______ 。
②为加快反应速率,可采取的措施有_______ 。(写出两项即可)。
(4)①反应釜3中, 时,
时, 浓度为
浓度为 ,理论上
,理论上 不超过
不超过_______ 。
②称取 水合物
水合物 ,加水溶解,加入过量
,加水溶解,加入过量 ,将所得沉淀过滤洗涤后,溶于热的稀硫酸中,用
,将所得沉淀过滤洗涤后,溶于热的稀硫酸中,用 标准溶液滴定,消耗
标准溶液滴定,消耗 。滴定达到终点的现象为
。滴定达到终点的现象为_______ ,该副产物中 的质量分数为
的质量分数为_______ 。
 是一种用途广泛的磁性材料,以
是一种用途广泛的磁性材料,以 为原料制备
为原料制备 并获得副产物
并获得副产物 水合物的工艺如下。
水合物的工艺如下。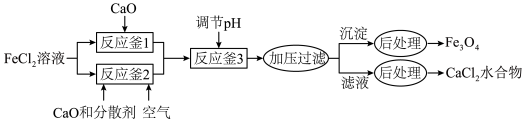
 时各物质溶度积见下表:
时各物质溶度积见下表:| 物质 |  |  |  |
溶度积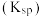 |  |  |  |
(1)
 中
中 元素的化合价是
元素的化合价是 和
和 的核外电子排布式为
的核外电子排布式为(2)反应釜1中的反应需在隔绝空气条件下进行,其原因是
(3)反应釜2中,加入
 和分散剂的同时通入空气。
和分散剂的同时通入空气。①反应的离子方程式为
②为加快反应速率,可采取的措施有
(4)①反应釜3中,
 时,
时, 浓度为
浓度为 ,理论上
,理论上 不超过
不超过②称取
 水合物
水合物 ,加水溶解,加入过量
,加水溶解,加入过量 ,将所得沉淀过滤洗涤后,溶于热的稀硫酸中,用
,将所得沉淀过滤洗涤后,溶于热的稀硫酸中,用 标准溶液滴定,消耗
标准溶液滴定,消耗 。滴定达到终点的现象为
。滴定达到终点的现象为 的质量分数为
的质量分数为
您最近一年使用:0次
2023-09-28更新
|
4694次组卷
|
5卷引用:2023年重庆市高考化学试卷
真题
解题方法
8 . 氢能是理想清洁能源,氢能产业链由制氢、储氢和用氢组成。
(1)利用铁及其氧化物循环制氢,原理如图所示。反应器Ⅰ中化合价发生改变的元素有_______ ;含CO和 各1mol的混合气体通过该方法制氢,理论上可获得
各1mol的混合气体通过该方法制氢,理论上可获得_______ 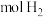 。
。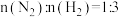 混合匀速通入合成塔,发生反应
混合匀速通入合成塔,发生反应 。海绵状的
。海绵状的 作催化剂,多孔
作催化剂,多孔 作为
作为 的“骨架”和气体吸附剂。
的“骨架”和气体吸附剂。
① 中含有CO会使催化剂中毒。
中含有CO会使催化剂中毒。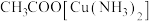 和氨水的混合溶液能吸收CO生成
和氨水的混合溶液能吸收CO生成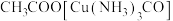 溶液,该反应的化学方程式为
溶液,该反应的化学方程式为_______ 。
② 含量与
含量与 表面积、出口处氨含量关系如图所示。
表面积、出口处氨含量关系如图所示。 含量大于
含量大于 ,出口处氨含量下降的原因是
,出口处氨含量下降的原因是_______ 。 可用于储氢。
可用于储氢。
①密闭容器中,其他条件不变,向含有催化剂的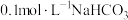 溶液中通入
溶液中通入 ,
, 产率随温度变化如图所示。温度高于
产率随温度变化如图所示。温度高于 ,
, 产率下降的可能原因是
产率下降的可能原因是_______ 。 ,CN是一种碳衍生材料)联合
,CN是一种碳衍生材料)联合 催化剂储氢,可能机理如图所示。氨基能将
催化剂储氢,可能机理如图所示。氨基能将 控制在催化剂表面,其原理是
控制在催化剂表面,其原理是_______ ;用重氢气(D2)代替H2,通过检测是否存在_______ (填化学式)确认反应过程中的加氢方式。
(1)利用铁及其氧化物循环制氢,原理如图所示。反应器Ⅰ中化合价发生改变的元素有
 各1mol的混合气体通过该方法制氢,理论上可获得
各1mol的混合气体通过该方法制氢,理论上可获得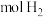 。
。
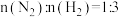 混合匀速通入合成塔,发生反应
混合匀速通入合成塔,发生反应 。海绵状的
。海绵状的 作催化剂,多孔
作催化剂,多孔 作为
作为 的“骨架”和气体吸附剂。
的“骨架”和气体吸附剂。①
 中含有CO会使催化剂中毒。
中含有CO会使催化剂中毒。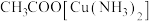 和氨水的混合溶液能吸收CO生成
和氨水的混合溶液能吸收CO生成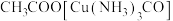 溶液,该反应的化学方程式为
溶液,该反应的化学方程式为②
 含量与
含量与 表面积、出口处氨含量关系如图所示。
表面积、出口处氨含量关系如图所示。 含量大于
含量大于 ,出口处氨含量下降的原因是
,出口处氨含量下降的原因是
 可用于储氢。
可用于储氢。①密闭容器中,其他条件不变,向含有催化剂的
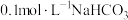 溶液中通入
溶液中通入 ,
, 产率随温度变化如图所示。温度高于
产率随温度变化如图所示。温度高于 ,
, 产率下降的可能原因是
产率下降的可能原因是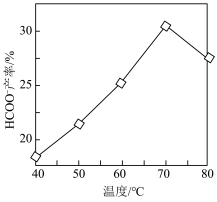
 ,CN是一种碳衍生材料)联合
,CN是一种碳衍生材料)联合 催化剂储氢,可能机理如图所示。氨基能将
催化剂储氢,可能机理如图所示。氨基能将 控制在催化剂表面,其原理是
控制在催化剂表面,其原理是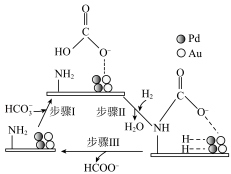
您最近一年使用:0次
真题
解题方法
9 . 氯气是一种重要的基础化工原料,广泛应用于含氯化工产品的生产。硫酰氯及1,4-二(氯甲基)苯等可通过氯化反应制备。
(1)硫酰氯常用作氯化剂和氯磺化剂,工业上制备原理如下: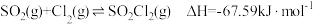 。
。
①若正反应的活化能为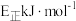 ,则逆反应的活化能
,则逆反应的活化能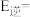
_______  (用含
(用含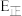 正的代数式表示)。
正的代数式表示)。
②恒容密闭容器中按不同进料比充入 和其
和其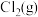 ,测定
,测定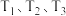 温度下体系达平衡时的
温度下体系达平衡时的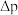 (
(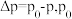 为体系初始压强,
为体系初始压强,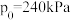 ,P为体系平衡压强),结果如图。
,P为体系平衡压强),结果如图。_______ ,判断依据为_______ 。M点 的转化率为
的转化率为_______ , 温度下用分压表示的平衡常数
温度下用分压表示的平衡常数
_______  。
。
③下图曲线中能准确表示 温度下
温度下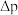 随进料比变化的是
随进料比变化的是_______ (填序号)。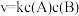 ,其中
,其中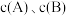 分别为各反应中对应反应物的浓度,k为速率常数(
分别为各反应中对应反应物的浓度,k为速率常数(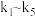 分别对应反应①~⑤)。某温度下,反应器中加入一定量的X,保持体系中氯气浓度恒定(反应体系体积变化忽略不计),测定不同时刻相关物质的浓度。已知该温度下,
分别对应反应①~⑤)。某温度下,反应器中加入一定量的X,保持体系中氯气浓度恒定(反应体系体积变化忽略不计),测定不同时刻相关物质的浓度。已知该温度下,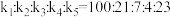 。
。
① 时,
时,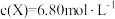 ,且
,且 内
内 ,反应进行到
,反应进行到 时,
时,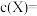
_______  。
。
② 时,
时,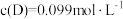 ,若
,若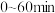 产物T的含量可忽略不计,则此时
产物T的含量可忽略不计,则此时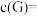
_______ 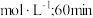 后,随T的含量增加,
后,随T的含量增加,
_______ (填“增大”“减小”或“不变”)。
(1)硫酰氯常用作氯化剂和氯磺化剂,工业上制备原理如下:
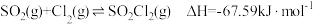 。
。①若正反应的活化能为
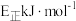 ,则逆反应的活化能
,则逆反应的活化能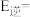
 (用含
(用含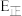 正的代数式表示)。
正的代数式表示)。②恒容密闭容器中按不同进料比充入
 和其
和其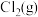 ,测定
,测定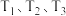 温度下体系达平衡时的
温度下体系达平衡时的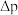 (
(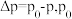 为体系初始压强,
为体系初始压强,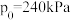 ,P为体系平衡压强),结果如图。
,P为体系平衡压强),结果如图。
 的转化率为
的转化率为 温度下用分压表示的平衡常数
温度下用分压表示的平衡常数
 。
。③下图曲线中能准确表示
 温度下
温度下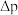 随进料比变化的是
随进料比变化的是

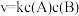 ,其中
,其中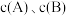 分别为各反应中对应反应物的浓度,k为速率常数(
分别为各反应中对应反应物的浓度,k为速率常数(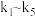 分别对应反应①~⑤)。某温度下,反应器中加入一定量的X,保持体系中氯气浓度恒定(反应体系体积变化忽略不计),测定不同时刻相关物质的浓度。已知该温度下,
分别对应反应①~⑤)。某温度下,反应器中加入一定量的X,保持体系中氯气浓度恒定(反应体系体积变化忽略不计),测定不同时刻相关物质的浓度。已知该温度下,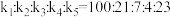 。
。①
 时,
时,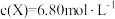 ,且
,且 内
内 ,反应进行到
,反应进行到 时,
时,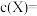
 。
。②
 时,
时,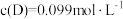 ,若
,若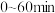 产物T的含量可忽略不计,则此时
产物T的含量可忽略不计,则此时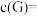
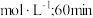 后,随T的含量增加,
后,随T的含量增加,
您最近一年使用:0次
真题
10 . 回收磁性合金钕铁硼( )可制备半导体材料铁酸铋和光学材料氧化钕。
)可制备半导体材料铁酸铋和光学材料氧化钕。
(1)钕铁硼在空气中焙烧转化为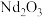 、
、 等(忽略硼的化合物),用
等(忽略硼的化合物),用 盐酸酸浸后过滤得到
盐酸酸浸后过滤得到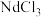 溶液和含铁滤渣。Nd、Fe浸出率(
溶液和含铁滤渣。Nd、Fe浸出率( )随浸取时间变化如图所示。
)随浸取时间变化如图所示。_______ (填化学式)。
②浸出初期Fe浸出率先上升后下降的原因是_______ 。
(2)含铁滤渣用硫酸溶解,经萃取、反萃取提纯后,用于制备铁酸铋。
①用含有机胺(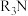 )的有机溶剂作为萃取剂提纯一定浓度的
)的有机溶剂作为萃取剂提纯一定浓度的 溶液,原理为:
溶液,原理为:
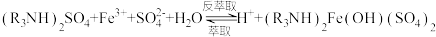 (有机层)
(有机层)
已知:
其他条件不变,水层初始pH在0.2~0.8范围内,随水层pH增大,有机层中Fe元素含量迅速增多的原因是_______ 。
②反萃取后, 经转化可得到铁酸铋。铁酸铋晶胞如图所示(图中有4个Fe原子位于晶胞体对角线上,O原子未画出),其中原子数目比
经转化可得到铁酸铋。铁酸铋晶胞如图所示(图中有4个Fe原子位于晶胞体对角线上,O原子未画出),其中原子数目比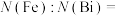
_______ 。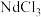 溶液通过沉钕、焙烧得到
溶液通过沉钕、焙烧得到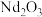 。
。
①向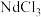 溶液中加入
溶液中加入 溶液,
溶液,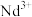 可转化为
可转化为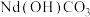 沉淀。该反应的离子方程式为
沉淀。该反应的离子方程式为_______ 。
②将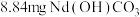 (摩尔质量为
(摩尔质量为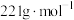 )在氮气氛围中焙烧,剩余固体质量随温度变化曲线如图所示。
)在氮气氛围中焙烧,剩余固体质量随温度变化曲线如图所示。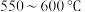 时,所得固体产物可表示为
时,所得固体产物可表示为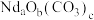 ,通过以上实验数据确定该产物中
,通过以上实验数据确定该产物中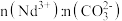 的比值
的比值_______ (写出计算过程)。
 )可制备半导体材料铁酸铋和光学材料氧化钕。
)可制备半导体材料铁酸铋和光学材料氧化钕。(1)钕铁硼在空气中焙烧转化为
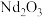 、
、 等(忽略硼的化合物),用
等(忽略硼的化合物),用 盐酸酸浸后过滤得到
盐酸酸浸后过滤得到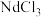 溶液和含铁滤渣。Nd、Fe浸出率(
溶液和含铁滤渣。Nd、Fe浸出率( )随浸取时间变化如图所示。
)随浸取时间变化如图所示。
②浸出初期Fe浸出率先上升后下降的原因是
(2)含铁滤渣用硫酸溶解,经萃取、反萃取提纯后,用于制备铁酸铋。
①用含有机胺(
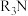 )的有机溶剂作为萃取剂提纯一定浓度的
)的有机溶剂作为萃取剂提纯一定浓度的 溶液,原理为:
溶液,原理为: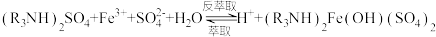 (有机层)
(有机层)已知:

其他条件不变,水层初始pH在0.2~0.8范围内,随水层pH增大,有机层中Fe元素含量迅速增多的原因是
②反萃取后,
 经转化可得到铁酸铋。铁酸铋晶胞如图所示(图中有4个Fe原子位于晶胞体对角线上,O原子未画出),其中原子数目比
经转化可得到铁酸铋。铁酸铋晶胞如图所示(图中有4个Fe原子位于晶胞体对角线上,O原子未画出),其中原子数目比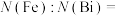

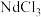 溶液通过沉钕、焙烧得到
溶液通过沉钕、焙烧得到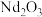 。
。①向
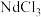 溶液中加入
溶液中加入 溶液,
溶液,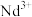 可转化为
可转化为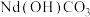 沉淀。该反应的离子方程式为
沉淀。该反应的离子方程式为②将
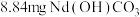 (摩尔质量为
(摩尔质量为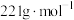 )在氮气氛围中焙烧,剩余固体质量随温度变化曲线如图所示。
)在氮气氛围中焙烧,剩余固体质量随温度变化曲线如图所示。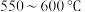 时,所得固体产物可表示为
时,所得固体产物可表示为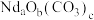 ,通过以上实验数据确定该产物中
,通过以上实验数据确定该产物中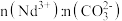 的比值
的比值
您最近一年使用:0次



