名校
解题方法
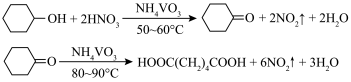
1 . 1,6己二酸是常用的化工原料,在高分子材料、医药、润滑剂的制造等方面都有重要作用。实验室利用图中的装置(夹持装置已省略),以环己醇和硝酸为反应物制备1,6己二酸。反应原理为:
实验步骤如下:
Ⅰ.向三颈烧瓶中加入0.03 g NH4VO3固体和18 mL浓HNO3(略过量),向恒压滴液漏斗中加入6 mL环己醇
Ⅱ.将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇。调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60 ℃之间,直至环己醇全部滴加完毕
Ⅲ.将三颈烧瓶放入80~90 ℃水浴中加热10 min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100 mL烧杯中,冷却至室温后,有白色晶体析出,减压过滤,___________,干燥,得到粗产品
Ⅳ.1,6-己二酸粗产品的提纯
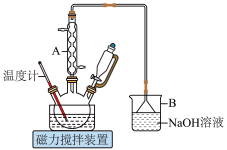
(1)仪器A的名称为___________ ,其作用是___________ 。
(2)B中发生反应的离子方程式为___________ (其中一种产物为亚硝酸盐)
(3)若步骤Ⅱ中控制水浴温度不当,未滴加环己醇前就会观察到红棕色气体生成,原因为___________ ,滴加环己醇的过程中,若温度过高,可用冷水浴冷却维持50~60 ℃,说明该反应的ΔH___________ 0(填“>”或“<”)。
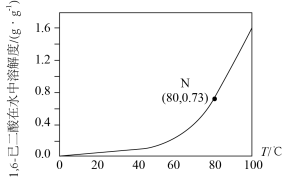
(4)将步骤Ⅲ补充完整:___________ 。步骤Ⅳ提纯方法的名称为___________ 。如图为1,6己二酸在水中的溶解度曲线,80 ℃时1,6-己二酸水溶液的密度为ρ g·mL-1;该溶液的物质的量浓度为___________ 。
| 试剂 | 相对分子质量 | 密度/(g·mL-1) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 环己醇 | 100 | 0.962 | 25.9 | 161.8 | 可溶于水、乙醇、乙醚 |
| 1,6-己二酸 | 146 | 1.360 | 152 | 330.5 | 微溶于冷水,易溶于乙醇 |
| NH4VO3 | 117 | 2.326 | 210(分解) | — | 微溶于冷水,易溶于热水 |
Ⅰ.向三颈烧瓶中加入0.03 g NH4VO3固体和18 mL浓HNO3(略过量),向恒压滴液漏斗中加入6 mL环己醇
Ⅱ.将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇。调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60 ℃之间,直至环己醇全部滴加完毕
Ⅲ.将三颈烧瓶放入80~90 ℃水浴中加热10 min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100 mL烧杯中,冷却至室温后,有白色晶体析出,减压过滤,___________,干燥,得到粗产品
Ⅳ.1,6-己二酸粗产品的提纯
(1)仪器A的名称为
(2)B中发生反应的离子方程式为
(3)若步骤Ⅱ中控制水浴温度不当,未滴加环己醇前就会观察到红棕色气体生成,原因为
(4)将步骤Ⅲ补充完整:
| A.46.07% | B.57.08% | C.63.03% | D.74.61% |
您最近一年使用:0次
2024-02-29更新
|
360次组卷
|
8卷引用:3.5.2 有机合成路线的设计与实施-2021-2022学年高二化学课后培优练(人教版2019选择性必修3)
(已下线)3.5.2 有机合成路线的设计与实施-2021-2022学年高二化学课后培优练(人教版2019选择性必修3)东北三省三校(哈师大附中、东北师大附中、辽宁省实验中学)2021届高三第一次联合模拟考试(3月)理综化学试题(已下线)重点7 化学实验综合题-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)05 以分离提纯为主线的有机制备类综合实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型三 以分离提纯为主的有机制备类实验-备战2024年高考化学答题技巧与模板构建河南省南阳市邓州市第六高级中学校2023-2024学年高二下学期开学测试化学试题四川省成都市第七中学林荫校区2023-2024学年高三下学期4月月考理科综合试卷-高中化学
名校
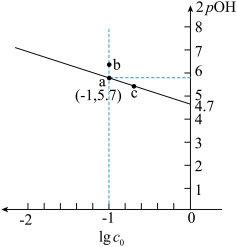
2 . 在 溶液中存在水解平衡:
溶液中存在水解平衡: ,水解常数
,水解常数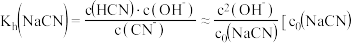 是
是 溶液的起始浓度]。
溶液的起始浓度]。 时,向
时,向 的
的 溶液中不断加水稀释,
溶液中不断加水稀释, 溶液浓度的对数值
溶液浓度的对数值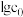 ,与
,与 的关系如图所示,下列说法错误的是
的关系如图所示,下列说法错误的是
 溶液中存在水解平衡:
溶液中存在水解平衡: ,水解常数
,水解常数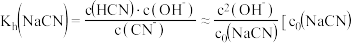 是
是 溶液的起始浓度]。
溶液的起始浓度]。 时,向
时,向 的
的 溶液中不断加水稀释,
溶液中不断加水稀释, 溶液浓度的对数值
溶液浓度的对数值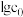 ,与
,与 的关系如图所示,下列说法错误的是
的关系如图所示,下列说法错误的是
A. 时, 时,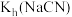 为 为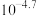 |
| B.升高温度,可使曲线上a点变到b点 |
C. ,向a点对应的溶液中加入固体 ,向a点对应的溶液中加入固体 , , 的水解程度减小 的水解程度减小 |
D.c点对应溶液中的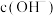 大于a点 大于a点 |
您最近一年使用:0次
2023-02-12更新
|
150次组卷
|
8卷引用:3.3.2 影响盐类的水解的主要因素-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
(已下线)3.3.2 影响盐类的水解的主要因素-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)湖北省新高考2021-2022学年高三下学期3月质量检测巩固化学试题(已下线)三轮冲刺卷3-【赢在高考黄金20卷】备战2022年高考化学模拟卷(湖北专用)山东省潍坊市2018届高三下学期一模考试理综化学试题河北省唐山市第一中学2019届高三下学期冲刺(五)(仿真模拟)理科综合化学试题河南省南阳市油田第一中学2021届高三五调考试化学试题(已下线)第八章 水溶液中的离子反应与平衡 第49练 盐类的水解河北省承德市隆化存瑞中学2023-2024学年高二上学期第一次质检化学试题
名校
解题方法
3 . 已知MgO、MgCl2的熔点分别为2800 ℃、714 ℃,将MgO、MgCl2加热熔融后通电电解,都可得到金属镁。海水中含有MgCl2,工业上从海水中提取镁,正确的方法是
A.海水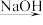 Mg(OH)2 Mg(OH)2 Mg Mg |
B.海水 MgCl2溶液 MgCl2溶液 MgCl2(熔融) MgCl2(熔融)  Mg Mg |
C.海水 Mg(OH)2 Mg(OH)2 MgO MgO Mg Mg |
D.海水 Mg(OH)2 Mg(OH)2 MgCl2溶液 MgCl2溶液 MgCl2(熔融) MgCl2(熔融) Mg Mg |
您最近一年使用:0次
2022-12-02更新
|
435次组卷
|
5卷引用:课中-8.1.1 金属矿物 海水资源的开发利用-人教2019必修第二册
课中-8.1.1 金属矿物 海水资源的开发利用-人教2019必修第二册四川省成都市蒲江县蒲江中学2020-2021学年高二上学期开学考试化学试题(已下线)8.1.2 海水资源的开发利用(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)天津市实验中学滨海学校黄南民族班2021-2022学年高三上学期期中质量监测化学试题黑龙江省勃利县高级中学2022-2023学年高一下学期5月月考化学试题
14-15高二上·湖北荆州·期末
名校
解题方法
4 . NH4Al(SO4)2常作食品加工中的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是_______ (用离子方程式说明)。
(2)相同条件下,0.1mol∙L-1NH4Al(SO4)2溶液中的c( )
)_______ (填“等于”“大于”或“小于”)0.1mol∙L-1NH4HSO4溶液中的c( )。
)。
(3)几种均为0.1mol∙L-1的电解质溶液的pH随温度变化的曲线如图所示。
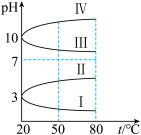
①其中符合0.1mol∙L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是_______ (填罗马数字),导致NH4Al(SO4)2溶液的pH随温度变化的原因是_______ 。
②20℃时,0.1mol∙L-1NH4Al(SO4)2溶液中2c c
c 3cAl3=
3cAl3=_______ molL1。
(4)室温时,向100mL0.1mol∙L-1NH4HSO4溶液中滴加0.1mol∙L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图乙所示。

试分析图中a、b、c、d四个点,水的电离程度最大的是_______ 点;在b点,溶液中各离子浓度由大到小的排列顺序是_______ 。
(1)NH4Al(SO4)2可作净水剂,其原理是
(2)相同条件下,0.1mol∙L-1NH4Al(SO4)2溶液中的c(
 )
) )。
)。(3)几种均为0.1mol∙L-1的电解质溶液的pH随温度变化的曲线如图所示。

①其中符合0.1mol∙L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是
②20℃时,0.1mol∙L-1NH4Al(SO4)2溶液中2c
 c
c 3cAl3=
3cAl3=(4)室温时,向100mL0.1mol∙L-1NH4HSO4溶液中滴加0.1mol∙L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图乙所示。

试分析图中a、b、c、d四个点,水的电离程度最大的是
您最近一年使用:0次
2022-12-01更新
|
1393次组卷
|
57卷引用:3.3.2 影响盐类的水解的主要因素-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
(已下线)3.3.2 影响盐类的水解的主要因素-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时3 水解平衡的移动和水解原理的应用高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 课时2 盐类水解的影响因素及应用(已下线)3.3.2 影响盐类水解的主要因素和盐类水解的应用(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)选择性必修1 专题3 第三单元 课时2 盐类水解的影响因素及应用(已下线)章末培优3 专题3 水溶液中的离子反应-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)(已下线)3.3.3 盐类水解的应用-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)3.3.2 影响盐类水解的主要因素-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第15练 反应原理综合-2022年【寒假分层作业】高二化学(人教版2019选择性必修2)四川省资阳中学2021-2022学年高二下学期3月月考化学试题(已下线)第20讲 盐类水解的影响因素及应用(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)上海市卢湾高级中学2022-2023学年高三上学期期中考试化学试题上海市卢湾高级中学2022-2023学年高三上学期期中考试化学试题(已下线)专题十三水溶液中的离子平衡四川省成都市树德中学2022-2023学年高二上学期期末考试化学试题广东省广州市华南师范大学附属中学2022-2023学年高二上学期12月月考化学试题(已下线)2013-2014学年湖北省荆州市部分县市高二上学期期末考试化学试卷(已下线)2014届山西省山大附中高三下学期第一次月考化学试卷2016-2017学年内蒙古包头九中高二上10月月考化学卷2016-2017学年四川省成都七中高二上11月考试化学卷2015—2016学年河南省郑州一中高二上学期期末考试化学试卷湖南省临武一中、嘉禾一中2017-2018学年高二12月联考化学试题河北省永年县第二中学2017-2018学年高二12月月考化学试题宁夏育才中学2017-2018学年高二上学期期末考试化学试题湖北省宜昌市第一中学2017-2018学年高二上学期期末考试化学试题高二人教版选修4 期末学业测评(一)山东省济宁市实验中学2018-2019学年高二上学期第二次月考化学试题(已下线)2019年1月5日 《每日一题》人教选修4-周末培优吉林省松原市扶余市第一中学2018-2019学年高二上学期期末考试化学试题【全国百强校】江苏省扬州中学2018-2019学年高二第二学期五月检测化学试题(已下线)2019年10月13日《每日一题》2020年高考一轮复习——每周一测四川省武胜烈面中学校2019-2020学年高二上学期期中考试化学试题苏教版选修四化学反应原理专题3第三单元 盐类的水解 同步检测试卷(已下线)考点14 化学基本理论——《备战2020年高考精选考点专项突破题集》(已下线)2019年12月30日 《每日一题》人教版(选修4)——盐类水解的影响因素河北省沧州市泊头市第一中学2019-2020学年高二上学期第三次月考化学试题山东省淄博市2019-2020学年高二上学期期中考试化学试题四川省成都市射洪县2018-2019学年高二下学期期末能力素质监测理综化学试题(英才班)山西省晋中市祁县中学校2019-2020学年高二11月月考化学试题河南省南阳市第一中学2021届高三上学期第二次月考(9月)化学试题(已下线)第3章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)浙江省苍南县金乡卫城中学2020-2021学年高二上学期第一次月考化学试题湖北省黄石市有色第一中学2020-2021学年高二上学期期末考试化学试题江苏省南通市海门实验学校2020-2021学年高二上学期期中考试化学试题福建省莆田锦江中学2020-2021学年高二上学期期末考试化学试题(已下线)第25讲 盐类水解(精练)-2022年高考化学一轮复习讲练测安徽省皖南八校2022届高三上学期摸底联考化学试题(已下线)3.3.1 盐类的水解-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)第23讲 盐类水解(练) — 2022年高考化学一轮复习讲练测(新教材新高考)辽宁省渤海大学附属高级中学2021-2022学年高二上学期期中考试化学试题山西省运城市教育发展联盟2021-2022学年高二上学期11月期中检测化学试题四川省宜宾市第四中学校2022-2023学年高二下学期开学考试化学试题(已下线)第八章 水溶液中的离子反应与平衡 第49练 盐类的水解(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)盐类的水解黑龙江省大庆铁人中学2023-2024学年高二上学期期中考试化学试题山西省朔州市怀仁县阳高一中2023-2024学年高二上学期11月化学试卷
22-23高二上·全国·课时练习
名校
解题方法
5 . 反应aA(g)+bB(g) cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
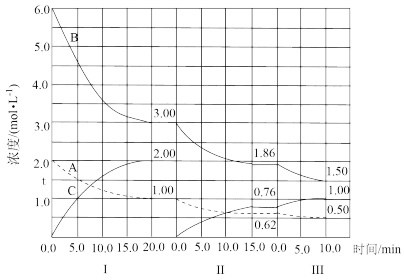
问题:
(1)反应的化学方程式中a∶b∶c为____ 。
(2)A的平均反应速率vI(A)、vII(A)、vIII(A)从大到小排列次序为____ 。
(3)B的平衡转化率αI(B)、αII(B)、αIII(B)中最小的是____ ,其值是____ 。
(4)由第一次平衡到第二次平衡,平衡向____ 移动,采取的措施是____ 。
(5)比较第II阶段反应温度(T2)和第III阶段反应温度(T3)的高低;T2____ T3(填“<”“>”“=”),判断的理由是____ 。
 cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
问题:
(1)反应的化学方程式中a∶b∶c为
(2)A的平均反应速率vI(A)、vII(A)、vIII(A)从大到小排列次序为
(3)B的平衡转化率αI(B)、αII(B)、αIII(B)中最小的是
(4)由第一次平衡到第二次平衡,平衡向
(5)比较第II阶段反应温度(T2)和第III阶段反应温度(T3)的高低;T2
您最近一年使用:0次
2022-10-18更新
|
1095次组卷
|
4卷引用:2.2.3 化学反应速率和化学平衡图像——同步学习必备知识
(已下线)2.2.3 化学反应速率和化学平衡图像——同步学习必备知识内蒙古包钢第一中学2022-2023学年高二上学期月考化学试题江西省赣州市十校协作2022-2023学年高二上学期期中联考化学试题河南省郑州中学2023-2024学年高三上学期第二次月考化学试题
22-23高二上·全国·课时练习
解题方法
6 . 在密闭容器中,对于反应N2(g)+3H2(g) 2NH3,N2和H2起始的量分别为2mol和6mol,达到平衡时H2的转化率30%。若从氨气开始进行化学反应,在相同条件下欲使平衡时各成分的含量与前者相同,则起始时NH3物质的量和NH3的转化率分别是
2NH3,N2和H2起始的量分别为2mol和6mol,达到平衡时H2的转化率30%。若从氨气开始进行化学反应,在相同条件下欲使平衡时各成分的含量与前者相同,则起始时NH3物质的量和NH3的转化率分别是
 2NH3,N2和H2起始的量分别为2mol和6mol,达到平衡时H2的转化率30%。若从氨气开始进行化学反应,在相同条件下欲使平衡时各成分的含量与前者相同,则起始时NH3物质的量和NH3的转化率分别是
2NH3,N2和H2起始的量分别为2mol和6mol,达到平衡时H2的转化率30%。若从氨气开始进行化学反应,在相同条件下欲使平衡时各成分的含量与前者相同,则起始时NH3物质的量和NH3的转化率分别是| A.3mol和70% | B.2mol和80% | C.2mol和70% | D.4mol和80% |
您最近一年使用:0次
名校
解题方法
7 . 电化学反应原理的实验装置如图所示。下列叙述错误的是
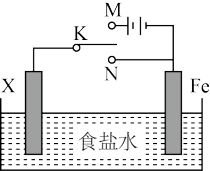

| A.若X为碳棒,开关K置于M处可减缓铁的腐蚀 |
| B.若X为锌棒,开关K置于M或N处都可减缓铁的腐蚀 |
| C.若X为锌棒,开关K置于N处时,为牺牲阳极的阴极保护法 |
| D.若X为碳棒,开关K置于N处时,X电极上发生的反应为2H+ +2e-=H2↑ |
您最近一年使用:0次
2022-09-06更新
|
927次组卷
|
16卷引用:第三节 金属的腐蚀与防护
第三节 金属的腐蚀与防护(已下线)4.3 金属的腐蚀与防护-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)(已下线)4.3.2 金属(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)的防护云南省玉溪第三中学2021-2022学年高二下学期3月入学考试化学试题河南省濮阳市2021-2022学年高二上学期期末学业质量监测化学试题云南省曲靖市马龙区第一中学2021-2022学年高二下学期3月考试化学试题黑龙江省哈尔滨市宾县第二中学2021-2022学年高二上学期期末考试化学试题新疆柯坪县柯坪湖州国庆中学2021-2022学年高二3月月考化学试题山东省章丘市第一中学2020-2021学年高二上学期9月月考化学试题内蒙古通辽市开鲁县第一中学2020-2021学年高二上学期期中考试化学试题河北省迁安市第一中学2020-2021学年高二上学期期中考试化学试题安徽省六安市城南中学2021届高三上学期第三次月考化学试题山东省济南德润高级中学2021-2022学年高二上学期10月月考化学试题河北省保定市博野中学2021-2022学年高二上学期12月月考化学试题浙江省宁波市余姚中学2020-2021学年高二上学期期中考试化学试题河北省唐山市第二中学2022-2023学年高二上学期期末考试化学试题
2009·辽宁抚顺·二模
名校
解题方法
8 . 将Cu片放入0.1mol/LFeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为
| A.3:2 | B.3:5 | C.4:3 | D.3:4 |
您最近一年使用:0次
2022-09-06更新
|
1655次组卷
|
49卷引用:3.2.2物质的量在化学方程式中的计算-同步学习必备知识
(已下线)3.2.2物质的量在化学方程式中的计算-同步学习必备知识人教版(2019)高一必修第一册第三章 铁 金属材料 第一节 铁及其化合物 课时2 铁盐、亚铁盐鲁科版(2019)高一必修第一册第三章第1节 铁的多样性 课时2 铁及其化合物之间的转化关系高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 教材帮(已下线)3.2.3 铁的重要化合物(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)甘肃省武威第七中学2022-2023学年高三上学期第一次质量检测化学试题辽宁省铁岭市昌图县第一高级中学2022-2023学年高一上学期12月化学试题陕西省咸阳市2022-2023学年高一上学期期末考试化学试题(已下线)辽宁省抚顺市六校联合体2009—2010学年度高三二模(理综)试题化学部分(已下线)2010年杭州市西湖高级中学高三上学期开学考试化学试题(已下线)2011-2012学年广东省中山市高一上学期期末统一考试化学试卷(已下线)2011-2012学年黑龙江哈六中高一上学期期末考试化学试卷(已下线)2013届山西省长治二中高三上学期第一次练考化学试卷(已下线)2013届福建安溪一中、养正中学高三上学期期中联考化学试卷(已下线)2012-2013学年吉林省长春二中高一上学期期末考试化学试卷(已下线)2012-2013学年陕西省西安市高陵县第三中学高一第三次月考化学试卷(已下线)2012-2013学年广东省深圳科学高中高一第一学期期末考试化学试卷B(已下线)2013-2014学年河北冀州中学高一上学期第四次月考化学试卷2015-2016学年湖北省汉川市高一上学期期末考试化学试卷2015-2016学年黑龙江省海林林业局一中高一上学期期末化学试卷2016-2017学年河北省张家口第一中学高一(普通班、实验班)下学期开学检测化学试卷河北省辛集中学2017-2018学年高一上学期12月月考化学试题宁夏银川一中2017-2018学年高一上学期期末考试化学试题黑龙江省伊春中学2017-2018学年高一化学上学期期末考试题北京四中2017-2018学年高一上学期期末考试化学试题【全国百强校】浙江省嘉兴市第一中学2017-2018学年高一下学期期中考试化学试题陕西省汉中市汉中中学2019届高三上学期第二次月考化学试题【全国百强校】河北省石家庄市辛集中学2018-2019学年高一上学期第二次月考化学试题湖南省双峰县第七中学2018-2019学年高一第一学期第三次月考化学试题吉林省扶余市第一中学2018-2019学年高一上学期期末考试化学试题宁夏回族自治区青铜峡市高级中学2018-2019学年高一上学期期末考试化学试题【全国百强校】北京市第四中学2018-2019学年高一上学期期末考试化学试题【全国百强校】河北省张家口市第一中学2018-2019学年高一下学期开学考试化学试题江西省南城县第二中学2018-2019学年高一12月月考化学试题黑龙江省安达市第七中学2019-2020学年高一上学期月考化学试题鲁教版高中化学必修1第四章《材料家族中的元素》测试卷2(已下线)【新东方】2020-80.湖北省武汉外国语学校2019-2020学年高一上学期期末考试化学试题河南省长葛市第一高级中学2020-2021学年高一上学期阶段性测试试卷化学试题(已下线)第三章 金属及其化合物(能力提升)-2020-2021学年高一化学单元测试定心卷(人教版必修1)河南省豫西名校2020-2021学年高一上学期第二次联考化学试题四川宜宾屏山县中学校2020-2021学年高一下学期第一次月考化学试题河北省石家庄二中2019-2020学年高一上学期期末考试化学试题河北省邯郸市大名县第一中学2020-2021学年高一下学期5月月考化学试题(已下线)微专题13 亚铁离子、三价铁离子的性质及检验-备战2022年高考化学考点微专题上海市杨浦高级中学2020-2021学年高二上学期第一次月考化学试题甘肃天祝藏族自治县第一中学2022-2023学年高一上学期期末考试化学试题湖南省邵阳市第二中学2023-2024学年高二上学期基础知识竞赛化学试题山东省聊城市临清市第一中学2023-2024学年高一上学期期末模拟考试化学试题
22-23高一上·全国·课时练习
名校
9 . 向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol·L-1Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是
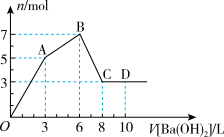

| A.图中C点铝元素存在形式是[Al(OH)4]- |
| B.向D点溶液中通入CO2气体,立即产生白色沉淀 |
| C.原混合溶液中c[Al2(SO4)3]:c(AlCl3)=1:2 |
D.OA段反应的离子方程式为2Al3++3 +3Ba2++8OH-=2[Al(OH)4]-+3BaSO4↓ +3Ba2++8OH-=2[Al(OH)4]-+3BaSO4↓ |
您最近一年使用:0次
2022-09-06更新
|
1719次组卷
|
4卷引用:3.2.2物质的量在化学方程式中的计算-同步学习必备知识
(已下线)3.2.2物质的量在化学方程式中的计算-同步学习必备知识山东省泰安一中老校区(新泰中学)2022-2023学年高三上学期第一次月考化学试题河南省信阳高级中学2022-2023学年高二下学期6月月考化学试题江西省宜春市宜丰中学2022-2023学年高二下学期开学考试化学试题
名校
解题方法
10 . 利用 合成二甲醚可以很大程度地帮助实现“碳中和”,其合成过程由两种工艺组成。
合成二甲醚可以很大程度地帮助实现“碳中和”,其合成过程由两种工艺组成。
工艺1:先在设备一加氢合成甲醇,主要涉及以下反应:
Ⅰ、甲醇的合成: ;
;
Ⅱ、逆水汽变换: ;
;
再通过设备二合成二甲醚,涉及以下反应:
Ⅲ、甲醇脱水: 。
。
工艺2:在双功能催化剂作用下,由 加氢直接得到二甲醚。
加氢直接得到二甲醚。
已知:相关物质变化的焓变示意图如下:

回答下列问题:
(1)请写出工艺2中 直接加氢合成
直接加氢合成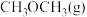 (反应Ⅳ)的热化学方程式:
(反应Ⅳ)的热化学方程式:___________ 。
(2)①工艺1需先在设备一合成甲醇。在不同压强下,按照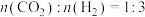 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如图所示。
的平衡产率随温度的变化关系如图所示。


下列说法正确的是___________ (填字母)。
A.图甲纵坐标表示 的平衡产率
的平衡产率
B.压强: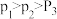
C.为了同时提高 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温、高压的反应条件
的平衡产率,应选择低温、高压的反应条件
D.一定温度、压强下,寻找活性更高的催化剂,是提高 的平衡转化率的主要研究方向
的平衡转化率的主要研究方向
②解释图乙不同压强下纵坐标代表的物理量在550℃后趋于相等的原因:___________ 。
(3)若一定量 和
和 仅发生反应Ⅰ和Ⅱ,研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性。使用该催化剂,按
仅发生反应Ⅰ和Ⅱ,研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性。使用该催化剂,按 (总量为a
(总量为a )投料于恒容密闭容器中进行反应,
)投料于恒容密闭容器中进行反应, 的平衡转化率和甲醇的选择性(甲醇的选择性:转化的
的平衡转化率和甲醇的选择性(甲醇的选择性:转化的 中生成甲醇的物质的量分数)随温度的变化趋势如图所示(忽略温度对催化剂的影响)。
中生成甲醇的物质的量分数)随温度的变化趋势如图所示(忽略温度对催化剂的影响)。

①根据图中数据,温度选择___________ K(填“473”“513”或“553”),达到平衡时,反应体系内甲醇的产量最高。
②随着温度的升高, 的平衡转化率增加但甲醇的选择性降低,请分析其原因:
的平衡转化率增加但甲醇的选择性降低,请分析其原因:___________ 。
 合成二甲醚可以很大程度地帮助实现“碳中和”,其合成过程由两种工艺组成。
合成二甲醚可以很大程度地帮助实现“碳中和”,其合成过程由两种工艺组成。工艺1:先在设备一加氢合成甲醇,主要涉及以下反应:
Ⅰ、甲醇的合成:
 ;
;Ⅱ、逆水汽变换:
 ;
;再通过设备二合成二甲醚,涉及以下反应:
Ⅲ、甲醇脱水:
 。
。工艺2:在双功能催化剂作用下,由
 加氢直接得到二甲醚。
加氢直接得到二甲醚。已知:相关物质变化的焓变示意图如下:

回答下列问题:
(1)请写出工艺2中
 直接加氢合成
直接加氢合成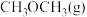 (反应Ⅳ)的热化学方程式:
(反应Ⅳ)的热化学方程式:(2)①工艺1需先在设备一合成甲醇。在不同压强下,按照
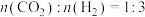 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如图所示。
的平衡产率随温度的变化关系如图所示。

下列说法正确的是
A.图甲纵坐标表示
 的平衡产率
的平衡产率B.压强:
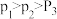
C.为了同时提高
 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温、高压的反应条件
的平衡产率,应选择低温、高压的反应条件D.一定温度、压强下,寻找活性更高的催化剂,是提高
 的平衡转化率的主要研究方向
的平衡转化率的主要研究方向②解释图乙不同压强下纵坐标代表的物理量在550℃后趋于相等的原因:
(3)若一定量
 和
和 仅发生反应Ⅰ和Ⅱ,研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性。使用该催化剂,按
仅发生反应Ⅰ和Ⅱ,研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性。使用该催化剂,按 (总量为a
(总量为a )投料于恒容密闭容器中进行反应,
)投料于恒容密闭容器中进行反应, 的平衡转化率和甲醇的选择性(甲醇的选择性:转化的
的平衡转化率和甲醇的选择性(甲醇的选择性:转化的 中生成甲醇的物质的量分数)随温度的变化趋势如图所示(忽略温度对催化剂的影响)。
中生成甲醇的物质的量分数)随温度的变化趋势如图所示(忽略温度对催化剂的影响)。
①根据图中数据,温度选择
②随着温度的升高,
 的平衡转化率增加但甲醇的选择性降低,请分析其原因:
的平衡转化率增加但甲醇的选择性降低,请分析其原因:
您最近一年使用:0次



