1 . 磷酸氢二铵[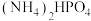 ]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备
]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备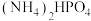 ,装置如图所示(夹持和搅拌装置已省略)。
,装置如图所示(夹持和搅拌装置已省略)。

回答问题:
(1)实验室用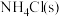 和
和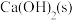 制备氨气的化学方程式为
制备氨气的化学方程式为_______ 。
(2)现有浓 质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的
质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的 溶液,则需浓
溶液,则需浓
_______ mL(保留一位小数)。
(3)装置中活塞 的作用为
的作用为_______ 。实验过程中,当出现_______ 现象时,应及时关闭 ,打开
,打开 。
。
(4)当溶液pH为8.0~9.0时,停止通 ,即可制得
,即可制得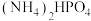 溶液。若继续通入
溶液。若继续通入 ,当
,当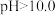 时,溶液中
时,溶液中 、
、_______ 和_______ (填离子符号)浓度明显增加。
(5)若本实验不选用pH传感器,还可选用_______ 作指示剂,当溶液颜色由_______ 变为_______ 时,停止通 。
。
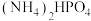 ]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备
]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备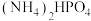 ,装置如图所示(夹持和搅拌装置已省略)。
,装置如图所示(夹持和搅拌装置已省略)。
回答问题:
(1)实验室用
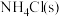 和
和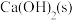 制备氨气的化学方程式为
制备氨气的化学方程式为(2)现有浓
 质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的
质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的 溶液,则需浓
溶液,则需浓
(3)装置中活塞
 的作用为
的作用为 ,打开
,打开 。
。(4)当溶液pH为8.0~9.0时,停止通
 ,即可制得
,即可制得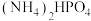 溶液。若继续通入
溶液。若继续通入 ,当
,当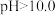 时,溶液中
时,溶液中 、
、(5)若本实验不选用pH传感器,还可选用
 。
。
您最近一年使用:0次
2022-07-04更新
|
8088次组卷
|
21卷引用:2022年海南省高考真题化学试题
2022年海南省高考真题化学试题(已下线)专题16 化学实验综合题-2022年高考真题模拟题分项汇编(已下线)2022年海南省高考真题变式题15-19(已下线)考点51 物质的制备-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第14讲 氮及其化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第12讲 氮及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第27讲 物质的制备与性质实验(练)-2023年高考化学一轮复习讲练测(新教材新高考)福建省厦门集美中学2022-2023学年高三上学期10月月考化学试题(已下线)易错点11 氮元素及其化合物-备战2023年高考化学考试易错题(已下线)专题27 物质制备类综合性实验题(学生版)-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)回归教材重难点11 熟记“五气体”制备实验、“两定量”测定实验-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)第13讲氮及其化合物(已下线)考点16 氮及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)题型一 实验简答题答题规范-备战2024年高考化学答题技巧与模板构建
2 . 某化学小组同学利用一定浓度的H2O2溶液制备O2,再用O2氧化C2H5OH,并检验氧化产物。
Ⅰ.制备O2
该小组同学设计了如下气体发生装置(夹持装置省略)

(1)甲装置中主要仪器的名称为___________ 。
(2)乙装置中,用粘合剂将MnO2制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞K1,经长颈漏斗向试管中缓慢加入3% H2O2溶液至___________ 。欲使反应停止,关闭活塞K1即可,此时装置中的现象是___________ 。
(3)丙装置可用于制备较多O2,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是___________ ,此时可以将铂丝抽离H2O2溶液,还可以采取的安全措施是___________ 。
(4)丙装置的特点是___________ (填序号)。
a.可以控制制备反应的开始和结束
b.可通过调节催化剂与液体接触的面积来控制反应的速率
c.与乙装置相比,产物中的O2含量高、杂质种类少
Ⅱ.氧化C2H5OH
该小组同学设计的氧化C2H5OH的装置如图(夹持装置省略)
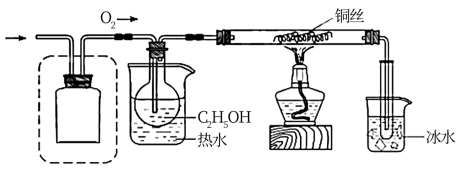
(5)在图中方框内补全干燥装置和干燥剂。___________
Ⅲ.检验产物
(6)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
实验①~③中的结论不合理的是___________ (填序号),原因是___________ 。
Ⅰ.制备O2
该小组同学设计了如下气体发生装置(夹持装置省略)

(1)甲装置中主要仪器的名称为
(2)乙装置中,用粘合剂将MnO2制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞K1,经长颈漏斗向试管中缓慢加入3% H2O2溶液至
(3)丙装置可用于制备较多O2,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是
(4)丙装置的特点是
a.可以控制制备反应的开始和结束
b.可通过调节催化剂与液体接触的面积来控制反应的速率
c.与乙装置相比,产物中的O2含量高、杂质种类少
Ⅱ.氧化C2H5OH
该小组同学设计的氧化C2H5OH的装置如图(夹持装置省略)

(5)在图中方框内补全干燥装置和干燥剂。
Ⅲ.检验产物
(6)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
| 实验序号 | 检验试剂和反应条件 | 现象 | 结论 |
| ① | 酸性KMnO4溶液 | 紫红色褪去 | 产物含有乙醛 |
| ② | 新制Cu(OH)2,加热 | 生成砖红色沉淀 | 产物含有乙醛 |
| ③ | 微红色含酚酞的NaOH溶液 | 微红色褪去 | 产物可能含有乙酸 |
您最近一年使用:0次
2021-09-07更新
|
8705次组卷
|
14卷引用:2021年新高考天津化学高考真题
2021年新高考天津化学高考真题2021年天津高考化学试题变式题13-16(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题10 化学实验综合—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点10 综合实验方案的设计与评价-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)微专题44 以气体制备为主体的实验-备战2023年高考化学一轮复习考点微专题(已下线)专题28 性质探究类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型182 综合实验突破天津市南开中学2022-2023学年高三下学期第四次月考化学试题(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)微专题 仪器的组合与创新使用
真题
解题方法
3 . 某兴趣小组在定量分析了镁渣[含有MgCO3、Mg(OH)2、CaCO3、Al2O3、Fe2O3和SiO2]中Mg含量的基础上,按如下流程制备六水合氯化镁(MgCl2·6H2O)。

相关信息如下:
①700℃只发生MgCO3和Mg(OH)2的分解反应。
②NH4Cl溶液仅与体系中的MgO反应,且反应程度不大。
③“蒸氨”是将氨从固液混合物中蒸出来,且须控制合适的蒸出量。
请回答:
(1) 下列说法正确的是________ 。
A.步骤Ⅰ,煅烧样品的容器可以用坩埚,不能用烧杯和锥形瓶
B.步骤Ⅲ,蒸氨促进平衡正向移动,提高MgO的溶解量
C.步骤Ⅲ,可以将固液混合物C先过滤,再蒸氨
D.步骤Ⅳ,固液分离操作可采用常压过滤,也可采用减压过滤
(2) 步骤Ⅲ,需要搭建合适的装置,实现蒸氨、吸收和指示于一体(用硫酸溶液吸收氨气)。
①选择必须的仪器,并按连接顺序排列(填写代表仪器的字母,不考虑夹持和橡皮管连接):热源→________ 。

②为了指示蒸氨操作完成,在一定量硫酸溶液中加指示剂。请给出并说明蒸氨可以停止时的现象________ 。
(3) 溶液F经盐酸酸化、蒸发、结晶、过滤、洗涤和低温干燥得到产品。取少量产品溶于水后发现溶液呈碱性。
①含有的杂质是________ 。
②从操作上分析引入杂质的原因是________ 。
(4) 有同学采用盐酸代替步骤Ⅱ中的NH4Cl溶液处理固体B,然后除杂,制备MgCl2溶液。已知金属离子形成氢氧化物沉淀的pH范围:
请给出合理的操作排序(从下列操作中选取,按先后次序列出字母,操作可重复使用):固体B→a→( ) →( ) →( ) →( ) →( ) →( ) →MgCl2溶液→产品。
a.用盐酸溶解 b.调pH=3.0 c.调pH=5.0 d.调pH=8.5
e.调pH=11.0 f.过滤 g.洗涤

相关信息如下:
①700℃只发生MgCO3和Mg(OH)2的分解反应。
②NH4Cl溶液仅与体系中的MgO反应,且反应程度不大。
③“蒸氨”是将氨从固液混合物中蒸出来,且须控制合适的蒸出量。
请回答:
(1) 下列说法正确的是
A.步骤Ⅰ,煅烧样品的容器可以用坩埚,不能用烧杯和锥形瓶
B.步骤Ⅲ,蒸氨促进平衡正向移动,提高MgO的溶解量
C.步骤Ⅲ,可以将固液混合物C先过滤,再蒸氨
D.步骤Ⅳ,固液分离操作可采用常压过滤,也可采用减压过滤
(2) 步骤Ⅲ,需要搭建合适的装置,实现蒸氨、吸收和指示于一体(用硫酸溶液吸收氨气)。
①选择必须的仪器,并按连接顺序排列(填写代表仪器的字母,不考虑夹持和橡皮管连接):热源→

②为了指示蒸氨操作完成,在一定量硫酸溶液中加指示剂。请给出并说明蒸氨可以停止时的现象
(3) 溶液F经盐酸酸化、蒸发、结晶、过滤、洗涤和低温干燥得到产品。取少量产品溶于水后发现溶液呈碱性。
①含有的杂质是
②从操作上分析引入杂质的原因是
(4) 有同学采用盐酸代替步骤Ⅱ中的NH4Cl溶液处理固体B,然后除杂,制备MgCl2溶液。已知金属离子形成氢氧化物沉淀的pH范围:
| 金属离子 | pH | |
| 开始沉淀 | 完全沉淀 | |
| Al3+ | 3.0 | 4.7 |
| Fe3+ | 1.1 | 2.8 |
| Ca2+ | 11.3 | - |
| Mg2+ | 8.4 | 10.9 |
a.用盐酸溶解 b.调pH=3.0 c.调pH=5.0 d.调pH=8.5
e.调pH=11.0 f.过滤 g.洗涤
您最近一年使用:0次
2019-04-12更新
|
3948次组卷
|
6卷引用:2019年4月浙江省普通高校招生选考科目考试化学试题
2019年4月浙江省普通高校招生选考科目考试化学试题(已下线)专题10.3 化学实验方案的设计与评价 (讲)-《2020年高考一轮复习讲练测》(已下线)专题10.3 化学实验方案的设计与评价 (练)-《2020年高考一轮复习讲练测》(已下线)2021年高考化学押题预测卷(湖南卷)02(含考试版、答题卡、参考答案、全解全析)(已下线)专题21.化学工艺流程分析-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)2019年高考浙江卷化学试题变式题(实验题)
真题
名校
4 . 环己烯是重要的化工原料。其实验室制备流程如下:
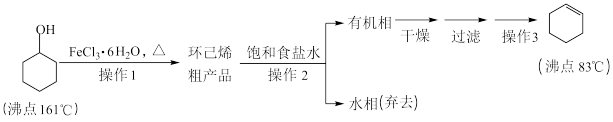
回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为____________ ,现象为__________________ 。
(2)操作1的装置如图所示(加热和夹持装置已略去)。
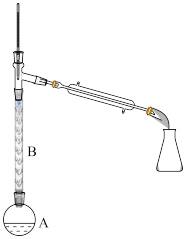
①烧瓶A中进行的可逆反应化学方程式为________________________ ,浓硫酸也可作该反应的催化剂,选择 而不用浓硫酸的原因为
而不用浓硫酸的原因为________________________ (填序号)。
a.浓硫酸易使原料碳化并产生
b. 污染小、可循环使用,符合绿色化学理念
污染小、可循环使用,符合绿色化学理念
c.同等条件下,用 比浓硫酸的平衡转化率高
比浓硫酸的平衡转化率高
②仪器B的作用为____________ 。
(3)操作2用到的玻璃仪器是____________ 。
(4)将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,____________ ,弃去前馏分,收集83℃的馏分。
Ⅱ.环己烯含量的测定
在一定条件下,向 环己烯样品中加入定量制得的
环己烯样品中加入定量制得的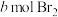 ,与环己烯充分反应后,剩余的
,与环己烯充分反应后,剩余的 与足量
与足量 作用生成
作用生成 ,用
,用 的
的 标准溶液滴定,终点时消耗
标准溶液滴定,终点时消耗 标准溶液
标准溶液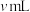 (以上数据均已扣除干扰因素)。
(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
①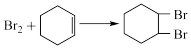
②
③
(5)滴定所用指示剂为____________ 。样品中环己烯的质量分数为____________ (用字母表示)。
(6)下列情况会导致测定结果偏低的是____________ (填序号)。
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c. 标准溶液部分被氧化
标准溶液部分被氧化

回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为
(2)操作1的装置如图所示(加热和夹持装置已略去)。

①烧瓶A中进行的可逆反应化学方程式为
 而不用浓硫酸的原因为
而不用浓硫酸的原因为a.浓硫酸易使原料碳化并产生

b.
 污染小、可循环使用,符合绿色化学理念
污染小、可循环使用,符合绿色化学理念c.同等条件下,用
 比浓硫酸的平衡转化率高
比浓硫酸的平衡转化率高②仪器B的作用为
(3)操作2用到的玻璃仪器是
(4)将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,
Ⅱ.环己烯含量的测定
在一定条件下,向
 环己烯样品中加入定量制得的
环己烯样品中加入定量制得的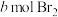 ,与环己烯充分反应后,剩余的
,与环己烯充分反应后,剩余的 与足量
与足量 作用生成
作用生成 ,用
,用 的
的 标准溶液滴定,终点时消耗
标准溶液滴定,终点时消耗 标准溶液
标准溶液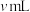 (以上数据均已扣除干扰因素)。
(以上数据均已扣除干扰因素)。测定过程中,发生的反应如下:
①

②

③

(5)滴定所用指示剂为
(6)下列情况会导致测定结果偏低的是
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c.
 标准溶液部分被氧化
标准溶液部分被氧化
您最近一年使用:0次
2019-06-09更新
|
7204次组卷
|
20卷引用:2019年天津高考化学试题
2019年天津高考化学试题(已下线)专题10.3 化学实验方案的设计与评价 (讲)-《2020年高考一轮复习讲练测》(已下线)专题10.3 化学实验方案的设计与评价 (练)-《2020年高考一轮复习讲练测》2020届高考化学二轮复习大题精准训练——定量分析化学实验中物质含量的测定专题5.2 化学实验的设计与评价(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)《2020年新高考政策解读与配套资源》模拟试题11-2020年北京新高考化学模拟试题(已下线)专题6.2 实验综合题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升山东省聊城市2019-2020学年高二下学期期末考试化学试题湖南省长沙市第一中学2020-2021学年高二上学期期末考试化学试题(已下线)小题24 有机物的制备中的操作、分离与提纯——备战2021年高考化学经典小题考前必刷(全国通用)江西省南昌市新建一中2020-2021学年高二下学期第一次月考化学试题(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点34 物质的制备与合成-备战2022年高考化学一轮复习考点帮(浙江专用)天津市第一中学2022届高三第一次月考化学试题(已下线)专题讲座(十)化学实验设计与探究(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点27 认识有机化合物-备战2023年高考化学考试易错题(已下线)专题十六实验设计与探究实验(已下线)专题19 实验综合题(已下线)T9-实验题湖北省武汉市武钢三中2022-2023学年高二下学期5月月考化学试题
5 . 根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计或结论不正确 的是
| 实验目的 | 方案设计 | 现象 | 结论 | |
| A | 探究 和浓 和浓 反应后溶液呈绿色的原因 反应后溶液呈绿色的原因 | 将 通入下列溶液至饱和: 通入下列溶液至饱和:①浓  ②  和HNO3,混合溶液 和HNO3,混合溶液 | ①无色变黄色 ②蓝色变绿色 |  和浓 和浓 反应后溶液呈绿色的主要原因是溶有 反应后溶液呈绿色的主要原因是溶有 |
| B | 比较 与 与 结合 结合 的能力 的能力 | 向等物质的量浓度的 和 和 混合溶液中滴加几滴 混合溶液中滴加几滴 溶液,振荡 溶液,振荡 | 溶液颜色无明显变化 | 结合 的能力: 的能力: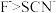 |
| C | 比较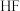 与 与 的酸性 的酸性 | 分别测定等物质的量浓度的 与 与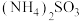 溶液的 溶液的 | 前者 小 小 | 酸性: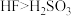 |
| D | 探究温度对反应速率的影响 | 等体积、等物质的量浓度的 与 与 溶液在不同温度下反应 溶液在不同温度下反应 | 温度高的溶液中先出现浑浊 | 温度升高,该反应速率加快 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-02更新
|
3388次组卷
|
6卷引用:2024年浙江高考真题化学(1月)
2024年浙江高考真题化学(1月)浙江省余姚中学2023-2024学年高二下学期3月质量检测化学试题(已下线)通关练03 常考化学实验基础知识-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)山东省青岛一中2023-2024学年高二下学期第二次月考化学试卷 (已下线)选择题11-16(已下线)2024年高考化学真题完全解读(浙江1月卷)(讲义+课件)
真题
6 . TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+CCl4(g) TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:

有关物质性质如下表
仪器A的名称是________ ,装置E中的试剂是_____________ 。反应开始前依次进行如下操作:组装仪器、____________ 、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通N2②熄灭酒精灯 ③冷却至室温。正确的顺序为_________ (填序号)。欲分离D中的液态混合物,所采用操作的名称是________________ 。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶 FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+ TiOSO4(aq)+ 2H2O(l)
水解 TiOSO4(aq)+ 2H2O(l) H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:

①试剂A为___ 。钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品TiO2收率降低,原因是________ 。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是_______ 。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是_________ (填化学式)。
(1)实验室利用反应TiO2(s)+CCl4(g)
 TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
有关物质性质如下表
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶 FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+ TiOSO4(aq)+ 2H2O(l)
水解 TiOSO4(aq)+ 2H2O(l)
 H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)简要工艺流程如下:

①试剂A为
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是
您最近一年使用:0次
2019-01-30更新
|
1713次组卷
|
4卷引用:2013年全国普通高等学校招生统一考试理科综合能力测试化学(山东卷)
2013年全国普通高等学校招生统一考试理科综合能力测试化学(山东卷)(已下线)2014届高考化学二轮复习四川配套训练 第13讲实验方案的设计练习卷2015届河南省陕州中学高三下学期第一次月考理科综合化学试卷(已下线)第29讲 化学实验方案的设计与评价-2021年高考化学一轮复习名师精讲练
7 . 下列实验能达到目的的是
| 实验目的 | 实验方法或操作 | |
| A | 测定中和反应的反应热 | 酸碱中和滴定的同时,用温度传感器采集锥形瓶内溶液的温度 |
| B | 探究浓度对化学反应速率的影响 | 量取同体积不同浓度的 溶液,分别加入等体积等浓度的 溶液,分别加入等体积等浓度的 溶液,对比现象 溶液,对比现象 |
| C | 判断反应后 是否沉淀完全 是否沉淀完全 | 将 溶液与 溶液与 溶液混合,反应后静置,向上层清液中再加1滴 溶液混合,反应后静置,向上层清液中再加1滴 溶液 溶液 |
| D | 检验淀粉是否发生了水解 | 向淀粉水解液中加入碘水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-07-06更新
|
13105次组卷
|
32卷引用:2022年辽宁高考真题化学试题
2022年辽宁高考真题化学试题(已下线)专题10 水溶液中的离子平衡-2022年高考真题模拟题分项汇编(已下线)2022年辽宁省高考真题化学试题(部分试题)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)2022年辽宁省高考真题变式题(11-15)(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)微专题43 常见物质的分离、提纯和鉴别-备战2023年高考化学考点微专题(全国版)福建省厦门集美中学2022-2023学年高三上学期10月月考化学试题吉林省延边第二中学2022-2023学年高三上学期第三次阶段测试化学试题(已下线)专题11 化学实验基础(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题18 物质检验、鉴别简单实验方案的设计及评价(已下线)【知识图鉴】单元讲练测选择性必修3第4单元02基础练(已下线)专题05 突破化学实验基础(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)江西省宜春市铜鼓中学2022-2023学年高二下学期第一次段考化学试题(已下线)回归教材重难点10 再现常考化学实验基础知识-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)2022年辽宁高考真题化学试题变式题(选择题11-15)(已下线)专题14 化学实验方案的设计与评价(已下线)专题14 化学实验方案的设计与评价(已下线)第09练 微型实验设计与评价 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点巩固卷12 化学实验基础(一)(3大考点67题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)专题11 化学实验(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)(已下线)实验02 定性与定量研究影响化学反应速率的因素-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)(已下线)实验01 中和反应反应热的测定-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)四川省内江市第六中学2023-2024学年高三上学期入学考试化学试题黑龙江省大庆市肇州县第二中学2023-2024学年高三上学期11月月考化学试题(已下线)题型07 化学实验基础(选择题)-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)吉林省长春市第二实验中学2023-2024学年高二下学期开学考试化学试题北京市第一○一中学2023-2024学年高三下学期统练二化学试题
真题
名校
8 . 根据实验目的,下列实验及现象、结论都正确的是
| 选项 | 实验目的 | 实验及现象 | 结论 |
| A | 比较 和 和 的水解常数 的水解常数 | 分别测浓度均为 的 的 和 和 溶液的 溶液的 ,后者大于前者 ,后者大于前者 |  |
| B | 检验铁锈中是否含有二价铁 | 将铁锈溶于浓盐酸,滴入 溶液,紫色褪去 溶液,紫色褪去 | 铁锈中含有二价铁 |
| C | 探究氢离子浓度对 、 、 相互转化的影响 相互转化的影响 | 向 溶液中缓慢滴加硫酸,黄色变为橙红色 溶液中缓慢滴加硫酸,黄色变为橙红色 | 增大氢离子浓度,转化平衡向生成 的方向移动 的方向移动 |
| D | 检验乙醇中是否含有水 | 向乙醇中加入一小粒金属钠,产生无色气体 | 乙醇中含有水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-06-08更新
|
23344次组卷
|
32卷引用:2022年高考全国甲卷化学真题
2022年高考全国甲卷化学真题(已下线)专题11化学实验基础-2022年高考真题+模拟题汇编(全国卷)(已下线)专题12化学实验方案的设计与评价-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题12化学实验方案的设计与评价-五年(2018~2022)高考真题汇编(全国卷)(已下线)2022年全国甲卷高考真题变式题(选择题)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)微专题43 常见物质的分离、提纯和鉴别-备战2023年高考化学考点微专题(全国版)(已下线)易错点34 化学实验方案的设计与评价-备战2023年高考化学考试易错题河南省濮阳市南乐县第一高级中学2022-2023学年高三上学期9月月考化学试题福建省2022-2023学年高三上学期化学1月质检考前模拟试题(已下线)专题11 化学实验基础(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题18 物质检验、鉴别简单实验方案的设计及评价(已下线)题型169 “实验目的—实验现象—实验操作”中涉及的实验基本操作(已下线)专题05 突破化学实验基础(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)北京师范大学附属实验中学2022-2023学年高三下学期零模化学试题(已下线)素养卷09 微型原理验证方案设计-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题14 化学实验方案的设计与评价湖南省衡阳市第八中学2022-2023学年高二下学期5月月考化学试题(已下线)专题14 化学实验方案的设计与评价(已下线)专题14 化学实验方案的设计与评价(已下线)第09练 微型实验设计与评价 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点巩固卷12 化学实验基础(一)(3大考点67题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)专题11 化学实验(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)江西省宜春市宜丰中学2022-2023学年高三上学期1月期末考试化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)题型07 化学实验基础(选择题)-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)四川省眉山市彭山区第一中学2023-2024学年高三上学期11月月考理综试题湖南省长沙市周南中学2023-2024学年高二下学期第一次月考化学试题山东省济宁市第一中学2023-2024学年高二下学期开学考试化学试题宁夏回族自治区银川一中2024届高三下学期考前热身训练化学试卷1
真题
名校
9 . 制备氮化镁的装置示意图如图:

回答下列问题:
(1)检查装置气密性的方法是_______ ,a的名称是_______ ,b的名称是_______ ;
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式_______ ;
(3)C的作用是_______ ,D的作用是_______ ,是否可以把C和D的位置对调并说明理由_______ ;
(4)写出E中发生反应的化学方程式_______ ;
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象_______ 。

回答下列问题:
(1)检查装置气密性的方法是
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式
(3)C的作用是
(4)写出E中发生反应的化学方程式
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象
您最近一年使用:0次
2016-12-09更新
|
1554次组卷
|
3卷引用:2013年全国普通高等学校招生统一考试理科综合能力测试化学(大纲卷)
2013年全国普通高等学校招生统一考试理科综合能力测试化学(大纲卷)(已下线)2014届高考化学二轮复习四川配套训练 第12讲化学实验基础练习卷福建省福州第一中学2017届高三5月质检(最后一模)理综化学试题
10 . 氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组长拟选用如下装置制备氢化钙。
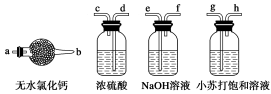
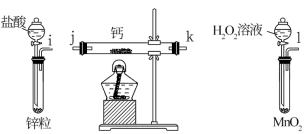
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为________ (填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞_________ (请按正确的顺序填入下列步骤的标号)。
A.加热反应一段时间 B.收集气体并检验其纯度
C.关闭分液漏斗活塞 D.停止加热,充分冷却
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此断,上述实验确有CaH2生成。
① 写出CaH2与水反应的化学方程式___________________ 。
②该同学的判断不正确,原因是_________________ 。
(4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象___________ 。
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是____________ 。


请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞
A.加热反应一段时间 B.收集气体并检验其纯度
C.关闭分液漏斗活塞 D.停止加热,充分冷却
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此断,上述实验确有CaH2生成。
① 写出CaH2与水反应的化学方程式
②该同学的判断不正确,原因是
(4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是
您最近一年使用:0次



