名校
1 . 二甲醚( )是一种洁净液体燃料,工业上以CO和
)是一种洁净液体燃料,工业上以CO和 为原料生产
为原料生产 。工业制备二甲醚在催化反应室中(压强:2.0~10.0 MIPa.温度:230-280℃)
。工业制备二甲醚在催化反应室中(压强:2.0~10.0 MIPa.温度:230-280℃)
进行下列反应:
反应ⅰ:
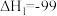 kJ⋅mol
kJ⋅mol
反应ⅱ: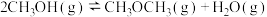
 kJ⋅mol
kJ⋅mol
反应ⅲ:
 kJ⋅mol
kJ⋅mol
(1)在该条件下,若反应i的起始浓度分别为 mol⋅L
mol⋅L ,
, mol⋅L
mol⋅L ,8 min后达到化学平衡状态,CO的转化率为50%,则8 min内CO的平均反应速率为
,8 min后达到化学平衡状态,CO的转化率为50%,则8 min内CO的平均反应速率为_______
(2)在t℃时。反应ⅱ的平衡常数为400,此温度下,在1 L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
此时
_______  (填“>”“<”或“=”)
(填“>”“<”或“=”)
(3)催化总反应为: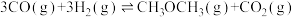

①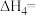
_______ kJ⋅mol
②CO的平衡转化率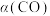 与温度、压强的关系如图所示。图中X代表
与温度、压强的关系如图所示。图中X代表_______ (填“温度”或“压强”)。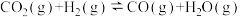 。回答下列问题:
。回答下列问题:
①用各物质的平衡浓度表示该反应的平衡常数表达式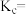
_______ 。
②下列有关上述可逆反应的说法正确的是_______ 。
A.断裂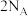 个
个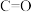 同时断裂
同时断裂 个
个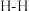 键,说明该可逆反应达到平衡
键,说明该可逆反应达到平衡
B.混合气体的平均密度不再改变,说明该可逆反应达到平衡
C.在该容器中充入一定量的氢气,平衡不移动
D.在该容器中充入 ,平衡常数K增大
,平衡常数K增大
E.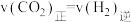 ,说明该可逆反应达到平衡
,说明该可逆反应达到平衡
F.该反应在低温下能自发进行
 )是一种洁净液体燃料,工业上以CO和
)是一种洁净液体燃料,工业上以CO和 为原料生产
为原料生产 。工业制备二甲醚在催化反应室中(压强:2.0~10.0 MIPa.温度:230-280℃)
。工业制备二甲醚在催化反应室中(压强:2.0~10.0 MIPa.温度:230-280℃)进行下列反应:
反应ⅰ:

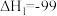 kJ⋅mol
kJ⋅mol
反应ⅱ:
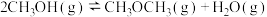
 kJ⋅mol
kJ⋅mol
反应ⅲ:

 kJ⋅mol
kJ⋅mol
(1)在该条件下,若反应i的起始浓度分别为
 mol⋅L
mol⋅L ,
, mol⋅L
mol⋅L ,8 min后达到化学平衡状态,CO的转化率为50%,则8 min内CO的平均反应速率为
,8 min后达到化学平衡状态,CO的转化率为50%,则8 min内CO的平均反应速率为(2)在t℃时。反应ⅱ的平衡常数为400,此温度下,在1 L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 |  |  |  |
c/(mol·L ) ) | 0.05 | 2.0 | 2.0 |

 (填“>”“<”或“=”)
(填“>”“<”或“=”)(3)催化总反应为:
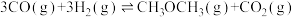

①
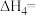

②CO的平衡转化率
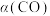 与温度、压强的关系如图所示。图中X代表
与温度、压强的关系如图所示。图中X代表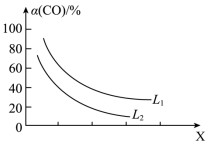
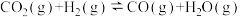 。回答下列问题:
。回答下列问题:①用各物质的平衡浓度表示该反应的平衡常数表达式
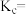
②下列有关上述可逆反应的说法正确的是
A.断裂
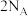 个
个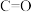 同时断裂
同时断裂 个
个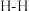 键,说明该可逆反应达到平衡
键,说明该可逆反应达到平衡B.混合气体的平均密度不再改变,说明该可逆反应达到平衡
C.在该容器中充入一定量的氢气,平衡不移动
D.在该容器中充入
 ,平衡常数K增大
,平衡常数K增大E.
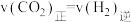 ,说明该可逆反应达到平衡
,说明该可逆反应达到平衡F.该反应在低温下能自发进行
您最近一年使用:0次
名校
解题方法
2 . 设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.含有7.8 g 的溶液中: 的溶液中: 的数目为 的数目为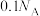 |
B.1 L 1 mol⋅L 溴化铵水溶液中 溴化铵水溶液中 与 与 离子数之和大于 离子数之和大于 |
C.标准状况下,11.2 L 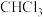 含有 含有 键的数目为 键的数目为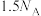 |
D.常温下,1 L  的 的 溶液中,由水电离出的 溶液中,由水电离出的 数目为 数目为 |
您最近一年使用:0次
2024-05-02更新
|
78次组卷
|
2卷引用:广西防城港市实验高级中学2023-2024学年高二下学期期中考试化学试题
3 . 下列关于价电子排布3s23p4的描述正确的是
| A.它的元素符号为O |
| B.它的核外电子排布式为1s22s22p63s23p4 |
| C.可以与H2化合生成液态化合物 |
D.其电子排布图为 |
您最近一年使用:0次
2024-04-13更新
|
225次组卷
|
44卷引用:广西防城港市防城中学2019-2020学年高二下学期期中考试化学试题
广西防城港市防城中学2019-2020学年高二下学期期中考试化学试题(已下线)2011-2012学年福建省厦门一中高二上学期期中考试化学试卷(已下线)2011-2012学年内蒙古包头三十三中高二下学期期中考试化学试卷(已下线)2011-2012学年河南许昌鄢陵一高高二下学期期中考试化学试卷(已下线)2012-2013学年山东省淄博市沂源一中高二下学期期中模块检测化学卷(已下线)2012-2013学年山东省济南一中高二下学期期中考试理科化学试卷(已下线)2013-2014学年福建省厦门一中高二上学期期中考试化学试卷2013-2014山东省即墨市高二下学期期中考试化学试卷宁夏育才中学2016-2017学年高二下学期期中考试化学试题江苏省盘湾中学、陈洋中学2017-2018学年高二上学期期中联考(选修)化学试题新疆维吾尔自治区北京大学附属中学新疆分校2018-2019学年高二下学期期中考试化学试题甘肃省静宁县第一中学2019-2020学年高二下学期期中考试(第二次月考)化学试题(普通班)湖北省仙桃市汉江中学2018-2019学年高二下学期期中考试化学试题宁夏石嘴山市平罗中学2021-2022学年高二上学期期中考试化学试题(已下线)吉林一中2009--2010学年度下学期期末考试第一次质量检测高二化学试卷(已下线)2012届浙江省杭州高中高三第二次月考化学试卷2015-2016学年西藏日喀则一中高二10月月考化学试卷2015-2016学年贵州省思南中学高二下第二次月考化学试卷2016-2017学年高中化学选修3(人教版)模块综合测评【全国校级联考】新疆昌吉市教育共同体四校2017-2018学年高二下学期期末联考化学试题云南省武定县第一中学2018-2019学年高二上学期12月份考试化学试题云南省昭通水田新区中学2018-2019学年高二上学期12月月考化学试题宁夏回族自治区青铜峡市高级中学2018-2019学年高二上学期期末考试化学试题宁夏回族自治区银川市长庆高级中学2018-2019学年高二下学期第二次月考化学试题福建省长泰县第一中学2018-2019学年高二下学期期末考试化学试题新疆石河子第二中学2018-2019学年高二下学期第一次月考化学试题河南省林州市第一中学2019-2020学年高二3月线上调研考试化学试题江苏省盐城市伍佑中学2019-2020学年高二下学期第一次阶段考试化学试题湖北省武汉市黄陂区第六中学2019-2020学年高二下学期三月线上考试化学试题新疆新源县第二中学2019-2020学年高二下学期期末考试化学试题(已下线)考点33 原子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)课时54 原子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)宁夏青铜峡市高级中学2021-2022学年高二上学期期末考试化学试题(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)黑龙江省牡丹江市海林市朝鲜族中学2021-2022学年高二下学期第一次月考化学试题宁夏吴忠市吴忠中学2022-2023学年高三上学期阶段性测试 化学试题河北省保定高碑店市崇德实验中学2022-2023学年高三上学期10月月考化学试题重庆市西南大学附属中学校2022-2023学年高二上学期开学定时训练化学试题(广延班)(已下线)考点41 原子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江西省南昌市八一中学2022-2023学年高二上学期1月期末考试化学试题(已下线)第01讲 原子结构-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)(已下线)选择题6-10(已下线)第一章章节专项提升贵州省遵义市桐梓县荣兴高级中学2023-2024学年高二下学期第一次(3月)月考化学试题
名校
解题方法
4 . 高铁酸钠( )是一种新型绿色消毒剂,主要用于饮用水处理。制备高铁酸钠的反应原理为:
)是一种新型绿色消毒剂,主要用于饮用水处理。制备高铁酸钠的反应原理为: 。某化学兴趣小组用废铁屑(主要成分为Fe,杂质有Al、C)制备高铁酸钠的主要流程如下。
。某化学兴趣小组用废铁屑(主要成分为Fe,杂质有Al、C)制备高铁酸钠的主要流程如下。___________ , 中铁的化合价为
中铁的化合价为___________ 。
(2)“碱浸”过程中发生的离子反应方程式为___________ 。
(3)“酸浸”时适当升温的目的是___________ 。
(4)“滤渣”的主要成分为___________ 。
(5)“操作I”中通入空气的目的是___________ 。
(6)常温下,加入NaOH溶液调节溶液
___________ 时,溶液中 mol/L(已知:常温下,
mol/L(已知:常温下, 的溶度积常数为
的溶度积常数为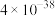 )。
)。
 )是一种新型绿色消毒剂,主要用于饮用水处理。制备高铁酸钠的反应原理为:
)是一种新型绿色消毒剂,主要用于饮用水处理。制备高铁酸钠的反应原理为: 。某化学兴趣小组用废铁屑(主要成分为Fe,杂质有Al、C)制备高铁酸钠的主要流程如下。
。某化学兴趣小组用废铁屑(主要成分为Fe,杂质有Al、C)制备高铁酸钠的主要流程如下。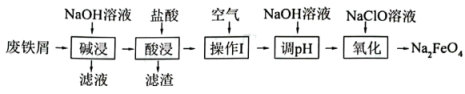
 中铁的化合价为
中铁的化合价为(2)“碱浸”过程中发生的离子反应方程式为
(3)“酸浸”时适当升温的目的是
(4)“滤渣”的主要成分为
(5)“操作I”中通入空气的目的是
(6)常温下,加入NaOH溶液调节溶液

 mol/L(已知:常温下,
mol/L(已知:常温下, 的溶度积常数为
的溶度积常数为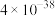 )。
)。
您最近一年使用:0次
2024-03-31更新
|
96次组卷
|
2卷引用:广西防城港市实验高级中学2023-2024学年高二下学期期中考试化学试题
5 . 橙花醇的结构简式如图,下列有关橙花醇的说法不正确 的是
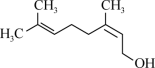
| A.分子式为C10H18O |
| B.能发生取代反应、加成反应 |
| C.所有的C原子一定都共平面 |
| D.橙花醇能使溴水褪色 |
您最近一年使用:0次
2024-03-31更新
|
363次组卷
|
2卷引用:广西防城港市实验高级中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
6 . 下列物质的熔点高低顺序正确的是
| A.金刚石>石墨>晶体硅>碳化硅 |
| B.CH3CH2CH2CH2CH3>CH3C(CH3)2CH3 |
| C.HI>HBr>HCl>HF |
| D.黄铜>纯铜>钠>钾 |
您最近一年使用:0次
2024-03-31更新
|
130次组卷
|
2卷引用:广西防城港市实验高级中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
7 . 下列关于各图像的解释或得出的结论不正确 的是

A.由甲图可知,反应在 时刻可能改变了压强或使用了催化剂 时刻可能改变了压强或使用了催化剂 |
| B.由乙图可知,反应在m点可能达到了平衡状态 |
C.由丙图可知,C点: |
D.由丁图可知,交点A表示反应一定处于平衡状态,此时 |
您最近一年使用:0次
2023-12-29更新
|
308次组卷
|
9卷引用:广西防城港市实验高级中学2023-2024学年高二上学期期中考试化学试题
广西防城港市实验高级中学2023-2024学年高二上学期期中考试化学试题湖南省岳阳县第一中学2022-2023学年高二上学期11月期中测试化学试题(已下线)广东省深圳中学2023-2024学年高二上学期11月期中考试化学试题四川省资阳市2021-2022学年高二上学期期末考试化学试题湖南省长沙市长郡梅溪湖中学2022-2023学年高二上学期第三次月考化学试题陕西省西北工业大学附属中学2022-2023学年高一下学期期末考试化学试题(已下线)考点25 化学反应速率与平衡图象(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省永州市第一中学2023-2024学年高二上学期9月月考化学试题河南省许昌高级中学2023-2024学年高一下学期4月月考化学试题
名校
解题方法
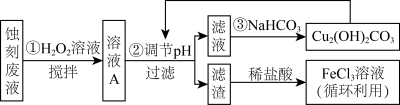
8 . 电子工业中,可用FeCl3-HCl溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
已知: Fe3+在溶液中会发生水解,当溶液呈酸性时可以抑制其水解
(1)步骤①中,为加快反应速率,除搅拌外,还可以___________ (任写一点)
(2)步骤②过滤中,用到的玻璃仪器,除烧杯外,还需要___________
(3)用FeCl3—HCl溶液刻蚀铜板时反应的离子方程式为___________ 。
(4)FeCl3蚀刻液中加入盐酸的目的是___________ 。
(5)步骤①中加入H2O2溶液的目的是(用离子方程式表示)___________ 。
(6)生成氢氧化物沉淀的pH如下表根据表中数据推测调节pH的范围是___________ 。
(7)上述流程路线中,除FeCl3溶液外,还可用于循环利用的物质是___________ 。

已知: Fe3+在溶液中会发生水解,当溶液呈酸性时可以抑制其水解
(1)步骤①中,为加快反应速率,除搅拌外,还可以
(2)步骤②过滤中,用到的玻璃仪器,除烧杯外,还需要
(3)用FeCl3—HCl溶液刻蚀铜板时反应的离子方程式为
(4)FeCl3蚀刻液中加入盐酸的目的是
(5)步骤①中加入H2O2溶液的目的是(用离子方程式表示)
(6)生成氢氧化物沉淀的pH如下表根据表中数据推测调节pH的范围是
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
(7)上述流程路线中,除FeCl3溶液外,还可用于循环利用的物质是
您最近一年使用:0次
名校
解题方法
9 . 二氧化氯(ClO2)是一种高效消毒剂,易溶于水,沸点为11.0°C,浓度高时极易爆炸。某研究小组在实验室按如图所示的装置,用干燥的氯气与固体亚氯酸钠制备二氧化氯,请回答下列问题:

(1)B装置使用的试液X为___________ ,其作用是___________ 。
(2)装置E的作用是___________ 。
(3)装置D中冰水的主要作用是___________ ,往D中通入氯气的同时还通入干燥的空气,其主要目的是___________ 。
(4)装置D内发生反应的化学方程式为___________ 。
(5)工业上可在酸性条件下用双氧水与NaClO3反应制备ClO2,该反应的离子方程式为___________ 。

(1)B装置使用的试液X为
(2)装置E的作用是
(3)装置D中冰水的主要作用是
(4)装置D内发生反应的化学方程式为
(5)工业上可在酸性条件下用双氧水与NaClO3反应制备ClO2,该反应的离子方程式为
您最近一年使用:0次
10 . 丙烯是一种重要的化工原料。可在一固定容积的密闭容器中由丙烷催化脱氢制备。
(1)已知: ①C3H8(g)=C3H6(g)+H2(g) _______。
_______。
②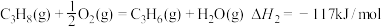
③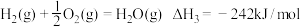
反应①的
___________ 。
(2)欲提高①反应中 的平衡转化率,可采取的措施有___________(填标号)。
的平衡转化率,可采取的措施有___________(填标号)。
(3)能表明该反应①达到平衡状态的是___________(填字母)。
(4)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为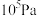 ,平衡时总压增加了20%。则达到平衡时,
,平衡时总压增加了20%。则达到平衡时, 的转化率为
的转化率为___________ 。该反应的平衡常数
___________ Pa.(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。写出该反应的化学平衡常数表达式:K=___________ ;保持恒温恒容,将反应的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡___________ (填“正向”逆向”或“不”)移动,平衡常数K___________ (填“变大”变小”或“不变”)。
(1)已知: ①C3H8(g)=C3H6(g)+H2(g)
 _______。
_______。②
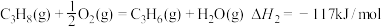
③
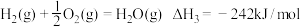
反应①的

(2)欲提高①反应中
 的平衡转化率,可采取的措施有___________(填标号)。
的平衡转化率,可采取的措施有___________(填标号)。A.增大 的浓度 的浓度 | B.提高温度 | C.恒容下通入惰性气体 | D.使用高效催化剂 |
| A.C3H8的转化率等于H2的产率 | B.混合气体的平均相对分子质量不变 |
C.v(C3H8)与 的比值不变 的比值不变 | D.混合气体的密度不变 |
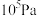 ,平衡时总压增加了20%。则达到平衡时,
,平衡时总压增加了20%。则达到平衡时, 的转化率为
的转化率为
(5)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。写出该反应的化学平衡常数表达式:K=
您最近一年使用:0次



