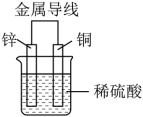
1 . 如图为Zn-Cu原电池的示意图,请回答:_______ 极,铜片为原电池的_______ 极 (填“正”或“负”) 。
(2)锌电极反应式是_______ ,属于_______ 反应(填“氧化”或“还原”);铜电极反应式是_______ ,属于_______ 反应(同上)。
(3)若锌片减轻0.1mol,则另一极放出气体的物质的量为_______ mol。
(2)锌电极反应式是
(3)若锌片减轻0.1mol,则另一极放出气体的物质的量为
您最近一年使用:0次
2 . 卤素化合物在生产生活中应用广泛,回答下列问题
(1)研究表明 气体中存在单体和环状六聚体的平衡:
气体中存在单体和环状六聚体的平衡: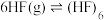 ,HF形成环状六聚体的作用力是
,HF形成环状六聚体的作用力是____________ ;在测定 相对分子质量的实验中,
相对分子质量的实验中,____________ (填“低压”或“高压”)有利于测定的准确性.
(2) 气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸
气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸 和氯酸钾
和氯酸钾 在酸性条件下制备
在酸性条件下制备 ,离子方程式为
,离子方程式为__________ ;产物中的另一种气体可以起到的作用是________________ .
(3) 与
与 以共价键形成
以共价键形成 ,其中
,其中________ 显负电性, 与水反应的方程式是
与水反应的方程式是____________ .
(4)利用 和浓磷酸制备
和浓磷酸制备 的原理是:
的原理是: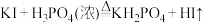 ,该反应中利用了浓磷酸的什么性质:
,该反应中利用了浓磷酸的什么性质:________ (“强酸性”“强氧化性”“高沸点”).
(1)研究表明
 气体中存在单体和环状六聚体的平衡:
气体中存在单体和环状六聚体的平衡: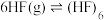 ,HF形成环状六聚体的作用力是
,HF形成环状六聚体的作用力是 相对分子质量的实验中,
相对分子质量的实验中,(2)
 气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸
气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸 和氯酸钾
和氯酸钾 在酸性条件下制备
在酸性条件下制备 ,离子方程式为
,离子方程式为(3)
 与
与 以共价键形成
以共价键形成 ,其中
,其中 与水反应的方程式是
与水反应的方程式是(4)利用
 和浓磷酸制备
和浓磷酸制备 的原理是:
的原理是: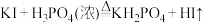 ,该反应中利用了浓磷酸的什么性质:
,该反应中利用了浓磷酸的什么性质:
您最近一年使用:0次
解题方法
3 . I.现有下列物质:
①铁、②硫酸溶液、③ 、④熔融的
、④熔融的 、⑤
、⑤ 固体、⑥蔗糖、⑦
固体、⑥蔗糖、⑦ 晶体、⑧氧气、⑨氨水、⑩稀硝酸。
晶体、⑧氧气、⑨氨水、⑩稀硝酸。
(1)上述物质中属于电解质的有___________ (填编号,下同),属于非电解质的有___________ ,能导电的有___________ 。
(2) 电离方程式为
电离方程式为___________ 。
II.利用氧化还原反应原理可处理污水。
(3)高铁酸钠 是一种新型的净水剂,其中一种制备方法如下:
是一种新型的净水剂,其中一种制备方法如下:
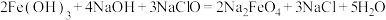 。
。
用单线桥标出该反应电子转移的方向和数目___________ 。
(4)电镀废水中含有剧毒的 (C为
(C为 价),加入
价),加入 溶液处理该碱性废水时生成
溶液处理该碱性废水时生成 、
、 和
和 。该反应的离子方程式为
。该反应的离子方程式为___________ 。
①铁、②硫酸溶液、③
 、④熔融的
、④熔融的 、⑤
、⑤ 固体、⑥蔗糖、⑦
固体、⑥蔗糖、⑦ 晶体、⑧氧气、⑨氨水、⑩稀硝酸。
晶体、⑧氧气、⑨氨水、⑩稀硝酸。(1)上述物质中属于电解质的有
(2)
 电离方程式为
电离方程式为II.利用氧化还原反应原理可处理污水。
(3)高铁酸钠
 是一种新型的净水剂,其中一种制备方法如下:
是一种新型的净水剂,其中一种制备方法如下: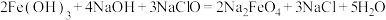 。
。用单线桥标出该反应电子转移的方向和数目
(4)电镀废水中含有剧毒的
 (C为
(C为 价),加入
价),加入 溶液处理该碱性废水时生成
溶液处理该碱性废水时生成 、
、 和
和 。该反应的离子方程式为
。该反应的离子方程式为
您最近一年使用:0次
解题方法
4 . 亚硝酸钠 是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。
是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。
(1)从物质分类角度来看, 是
是___________ (填序号)。
a.酸 b.盐 c.碱 d.非电解质 e.电解质
(2)由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下,配平该化学方程式:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下,配平该化学方程式:___________
_______ _______
_______ _______
_______ _______NO↑+_______
_______NO↑+_______ _______
_______ _______
_______ _______
_______
(3)用上述反应来处理 并不是最佳方法,其原因是
并不是最佳方法,其原因是___________ 。
(4)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出
表现出___________ (“氧化性”或“还原性”)。
 是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。
是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。(1)从物质分类角度来看,
 是
是a.酸 b.盐 c.碱 d.非电解质 e.电解质
(2)由于
 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下,配平该化学方程式:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下,配平该化学方程式:_______
 _______
_______ _______
_______ _______NO↑+_______
_______NO↑+_______ _______
_______ _______
_______ _______
_______
(3)用上述反应来处理
 并不是最佳方法,其原因是
并不是最佳方法,其原因是(4)误食
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出
表现出
您最近一年使用:0次
名校
解题方法
5 . I.现有如下物质:①液态氯化氢②氯水③ ④
④ ⑤澄清石灰水⑥铝⑦NaOH溶液⑧
⑤澄清石灰水⑥铝⑦NaOH溶液⑧ 溶液
溶液
(1)这些物质中,属于电解质的是(填编号)_______ 。
(2)将铝放入氢氧化钠溶液中有气体产生,请写出发生反应的离子方程式_______ 。
(3)把少量的④加入⑤中,离子反应方程式为_______ 。
II.已知次磷酸(H3PO2)是一元中强酸。
(4)次磷酸钡是一种溶于水的强电解质,向Ba(H2PO2)2溶液中加入硫酸可以制取H3PO2,写出反应的离子方程式:_______ 。
(5)H3PO2可将溶液中的Ag+还原为银,从而用于化学镀银,反应同时生成P元素最高价氧化物对应的水化物。0.1molH3PO2能还原出金属银_______ g。
 ④
④ ⑤澄清石灰水⑥铝⑦NaOH溶液⑧
⑤澄清石灰水⑥铝⑦NaOH溶液⑧ 溶液
溶液(1)这些物质中,属于电解质的是(填编号)
(2)将铝放入氢氧化钠溶液中有气体产生,请写出发生反应的离子方程式
(3)把少量的④加入⑤中,离子反应方程式为
II.已知次磷酸(H3PO2)是一元中强酸。
(4)次磷酸钡是一种溶于水的强电解质,向Ba(H2PO2)2溶液中加入硫酸可以制取H3PO2,写出反应的离子方程式:
(5)H3PO2可将溶液中的Ag+还原为银,从而用于化学镀银,反应同时生成P元素最高价氧化物对应的水化物。0.1molH3PO2能还原出金属银
您最近一年使用:0次
6 . 研究化学反应意义重大,请就下列现象和实质回答问题。
(1) 可用作白色颜料和阻燃剂等。在实验室中可利用
可用作白色颜料和阻燃剂等。在实验室中可利用 的水解反应制取
的水解反应制取 (
( 的水解分三步进行,中间产物有
的水解分三步进行,中间产物有 等),写出
等),写出 水解生成
水解生成 的水解反应方程式
的水解反应方程式______ 。
(2)次磷酸( )是一种弱酸,
)是一种弱酸, 溶液和足量
溶液和足量 溶液混合,所得溶液中阴离子只有
溶液混合,所得溶液中阴离子只有 、
、 两种。写出
两种。写出 溶液与
溶液与 溶液恰好完全中和的溶液中各离子浓度由大到小的顺序为
溶液恰好完全中和的溶液中各离子浓度由大到小的顺序为_______ 。
(3)已知 与
与 溶液反应生成
溶液反应生成 ,与稀硫酸反应生成
,与稀硫酸反应生成 ,写出
,写出 在水中的两种电离方程式
在水中的两种电离方程式_______ 、_______ 。
(4)一定温度下,用水吸收 气体时,溶液中水的电离平衡
气体时,溶液中水的电离平衡_______ 移动(填“向左”“向右”或“不”);若得到 的
的 溶液,试计算溶液中
溶液,试计算溶液中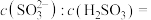
_______ (已知该温度下, 的电离常数:
的电离常数: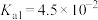 ,
, )。
)。
(5)某温度下, 的盐酸中
的盐酸中 ;该温度下
;该温度下 的
的 溶液与
溶液与 的
的 溶液混合后溶液的
溶液混合后溶液的 ,则
,则 与
与 溶液的体积比为
溶液的体积比为_______ 。
(6) 时,若向
时,若向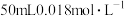 的
的 溶液中加入
溶液中加入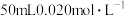 的盐酸,混合后溶液中的
的盐酸,混合后溶液中的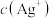 为
为______  (
( 时,
时, )。
)。
(1)
 可用作白色颜料和阻燃剂等。在实验室中可利用
可用作白色颜料和阻燃剂等。在实验室中可利用 的水解反应制取
的水解反应制取 (
( 的水解分三步进行,中间产物有
的水解分三步进行,中间产物有 等),写出
等),写出 水解生成
水解生成 的水解反应方程式
的水解反应方程式(2)次磷酸(
 )是一种弱酸,
)是一种弱酸, 溶液和足量
溶液和足量 溶液混合,所得溶液中阴离子只有
溶液混合,所得溶液中阴离子只有 、
、 两种。写出
两种。写出 溶液与
溶液与 溶液恰好完全中和的溶液中各离子浓度由大到小的顺序为
溶液恰好完全中和的溶液中各离子浓度由大到小的顺序为(3)已知
 与
与 溶液反应生成
溶液反应生成 ,与稀硫酸反应生成
,与稀硫酸反应生成 ,写出
,写出 在水中的两种电离方程式
在水中的两种电离方程式(4)一定温度下,用水吸收
 气体时,溶液中水的电离平衡
气体时,溶液中水的电离平衡 的
的 溶液,试计算溶液中
溶液,试计算溶液中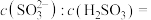
 的电离常数:
的电离常数: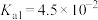 ,
, )。
)。(5)某温度下,
 的盐酸中
的盐酸中 ;该温度下
;该温度下 的
的 溶液与
溶液与 的
的 溶液混合后溶液的
溶液混合后溶液的 ,则
,则 与
与 溶液的体积比为
溶液的体积比为(6)
 时,若向
时,若向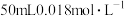 的
的 溶液中加入
溶液中加入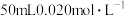 的盐酸,混合后溶液中的
的盐酸,混合后溶液中的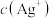 为
为 (
( 时,
时, )。
)。
您最近一年使用:0次
名校
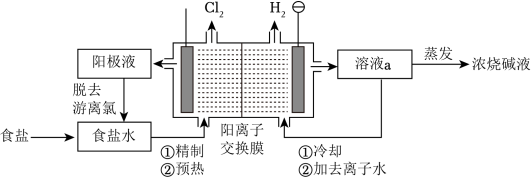
7 . 阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如图所示:________ ,开始时_________ 极(阴、阳)碱性增强。
(2)实际生产中,阳离子交换膜的损伤会造成OH-迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为___________ 。
(3)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为___________ 。
(4)电解结束后,能够脱去阳极液中游离氯的试剂或方法是___________ (填字母序号)。
a.Na2SO4 b.Na2SO3 c.热空气吹出 d.降低阳极区液面上方的气压
(5)食盐水中的I若进入电解槽,可被电解产生的Cl2氧化为ICl。ICl中碘元素的化合价为___________ ,根据原子的性质分析上述判断的理由:___________ 。
(2)实际生产中,阳离子交换膜的损伤会造成OH-迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为
(3)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为
(4)电解结束后,能够脱去阳极液中游离氯的试剂或方法是
a.Na2SO4 b.Na2SO3 c.热空气吹出 d.降低阳极区液面上方的气压
(5)食盐水中的I若进入电解槽,可被电解产生的Cl2氧化为ICl。ICl中碘元素的化合价为
您最近一年使用:0次
2024-02-10更新
|
166次组卷
|
3卷引用:安徽省淮北市树人高级中学2023-2024学年高二下学期开学考试化学试题
名校
8 . 氧化还原反应在生产、生活和生命活动中起着十分重要的作用。例如,饮用水处理和污水净化问题中就广泛应用了氧化还原反应的原理。
I.高铁酸钠 是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用化学方程式表示为:
是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用化学方程式表示为: 。
。
(1)在 中,
中, 的化合价为
的化合价为___________ 价;上述反应中,每生成 ,有
,有___________  电子转移。
电子转移。
(2)制备 的另外一种方法是在碱性条件下用
的另外一种方法是在碱性条件下用 和
和 反应,请写出相关的离子方程式:
反应,请写出相关的离子方程式:___________ 。
Ⅱ.含氯消毒剂在自来水净化过程中也起到了重要作用。
(3)很多自来水厂用氯气来杀菌、消毒,实验室不能用自来水配制硝酸银溶液,用离子方程式表示其原因___________ 。
(4)亚氯酸钠 是一种高效的漂白剂和氧化剂,其制备方法如下:
是一种高效的漂白剂和氧化剂,其制备方法如下: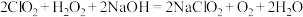 ,从上述反应中可知氧化性较强的是
,从上述反应中可知氧化性较强的是___________ (填“二氧化氯”或“氧气”)。
(5)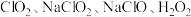 都常被用作消毒剂,上述物质消毒效率最高的是___________(填序号)。(已知:消毒效率是以单位物质的量的物质得电子的数目多少表示,得电子越多效率越高)
都常被用作消毒剂,上述物质消毒效率最高的是___________(填序号)。(已知:消毒效率是以单位物质的量的物质得电子的数目多少表示,得电子越多效率越高)
I.高铁酸钠
 是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用化学方程式表示为:
是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用化学方程式表示为: 。
。(1)在
 中,
中, 的化合价为
的化合价为 ,有
,有 电子转移。
电子转移。(2)制备
 的另外一种方法是在碱性条件下用
的另外一种方法是在碱性条件下用 和
和 反应,请写出相关的离子方程式:
反应,请写出相关的离子方程式:Ⅱ.含氯消毒剂在自来水净化过程中也起到了重要作用。
(3)很多自来水厂用氯气来杀菌、消毒,实验室不能用自来水配制硝酸银溶液,用离子方程式表示其原因
(4)亚氯酸钠
 是一种高效的漂白剂和氧化剂,其制备方法如下:
是一种高效的漂白剂和氧化剂,其制备方法如下: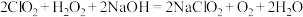 ,从上述反应中可知氧化性较强的是
,从上述反应中可知氧化性较强的是(5)
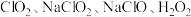 都常被用作消毒剂,上述物质消毒效率最高的是___________(填序号)。(已知:消毒效率是以单位物质的量的物质得电子的数目多少表示,得电子越多效率越高)
都常被用作消毒剂,上述物质消毒效率最高的是___________(填序号)。(已知:消毒效率是以单位物质的量的物质得电子的数目多少表示,得电子越多效率越高)A. | B. | C. | D. |
您最近一年使用:0次
名校
9 . I.完成以下填空:
(1)现有:①固体 ②稀硫酸③氨气④熔融
②稀硫酸③氨气④熔融 ⑤蔗糖⑥铜;其中能导电的是
⑤蔗糖⑥铜;其中能导电的是___________ (填序号,下同);属于电解质的是___________ 。
(2)配制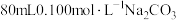 溶液,需要
溶液,需要 晶体的质量为
晶体的质量为___________ 。
II.酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有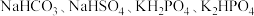 等。已知
等。已知 (次磷酸)与足量的
(次磷酸)与足量的 反应只生成一种盐
反应只生成一种盐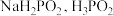 水溶液中存在
水溶液中存在 分子。
分子。
(3) 属于
属于___________ 酸; 为
为___________ 盐(填序号)。
①一元酸,②二元酸,③三元酸,④强酸,⑤弱酸,⑥正盐,⑦酸式盐
(4)写出 溶液与足量
溶液与足量 溶液反应的离子方程式
溶液反应的离子方程式___________ 。
(1)现有:①固体
 ②稀硫酸③氨气④熔融
②稀硫酸③氨气④熔融 ⑤蔗糖⑥铜;其中能导电的是
⑤蔗糖⑥铜;其中能导电的是(2)配制
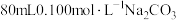 溶液,需要
溶液,需要 晶体的质量为
晶体的质量为II.酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有
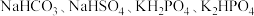 等。已知
等。已知 (次磷酸)与足量的
(次磷酸)与足量的 反应只生成一种盐
反应只生成一种盐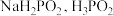 水溶液中存在
水溶液中存在 分子。
分子。(3)
 属于
属于 为
为①一元酸,②二元酸,③三元酸,④强酸,⑤弱酸,⑥正盐,⑦酸式盐
(4)写出
 溶液与足量
溶液与足量 溶液反应的离子方程式
溶液反应的离子方程式
您最近一年使用:0次
10 . 碱式硫酸铁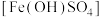 难溶于水,可做净水剂、媒染剂、颜料和药物。可由硫酸亚铁与稀硝酸共热制得。某实验小组欲用如图所示装置进行实验,回答下列问题:
难溶于水,可做净水剂、媒染剂、颜料和药物。可由硫酸亚铁与稀硝酸共热制得。某实验小组欲用如图所示装置进行实验,回答下列问题:
(1)锥形瓶中发生反应的化学方程式为___________ ;某同学认为用 溶液代替稀硝酸更好,理由是
溶液代替稀硝酸更好,理由是___________ 。
(2)酸性高锰酸钾溶液可除去一氧化氮,反应的离子方程式为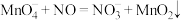 。
。
该反应分两步进行。第一步是高锰酸钾把一氧化氮氧化为二氧化氮,反应的离子方程式为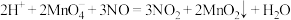 ,则第二步反应的离子方程式为
,则第二步反应的离子方程式为___________ 。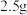 产物溶于适量稀硫酸中,加入足量KI溶液,充分反应后,滴入几滴淀粉溶液,用
产物溶于适量稀硫酸中,加入足量KI溶液,充分反应后,滴入几滴淀粉溶液,用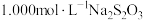 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 (涉及的反应方程式为
(涉及的反应方程式为 、
、 )。
)。
①盛装 标准溶液的滴定管应选用
标准溶液的滴定管应选用___________ (填“酸式”或“碱式”)滴定管。
②判断达到滴定终点的方法为___________ 。
③该产品的纯度为___________  ,滴定过程中,如果滴定速度过慢,可能导致所测结果
,滴定过程中,如果滴定速度过慢,可能导致所测结果___________ (填“偏高”“偏低”或“无影响”)。
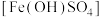 难溶于水,可做净水剂、媒染剂、颜料和药物。可由硫酸亚铁与稀硝酸共热制得。某实验小组欲用如图所示装置进行实验,回答下列问题:
难溶于水,可做净水剂、媒染剂、颜料和药物。可由硫酸亚铁与稀硝酸共热制得。某实验小组欲用如图所示装置进行实验,回答下列问题:(1)锥形瓶中发生反应的化学方程式为
 溶液代替稀硝酸更好,理由是
溶液代替稀硝酸更好,理由是(2)酸性高锰酸钾溶液可除去一氧化氮,反应的离子方程式为
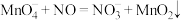 。
。该反应分两步进行。第一步是高锰酸钾把一氧化氮氧化为二氧化氮,反应的离子方程式为
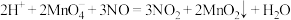 ,则第二步反应的离子方程式为
,则第二步反应的离子方程式为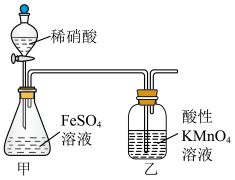
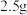 产物溶于适量稀硫酸中,加入足量KI溶液,充分反应后,滴入几滴淀粉溶液,用
产物溶于适量稀硫酸中,加入足量KI溶液,充分反应后,滴入几滴淀粉溶液,用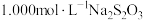 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 (涉及的反应方程式为
(涉及的反应方程式为 、
、 )。
)。①盛装
 标准溶液的滴定管应选用
标准溶液的滴定管应选用②判断达到滴定终点的方法为
③该产品的纯度为
 ,滴定过程中,如果滴定速度过慢,可能导致所测结果
,滴定过程中,如果滴定速度过慢,可能导致所测结果
您最近一年使用:0次
2023-12-21更新
|
94次组卷
|
2卷引用:安徽省淮北市树人高级中学2023-2024学年高二下学期开学考试化学试题



