1 . 将35.8gNa2CO3和NaHCO3的固体混合物溶于足量水中,向其中逐滴加入1mol·L-1的盐酸至不再产生气体为止,测得共产生CO28.96L(标准状况)(气体溶解忽略不计)。回答下列问题:
(1)原混合物中Na2CO3为___________ g。
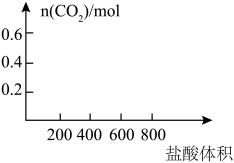
(2)若以滴加盐酸的体积为V(mL),产生气体的物质的量为n(mol),建立n=f(V)的函数关系,将V在不同取值范围时,n=f(V)的关系式填入下表并作图。
___________
(1)原混合物中Na2CO3为
(2)若以滴加盐酸的体积为V(mL),产生气体的物质的量为n(mol),建立n=f(V)的函数关系,将V在不同取值范围时,n=f(V)的关系式填入下表并作图。
| V的取值范围 | n=f(V) |
您最近一年使用:0次
名校
2 . 硝酸与金属的反应
①先将5.6克铁粉与200mL一定浓度的稀硝酸混合使其充分反应,固体完全溶解,并收集到气体VL(已折算为标准状况);
②往反应后的溶液中加入一定量铜粉,铜粉恰好完全溶解,且溶解过程中无气泡产生;
③继续往溶液中加入足量NaOH溶液并过滤,将滤渣充分加热后得共到12g固体X.
回答下列问题:
(1)①中产生的气体为______ ,其体积为______ (标况下),写出产生该气体的化学方程式______ 。
(2)铜粉的质量为______ 写出铜粉溶解的离子方程式______ 。
(3)固体X中主要成分的物质的量之比为______ 。
①先将5.6克铁粉与200mL一定浓度的稀硝酸混合使其充分反应,固体完全溶解,并收集到气体VL(已折算为标准状况);
②往反应后的溶液中加入一定量铜粉,铜粉恰好完全溶解,且溶解过程中无气泡产生;
③继续往溶液中加入足量NaOH溶液并过滤,将滤渣充分加热后得共到12g固体X.
回答下列问题:
(1)①中产生的气体为
(2)铜粉的质量为
(3)固体X中主要成分的物质的量之比为
您最近一年使用:0次
3 . 制取SO2的方程式为: ,将12.6g Na2SO3与足量浓硫酸反应,求制得标准状况下SO2的体积
,将12.6g Na2SO3与足量浓硫酸反应,求制得标准状况下SO2的体积
您最近一年使用:0次
名校
解题方法
4 . 填空
(1)0.3molD2O中所含中子数与_____ 克H2O分子中所含电子数相等。
(2)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的摩尔质量是_____ ;A的相对原子质量是_____ 。
(3)在无土栽培中,配制1L内含0.5mol 、0.64molCl-、0.56molK+、
、0.64molCl-、0.56molK+、_____ mol 的某中性营养液,若用KCl、NH4Cl、
的某中性营养液,若用KCl、NH4Cl、_____ 配制,则需这三种固体的物质的量分别为0.56mol、0.08mol、_____ mol。
(4)现有一定条件下CO2和H2O的混合气体37.5g,通过足量的Na2O2固体后,剩余的气体在标准状况的体积为11.2L,则:混合气体中CO2的物质的量为_____ mol,混合气体中H2O的质量为_____ g。
(5)Na2O和Na2O2的混合物14g和足量的水反应,得到300mL溶液,其中含溶质16g。原混合物中Na2O和Na2O2的质量分别多少_____ 。
(1)0.3molD2O中所含中子数与
(2)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的摩尔质量是
(3)在无土栽培中,配制1L内含0.5mol
 、0.64molCl-、0.56molK+、
、0.64molCl-、0.56molK+、 的某中性营养液,若用KCl、NH4Cl、
的某中性营养液,若用KCl、NH4Cl、(4)现有一定条件下CO2和H2O的混合气体37.5g,通过足量的Na2O2固体后,剩余的气体在标准状况的体积为11.2L,则:混合气体中CO2的物质的量为
(5)Na2O和Na2O2的混合物14g和足量的水反应,得到300mL溶液,其中含溶质16g。原混合物中Na2O和Na2O2的质量分别多少
您最近一年使用:0次
名校
解题方法
5 . 完成下列小题
(1) 溶液含中,含
溶液含中,含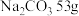 ,则该溶液中
,则该溶液中 的物质的量浓度
的物质的量浓度_____  。
。
(2)对于反应: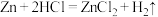 ,现有
,现有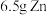 放入
放入 的
的 溶液中充分反应后,溶液中存在的溶质有
溶液中充分反应后,溶液中存在的溶质有_____ 。
(3)对于反应: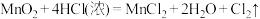 。
。
①用双线桥法表示上述反应电子转移的方向和数目_____ 。
②上述反应中还原剂是_____ ,若该反应有中有 电子转移,实际参加反应的
电子转移,实际参加反应的 质量
质量_____ g,生成氯在气在STP时体积是_____ L。
③若使用浓盐酸的质量分数0.365、密度 ,该浓盐酸物质的量浓度是
,该浓盐酸物质的量浓度是_____  。
。
(1)
 溶液含中,含
溶液含中,含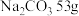 ,则该溶液中
,则该溶液中 的物质的量浓度
的物质的量浓度 。
。(2)对于反应:
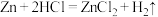 ,现有
,现有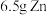 放入
放入 的
的 溶液中充分反应后,溶液中存在的溶质有
溶液中充分反应后,溶液中存在的溶质有(3)对于反应:
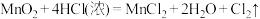 。
。①用双线桥法表示上述反应电子转移的方向和数目
②上述反应中还原剂是
 电子转移,实际参加反应的
电子转移,实际参加反应的 质量
质量③若使用浓盐酸的质量分数0.365、密度
 ,该浓盐酸物质的量浓度是
,该浓盐酸物质的量浓度是 。
。
您最近一年使用:0次
6 . 将质量为15g锌片浸入100.2克硫酸铜溶液中,一段时间后,取出锌片,洗涤、干燥、称量,锌片的质量为14.8克。(写出计算过程)
(1)生成铜的质量为多少?_______
(2)剩余的溶液中生成硫酸锌的质量分数为多少?_________
(1)生成铜的质量为多少?
(2)剩余的溶液中生成硫酸锌的质量分数为多少?
您最近一年使用:0次
解题方法
7 . 回答下列问题:
(1)合成气(CO、H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。工业上用CO和H2合成CH3OH: △H。则该反应的平衡常数表达式为
△H。则该反应的平衡常数表达式为_______ ;
(2)测得不同温度下反应的平衡常数 如下表:
如下表:
下列说法错误的是_______。
(3)工业上,利用水煤气法制取合成气,其中发生的一步反应为:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知
CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知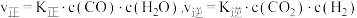 (k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数
(k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数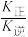 =
=_______ 。
(4)以天然气为原料生产合成气也有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
①T℃下,该反应的平衡常数K=_______ 。
②实验1中,CO的平衡体积分数为_______ %(保留三位有效数字)。
③V1:V2=_______ 。
(1)合成气(CO、H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。工业上用CO和H2合成CH3OH:
 △H。则该反应的平衡常数表达式为
△H。则该反应的平衡常数表达式为(2)测得不同温度下反应的平衡常数
 如下表:
如下表:| 温度/℃ | T1 | 100 | T2 | 200 | 300 |
| 平衡常数K | 100 | 13 | 1 | 1.9×10-2 | 2.4×10-4 |
| A.△H<0 |
| B.该反应的ΔS<0 |
| C.T2时,某时刻1L容器中含0.1mol CO、0.2mol H2和0.3mol CH3OH,此时v正>v逆 |
| D.T1时,向1L密闭容器中投入0.1mol CO和0.2mol H2,平衡时CO转化率为50% |
 CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知
CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知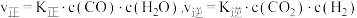 (k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数
(k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数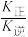 =
=(4)以天然气为原料生产合成气也有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:| 实验编号 | 容器体积 | 物质浓度/mol·L-1 | ||
| CH4 | CO2 | CO | ||
| 1 | V1 | 0.02 | 0.02 | 0.10 |
| 2 | V2 | x | x | 0.05 |
②实验1中,CO的平衡体积分数为
③V1:V2=
您最近一年使用:0次
8 . 工业上通常采用将氯气通入消石灰或石灰乳的方法制取漂白粉。消石灰要含略少于1%(质量分数)的水,因为极为干燥的消石灰是不跟氯气反应的。生产漂白粉的反应过程比较复杂,可发生如下反应:
①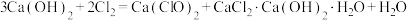 ;
;
②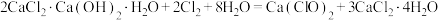 。
。
回答下列问题:
(1) 的摩尔质量为
的摩尔质量为__________ , 中质量分数最大的元素为
中质量分数最大的元素为__________ (填元素符号)。
(2)所含氢原子总数为 的
的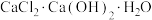 的物质的量为
的物质的量为__________ ,该化合物中Ca元素的物质的量为__________ 。
(3)反应②中,每转移 电子,此时消耗
电子,此时消耗 的体积约为
的体积约为__________ (标准状况下)。
(4)同温同压下,氯化氢与氯气两种气体的密度之比为__________ 。
①
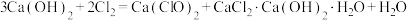 ;
;②
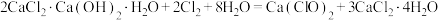 。
。回答下列问题:
(1)
 的摩尔质量为
的摩尔质量为 中质量分数最大的元素为
中质量分数最大的元素为(2)所含氢原子总数为
 的
的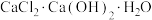 的物质的量为
的物质的量为(3)反应②中,每转移
 电子,此时消耗
电子,此时消耗 的体积约为
的体积约为(4)同温同压下,氯化氢与氯气两种气体的密度之比为
您最近一年使用:0次
9 . 物质的量在计算中有着举足轻重的地位。请根据物质的量的相关概念和公式,完成下列各题。
(1)等质量的 和
和 的物质的量之比为
的物质的量之比为__________ ,所含氢原子数之比为__________ 。
(2)标准状况下,在一体积可变的密闭容器中充有 由CO和
由CO和 组成的混合气体,该混合气体的体积为
组成的混合气体,该混合气体的体积为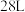 ,则该混合气体的平均摩尔质量为
,则该混合气体的平均摩尔质量为__________  ,CO、
,CO、 的体积比为
的体积比为__________ 。若将该混合气体在点燃条件下充分反应后,恢复到标准状况下,此时容器内的物质为__________ (填“纯净物”或“混合物”),体积为__________ L。
(3)把标准状况下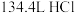 气体溶于
气体溶于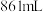 水中,所得溶液的密度为
水中,所得溶液的密度为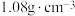 ,则此溶液的物质的量浓度为
,则此溶液的物质的量浓度为__________  。
。
(1)等质量的
 和
和 的物质的量之比为
的物质的量之比为(2)标准状况下,在一体积可变的密闭容器中充有
 由CO和
由CO和 组成的混合气体,该混合气体的体积为
组成的混合气体,该混合气体的体积为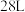 ,则该混合气体的平均摩尔质量为
,则该混合气体的平均摩尔质量为 ,CO、
,CO、 的体积比为
的体积比为(3)把标准状况下
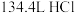 气体溶于
气体溶于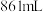 水中,所得溶液的密度为
水中,所得溶液的密度为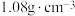 ,则此溶液的物质的量浓度为
,则此溶液的物质的量浓度为 。
。
您最近一年使用:0次
解题方法
10 . SO2在生产生活中有重要的应用,处理不当会造成环境污染。回答下列问题:
(1)标准状况下16.0gSO2的体积为______ L,与______ molH2O中所含氧原子数相等。
(2)为测定某工厂废气中SO2的含量,课外小组的同学将废气样品经过管道通入密闭容器中的100mL0.1000mol•L-1的酸性高锰酸钾溶液。反应原理为:5SO2+2MnO +2H2O=5SO
+2H2O=5SO +2Mn2++4H+。
+2Mn2++4H+。
①该反应中被还原的元素是_____ 。
②100mL该酸性高锰酸钾溶液恰好完全反应时,转移电子的数目为______ 。
③若通入管道的废气样品为am3时,酸性高锰酸钾溶液恰好褪色,则该废气样品中SO2的含量为______ g•m-3(用含a的表达式表示,假定样品中其它气体均不参与反应,SO2可被溶液充分吸收)。
④实验需240mL0.500mol•L-1的硫酸溶液,使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、_____ ;需用量筒量取密度为1.84g•cm-3,质量分数为98%的浓硫酸_____ mL;若定容时俯视刻度线,则所配溶液的浓度______ (填“偏高”、“偏低”或“不变”)。
(1)标准状况下16.0gSO2的体积为
(2)为测定某工厂废气中SO2的含量,课外小组的同学将废气样品经过管道通入密闭容器中的100mL0.1000mol•L-1的酸性高锰酸钾溶液。反应原理为:5SO2+2MnO
 +2H2O=5SO
+2H2O=5SO +2Mn2++4H+。
+2Mn2++4H+。①该反应中被还原的元素是
②100mL该酸性高锰酸钾溶液恰好完全反应时,转移电子的数目为
③若通入管道的废气样品为am3时,酸性高锰酸钾溶液恰好褪色,则该废气样品中SO2的含量为
④实验需240mL0.500mol•L-1的硫酸溶液,使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、
您最近一年使用:0次



