1 . 数学计算令人头大,物理公式也难拿下,化学计算数字不大,得个高分不在话下。请认真完成以下计算,让化学成绩为你舔砖加瓦。
(1)常温下,0.05mol/L硫酸溶液中,C(H+)=___________ mol/L
(2)某温度,纯水中C(H+)=3×10-7mol/L,则:纯水中C(OH-)=___________ mol/L,此时温度___________ (填“高于”“低于”或“等于”)25℃。若温度不变,滴入盐酸后C(H+)=5×10-4mol/L,则溶液中C(OH-)=___________ mol/L,由水电离的C(H+)=___________ mol/L。
(3)室温下,pH=3的盐酸与pH=5的H2SO4溶液等体积混合(忽略体积变化),混合溶液的pH=___________ 。
(4)常温向水中加入少量碳酸钠固体,得到pH为11的溶液,溶液中c(OH-)=_____ mol·L-1。
(1)常温下,0.05mol/L硫酸溶液中,C(H+)=
(2)某温度,纯水中C(H+)=3×10-7mol/L,则:纯水中C(OH-)=
(3)室温下,pH=3的盐酸与pH=5的H2SO4溶液等体积混合(忽略体积变化),混合溶液的pH=
(4)常温向水中加入少量碳酸钠固体,得到pH为11的溶液,溶液中c(OH-)=
您最近一年使用:0次
名校
2 . 2SO2(g)+O2(g) 2SO3(g) ΔH反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-98 kJ/mol。回答下列问题:
2SO3(g) ΔH反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-98 kJ/mol。回答下列问题:
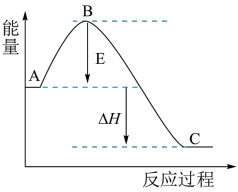
(1)图中A、表示:_____ (填“反应物能量”或“生成物能量 ”)。E的大小对该反应的反应热有无影响?_______ 。该反应通常用V2O5作催化剂,加V2O5会使图中B点_____ (填“升高” “降低”)。
(2)图中ΔH=________ kJ/mol。
(3)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的总反应的ΔH=________ kJ/mol。
(4)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,表示氢气燃烧热的热化学方程式是_________
(5)已知中和热ΔH=-57.3kJ·mol-1,0.5 mol Ba(OH)2和0.5 molH2SO4的反应热ΔH_______ (填“>”“=”或“<”)-57.3kJ·mol-1
 2SO3(g) ΔH反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-98 kJ/mol。回答下列问题:
2SO3(g) ΔH反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-98 kJ/mol。回答下列问题:
(1)图中A、表示:
(2)图中ΔH=
(3)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的总反应的ΔH=
(4)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,表示氢气燃烧热的热化学方程式是
(5)已知中和热ΔH=-57.3kJ·mol-1,0.5 mol Ba(OH)2和0.5 molH2SO4的反应热ΔH
您最近一年使用:0次
2023-02-21更新
|
255次组卷
|
2卷引用:新疆塔城地区第一高级中学2023-2024学年高二上学期9月月考化学试题
名校
解题方法
3 . 计算(要有计算过程)
(1)常温常压下,用等质量的 、
、 、
、 三种气体分别吹出三个气球,求三个气球的体积之比为
三种气体分别吹出三个气球,求三个气球的体积之比为______ 。
(2)把 溶液和
溶液和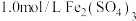 溶液各0.5L混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量的铁粉,经过足够长的时间后,铁粉有剩余。求此时溶液中
溶液各0.5L混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量的铁粉,经过足够长的时间后,铁粉有剩余。求此时溶液中 的物质的量浓度
的物质的量浓度___________ 。
(3)某种胃药的有效成分为碳酸钠,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠反应):
①向一粒研碎后的药片(0.10g)中加入20.00ml蒸馏水;
②配置 稀盐酸和
稀盐酸和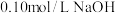 溶液;
溶液;
③加入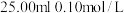 稀盐酸;
稀盐酸;
④用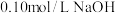 溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;
溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;
某同学4次测定所消耗的NaOH溶液的体积如下:
根据这个同学的实验数据,计算这种药片中碳酸钙的质量分数_________ 。
(1)常温常压下,用等质量的
 、
、 、
、 三种气体分别吹出三个气球,求三个气球的体积之比为
三种气体分别吹出三个气球,求三个气球的体积之比为(2)把
 溶液和
溶液和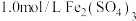 溶液各0.5L混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量的铁粉,经过足够长的时间后,铁粉有剩余。求此时溶液中
溶液各0.5L混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量的铁粉,经过足够长的时间后,铁粉有剩余。求此时溶液中 的物质的量浓度
的物质的量浓度(3)某种胃药的有效成分为碳酸钠,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠反应):
①向一粒研碎后的药片(0.10g)中加入20.00ml蒸馏水;
②配置
 稀盐酸和
稀盐酸和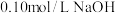 溶液;
溶液;③加入
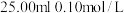 稀盐酸;
稀盐酸;④用
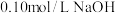 溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;
溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;某同学4次测定所消耗的NaOH溶液的体积如下:
| 测定次数 | 第一次 | 第二次 | 第三次 | 第四次 |
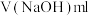 | 13.00 | 12.90 | 13.10 | 13.50 |
您最近一年使用:0次
名校
解题方法
4 . 125g黄铜(铜锌合金)粉末可以跟250g硫酸溶液恰好完全反应,称得未溶物质量为92.5g。(可能涉及到元素的相对原子质量:Zn65 H1 S32 O16 Cu64)
(1)写出该反应的化学方程式_______ 。
(2)若将反应后的溶液蒸发1g水,温度降到室温,溶液正好饱和。求在室温时硫酸锌的溶解度_______ 。
(1)写出该反应的化学方程式
(2)若将反应后的溶液蒸发1g水,温度降到室温,溶液正好饱和。求在室温时硫酸锌的溶解度
您最近一年使用:0次
名校
解题方法
5 . 某温度时,在0.5L密闭容器中,某一可逆反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析可得:

(1)该可逆反应的化学方程式为_______ 。
(2)若降低温度,则该反应的正反应速率_______ (填“加快”“减慢”或“不变”,下同), 若缩小体积加压,正反应速率_______ 。
(3)第8min时,正、逆反应速率的大小关系为v正_______ (填“>” “<”或“=”)v逆。
(4)0~4 min内,用B的浓度变化来表示该反应的平均反应速率为_______ mol·L-1·min-1
(5)能判断该反应在一定温 度下达到化学平衡状态的依据是_______。
(6)平衡时A的转化率(反应中已消耗A的物质的量占反应起始时A物质的量的百分数)为_______ 。

(1)该可逆反应的化学方程式为
(2)若降低温度,则该反应的正反应速率
(3)第8min时,正、逆反应速率的大小关系为v正
(4)0~4 min内,用B的浓度变化来表示该反应的平均反应速率为
(5)能判断该反应在一定温 度下达到化学平衡状态的依据是_______。
| A.容器各组分浓度不变 |
| B.混合气体中A的物质的量不再改变 |
| C.容器中反应体系温度不再改变 |
| D.c(A)=c(B) |
您最近一年使用:0次
2022-05-08更新
|
459次组卷
|
2卷引用:新疆乌苏市第一中学2021-2022学年高一下学期期中考试化学试题(加强班)
名校
6 . 回答问题:
(1)常温下,浓度为0.005mol/L的 溶液pH值为
溶液pH值为___________ ; 的NaOH溶液中水电离出的心
的NaOH溶液中水电离出的心 为
为___________ mol/L。
(2)常温下, 的盐酸和
的盐酸和 的NaOH等体积混合,溶液的pH值为
的NaOH等体积混合,溶液的pH值为___________ ;求 的
的 溶液与
溶液与 的NaOH溶液的等体积混合,溶液的pH值为
的NaOH溶液的等体积混合,溶液的pH值为___________ 。
(3)在一定温度下,有以下三种酸:a.醋酸 b.硫酸 c.盐酸
①当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是___________ 。(用a、b、c表示,下同)。
②当三种酸的pH相同、体积相同时,分别加入足量的锌,产生H2的体积(相同状况)由大到小的顺序为___________ 。
(1)常温下,浓度为0.005mol/L的
 溶液pH值为
溶液pH值为 的NaOH溶液中水电离出的心
的NaOH溶液中水电离出的心 为
为(2)常温下,
 的盐酸和
的盐酸和 的NaOH等体积混合,溶液的pH值为
的NaOH等体积混合,溶液的pH值为 的
的 溶液与
溶液与 的NaOH溶液的等体积混合,溶液的pH值为
的NaOH溶液的等体积混合,溶液的pH值为(3)在一定温度下,有以下三种酸:a.醋酸 b.硫酸 c.盐酸
①当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是
②当三种酸的pH相同、体积相同时,分别加入足量的锌,产生H2的体积(相同状况)由大到小的顺序为
您最近一年使用:0次
2022-03-15更新
|
270次组卷
|
2卷引用:新疆乌苏市第一中学2021-2022学年高二12月月考化学试题
名校
7 . 设 表示阿伏加德罗常数的值,请回答下列问题:
表示阿伏加德罗常数的值,请回答下列问题:
(1) 个
个 约含有1
约含有1
 ,其质量为
,其质量为___________ g。
(2)0.5
 在标准状况下的气体体积
在标准状况下的气体体积_________ L。
(3)相同物质的量的 和
和 的质量比
的质量比________ ,所含氧原子的个数比为________ 。
(4)0.1
 固体溶解后配制成100
固体溶解后配制成100 溶液,其物质的量浓度为
溶液,其物质的量浓度为________  ,取出10
,取出10 该溶液,它的物质的量浓度为
该溶液,它的物质的量浓度为________  ,将取出的10
,将取出的10 溶液加水稀释至100
溶液加水稀释至100 ,其中物质的量浓度
,其中物质的量浓度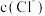 变为
变为________  。
。
 表示阿伏加德罗常数的值,请回答下列问题:
表示阿伏加德罗常数的值,请回答下列问题:(1)
 个
个 约含有1
约含有1
 ,其质量为
,其质量为(2)0.5

 在标准状况下的气体体积
在标准状况下的气体体积(3)相同物质的量的
 和
和 的质量比
的质量比(4)0.1

 固体溶解后配制成100
固体溶解后配制成100 溶液,其物质的量浓度为
溶液,其物质的量浓度为 ,取出10
,取出10 该溶液,它的物质的量浓度为
该溶液,它的物质的量浓度为 ,将取出的10
,将取出的10 溶液加水稀释至100
溶液加水稀释至100 ,其中物质的量浓度
,其中物质的量浓度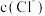 变为
变为 。
。
您最近一年使用:0次
名校
解题方法
8 . 向10 mL某浓度的AlCl3溶液中滴加1.5 mol·L-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
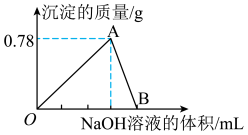
(1)图中B点溶液中的溶质有________________ 。
(2)O点到B点反应的总离子方程式可表示为________________ 。
(3)反应至A点时消耗NaOH溶液的体积为______________ 。
(4)AlCl3溶液的浓度为______________ 。

(1)图中B点溶液中的溶质有
(2)O点到B点反应的总离子方程式可表示为
(3)反应至A点时消耗NaOH溶液的体积为
(4)AlCl3溶液的浓度为
您最近一年使用:0次



