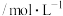1 . X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6;Y元素是动植物生长不可缺少的、构成蛋白质的重要组成元素;Z的基态原子核外9个原子轨道上填充了电子且有2个未成对电子,与X不同族;W是一种常见元素,可以形成一种具有磁性的黑色晶体氧化物。
(1)写出下列元素的名称:X__________ ,Y__________ ,Z__________ 。
(2)X—H和Y—H属于极性共价键,其中极性较强的是________ (X、Y用元素符号表示)。X的第一电离能比Y的________ (填“大”或“小”)。
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:_______________ 。
(4)W的基态原子的价层电子排布式为_________________ 。
(5)Y元素的核外电子轨道表达式为________________ 。
(1)写出下列元素的名称:X
(2)X—H和Y—H属于极性共价键,其中极性较强的是
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:
(4)W的基态原子的价层电子排布式为
(5)Y元素的核外电子轨道表达式为
您最近一年使用:0次
名校
解题方法
2 . 氯元素可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备 (
( 与KOH溶液加热条件下制得)和NaClO,并探究其氧化、还原性质。
与KOH溶液加热条件下制得)和NaClO,并探究其氧化、还原性质。
(1)盛放 粉末的仪器名称是
粉末的仪器名称是______ ,a中的试剂为_______ 。
(2)b中采用的加热方式是_______ ,c中化学反应的离子方程式是_____ ,采用冰水浴冷却的目的是_____ 。
(3)d的作用是____ ,可选用试剂____ (填标号)。
A. B.NaCl C.NaOH D.
B.NaCl C.NaOH D.
(4)反应结束后,取出b中试管,经冷却结晶,_______ ,______ ,干燥,得到 晶体。
晶体。
(5)取少量 和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入
和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入 振荡,静置后
振荡,静置后 层显
层显____ 色。可知该条件下 的氧化能力
的氧化能力_____ NaClO(填“大于”或“小于”)。
 (
( 与KOH溶液加热条件下制得)和NaClO,并探究其氧化、还原性质。
与KOH溶液加热条件下制得)和NaClO,并探究其氧化、还原性质。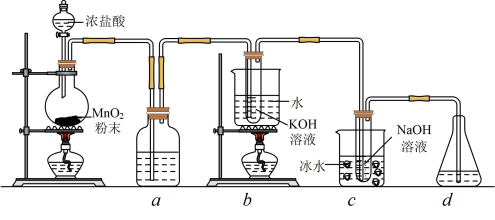
(1)盛放
 粉末的仪器名称是
粉末的仪器名称是(2)b中采用的加热方式是
(3)d的作用是
A.
 B.NaCl C.NaOH D.
B.NaCl C.NaOH D.
(4)反应结束后,取出b中试管,经冷却结晶,
 晶体。
晶体。(5)取少量
 和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入
和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入 振荡,静置后
振荡,静置后 层显
层显 的氧化能力
的氧化能力
您最近一年使用:0次
名校
3 . 碱式碳酸铜在烟火、农药、颜料、杀菌剂等方面应用广泛。
Ⅰ.碱式碳酸铜的制备
①步骤ⅱ中发生的化学反应方程式为_____ 。
②原料中 必须过量的原因是在反应中提供碱性环境,其水溶液呈碱性的原因
必须过量的原因是在反应中提供碱性环境,其水溶液呈碱性的原因_____ (用离子方程式表示)。
③步骤ⅱ中反应温度低于80℃的原因是_____ 。
(2)在步骤(ⅲ)的实验过程中,涉及三种固液分离的方法,分别是倾析法过滤(把上层清液直接倾入另一容器中,让沉淀尽可能留在烧杯内)、趁热过滤与减压过滤,最终制得蓝绿色固体。该实验流程中会使用到的下列装置有_____ (填序号);
同学们设计了如图装置,针对制得的蓝绿色固体进行检验。 ,点燃D处酒精灯。C中盛装的试剂应是
,点燃D处酒精灯。C中盛装的试剂应是_____ ;
(4)若蓝绿色固体的组成为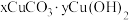 ,实验能观察到的现象是:D中现象为
,实验能观察到的现象是:D中现象为_____ ,E中现象为_____ ,F中现象为_____ 。
(5)同学们查阅文献得知: ,
,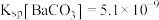 ,经讨论认为用
,经讨论认为用 代替
代替 来定量测定蓝绿色固体的化学式会更好,其原因是
来定量测定蓝绿色固体的化学式会更好,其原因是_____ (填序号);
a. 的碱性比
的碱性比 强
强
b.吸收等量 生成的
生成的 的质量大于
的质量大于 ,测量误差小
,测量误差小
c.相同条件下, 的溶解度明显大于
的溶解度明显大于
d. 溶解度大于
溶解度大于 ,能充分吸收
,能充分吸收
(6)若蓝绿色固体的组成为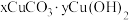 。取干燥后的蓝绿色固体10.84g,煅烧至完全分解后得到8.00g固体,测得F中干燥后的沉淀质量为7.88g[F中已改为
。取干燥后的蓝绿色固体10.84g,煅烧至完全分解后得到8.00g固体,测得F中干燥后的沉淀质量为7.88g[F中已改为 溶液,
溶液, 的相对分子质量为197]。则该蓝绿色固体的化学式为
的相对分子质量为197]。则该蓝绿色固体的化学式为_____ 。
Ⅰ.碱式碳酸铜的制备

①步骤ⅱ中发生的化学反应方程式为
②原料中
 必须过量的原因是在反应中提供碱性环境,其水溶液呈碱性的原因
必须过量的原因是在反应中提供碱性环境,其水溶液呈碱性的原因③步骤ⅱ中反应温度低于80℃的原因是
(2)在步骤(ⅲ)的实验过程中,涉及三种固液分离的方法,分别是倾析法过滤(把上层清液直接倾入另一容器中,让沉淀尽可能留在烧杯内)、趁热过滤与减压过滤,最终制得蓝绿色固体。该实验流程中会使用到的下列装置有
同学们设计了如图装置,针对制得的蓝绿色固体进行检验。
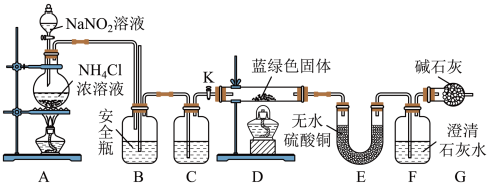
 ,点燃D处酒精灯。C中盛装的试剂应是
,点燃D处酒精灯。C中盛装的试剂应是(4)若蓝绿色固体的组成为
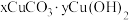 ,实验能观察到的现象是:D中现象为
,实验能观察到的现象是:D中现象为(5)同学们查阅文献得知:
 ,
,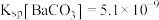 ,经讨论认为用
,经讨论认为用 代替
代替 来定量测定蓝绿色固体的化学式会更好,其原因是
来定量测定蓝绿色固体的化学式会更好,其原因是a.
 的碱性比
的碱性比 强
强b.吸收等量
 生成的
生成的 的质量大于
的质量大于 ,测量误差小
,测量误差小c.相同条件下,
 的溶解度明显大于
的溶解度明显大于
d.
 溶解度大于
溶解度大于 ,能充分吸收
,能充分吸收
(6)若蓝绿色固体的组成为
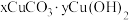 。取干燥后的蓝绿色固体10.84g,煅烧至完全分解后得到8.00g固体,测得F中干燥后的沉淀质量为7.88g[F中已改为
。取干燥后的蓝绿色固体10.84g,煅烧至完全分解后得到8.00g固体,测得F中干燥后的沉淀质量为7.88g[F中已改为 溶液,
溶液, 的相对分子质量为197]。则该蓝绿色固体的化学式为
的相对分子质量为197]。则该蓝绿色固体的化学式为
您最近一年使用:0次
名校
解题方法
4 . 下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。针对表中①~⑩号元素回答下列问题。______ ,⑨元素的原子结构示意图为______ 。
(2)②、③、④、⑤、⑥这五种元素分别形成的简单离子中离子半径最小的是______ (填离子符号)。
(3)镓(Ga)与⑥同主族,其氢氧化物为两性氢氧化物,请写出氢氧化镓与NaOH反应的化学方程式______ 。
(4)表中元素⑦和⑩的最高价氧化物对应水化物的酸性最强的是______ (填化学式)。
(5)元素④和⑥相比,金属性较强的是______ (填元素符号),下列能证明这一事实的有______ (填序号)。
A.在化合物中④的化合价比⑥的低
B.④的单质能与冷水剧烈反应而⑥的单质不能
C.④的最高价氧化物对应水化物的碱性比⑥强
D.④单质的熔点比⑥单质的低
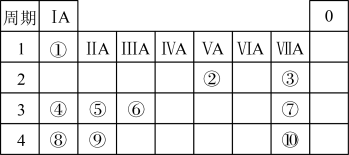
(2)②、③、④、⑤、⑥这五种元素分别形成的简单离子中离子半径最小的是
(3)镓(Ga)与⑥同主族,其氢氧化物为两性氢氧化物,请写出氢氧化镓与NaOH反应的化学方程式
(4)表中元素⑦和⑩的最高价氧化物对应水化物的酸性最强的是
(5)元素④和⑥相比,金属性较强的是
A.在化合物中④的化合价比⑥的低
B.④的单质能与冷水剧烈反应而⑥的单质不能
C.④的最高价氧化物对应水化物的碱性比⑥强
D.④单质的熔点比⑥单质的低
您最近一年使用:0次
名校
解题方法
5 . 为除去粗盐中的Ca2+、Mg2+、 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)______ 。
(2)第③步中,加入的试剂是______ (填化学式),判断该试剂已过量的方法是______ 。
(3)第③步和第②步______ (填“能”或“不能”)交换,原因是______ 。
(4)第④步中涉及反应的离子方程式______ 。
(5)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是______ 。
 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)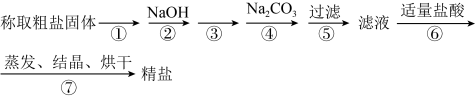
(2)第③步中,加入的试剂是
(3)第③步和第②步
(4)第④步中涉及反应的离子方程式
(5)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
您最近一年使用:0次
解题方法
6 . 回答下列问题:
(1)以 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 的反应为:
的反应为: ,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。____________ 转化为化学能。
②由图中信息经计算可知,2mol 发生光解反应生成2mol CO和1mol
发生光解反应生成2mol CO和1mol  需要
需要____________ (填“吸收”或“放出”)能量为____________ kJ。
(2)下列反应中属于吸热反应的是____________ 。(填字母)
a.盐酸与烧碱溶液反应 b. 与氯化铵固体反应
与氯化铵固体反应
c.盐酸与小苏打反应 d.镁和盐酸反应
(3)氢气被认为是21世纪替代矿物燃料的理想能源,每克 和汽油燃烧放出的热量分别为55kJ和46kJ。请分析氢气作为锌能源替代汽油的优势:
和汽油燃烧放出的热量分别为55kJ和46kJ。请分析氢气作为锌能源替代汽油的优势:
ⅰ. 为清洁能源,不污染环境;
为清洁能源,不污染环境;
ⅱ. 。
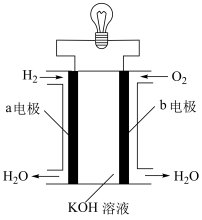
图中装置为氢氧燃料电池,回答下列问题: 向
向____________ 电极移动(填“a”或“b”);
②b电极上的反应式为_________________ 。当外电路中转移1mol电子时,a电极消耗的 在标准状况下体积为
在标准状况下体积为____________ L。
(4)“天宫1号”使用的蓄电池为镍氢电池,电解质为碱性溶液,该电池的总反应式为:
 。放电时,该电池的正极反应式为
。放电时,该电池的正极反应式为________ ,该电极附近溶液pH将_____ (填“增大”、“减小”或“不变”)。
(1)以
 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 的反应为:
的反应为: ,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。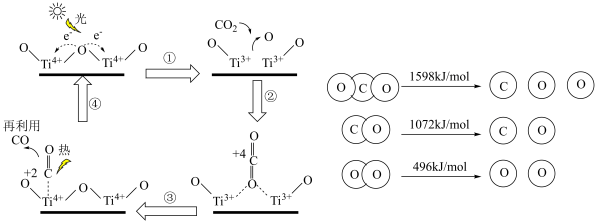
②由图中信息经计算可知,2mol
 发生光解反应生成2mol CO和1mol
发生光解反应生成2mol CO和1mol  需要
需要(2)下列反应中属于吸热反应的是
a.盐酸与烧碱溶液反应 b.
 与氯化铵固体反应
与氯化铵固体反应c.盐酸与小苏打反应 d.镁和盐酸反应
(3)氢气被认为是21世纪替代矿物燃料的理想能源,每克
 和汽油燃烧放出的热量分别为55kJ和46kJ。请分析氢气作为锌能源替代汽油的优势:
和汽油燃烧放出的热量分别为55kJ和46kJ。请分析氢气作为锌能源替代汽油的优势:ⅰ.
 为清洁能源,不污染环境;
为清洁能源,不污染环境;ⅱ. 。
图中装置为氢氧燃料电池,回答下列问题:
 向
向②b电极上的反应式为
 在标准状况下体积为
在标准状况下体积为(4)“天宫1号”使用的蓄电池为镍氢电池,电解质为碱性溶液,该电池的总反应式为:

 。放电时,该电池的正极反应式为
。放电时,该电池的正极反应式为
您最近一年使用:0次
解题方法
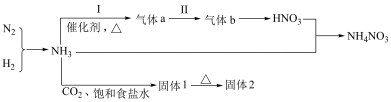
7 . 合成氨及其衍生工业是化工生产的重要门类,其部分衍生工业如下图所示。
(1)写出反应Ⅰ的化学方程式______________ 。“固体2”俗名为____________ 。
(2)将一定质量的Cu粉投入到400mL 2mol/L的稀硝酸中,待Cu粉完全溶解时,收集到标准状况下的NO气体2.24L(假设硝酸的还原产物只有NO且气体全部逸出),再向反应后的溶液中缓慢加入Fe粉,充分反应后,最终溶液中只有一种溶质。
①写出Cu与稀硝酸反应的离子方程式________________ 。最初的Cu粉质量为__________ g。
②加入铁粉后,最终溶液的溶质是_________ (填化学式),至少需要加入铁粉为________ g。
(1)写出反应Ⅰ的化学方程式
(2)将一定质量的Cu粉投入到400mL 2mol/L的稀硝酸中,待Cu粉完全溶解时,收集到标准状况下的NO气体2.24L(假设硝酸的还原产物只有NO且气体全部逸出),再向反应后的溶液中缓慢加入Fe粉,充分反应后,最终溶液中只有一种溶质。
①写出Cu与稀硝酸反应的离子方程式
②加入铁粉后,最终溶液的溶质是
您最近一年使用:0次
解题方法
8 . 某工厂的固体废渣中主要含 和
和 ,还含有少量
,还含有少量 和
和 。
。
利用该固体废渣制取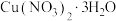 的部分工艺流程如图所示:
的部分工艺流程如图所示: 属于碱性氧化物;
属于碱性氧化物; 在酸性溶液中不稳定,会转变为
在酸性溶液中不稳定,会转变为 和
和 。
。
② 是酸性氧化物,难于水和酸。
是酸性氧化物,难于水和酸。
(1)若中和时加入的 恰好完全反应,则过滤后所得废渣的成分为
恰好完全反应,则过滤后所得废渣的成分为________ 。
(2) 与稀硝酸反应时,硝酸体现出的性质:
与稀硝酸反应时,硝酸体现出的性质:________ 。
(3)酸溶时,反应温度不宜超过 ,其主要原因是
,其主要原因是________ 。
(4)写出 与稀硝酸反应的离子方程式:
与稀硝酸反应的离子方程式:________ 。
(5)已知: 的溶解度曲线如图所示
的溶解度曲线如图所示 )为原料,制取
)为原料,制取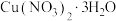 晶体的操作流程如下:
晶体的操作流程如下:
先向工业废水中加入 溶液,充分反应后,过滤,洗涤;向滤渣中加入稀硝酸至固体完全溶解,
溶液,充分反应后,过滤,洗涤;向滤渣中加入稀硝酸至固体完全溶解,_________ ,_________ ,(填操作名称)过滤,洗涤,干燥,即制得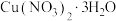 晶体。
晶体。
 和
和 ,还含有少量
,还含有少量 和
和 。
。利用该固体废渣制取
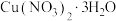 的部分工艺流程如图所示:
的部分工艺流程如图所示:
 属于碱性氧化物;
属于碱性氧化物; 在酸性溶液中不稳定,会转变为
在酸性溶液中不稳定,会转变为 和
和 。
。②
 是酸性氧化物,难于水和酸。
是酸性氧化物,难于水和酸。(1)若中和时加入的
 恰好完全反应,则过滤后所得废渣的成分为
恰好完全反应,则过滤后所得废渣的成分为(2)
 与稀硝酸反应时,硝酸体现出的性质:
与稀硝酸反应时,硝酸体现出的性质:(3)酸溶时,反应温度不宜超过
 ,其主要原因是
,其主要原因是(4)写出
 与稀硝酸反应的离子方程式:
与稀硝酸反应的离子方程式:(5)已知:
 的溶解度曲线如图所示
的溶解度曲线如图所示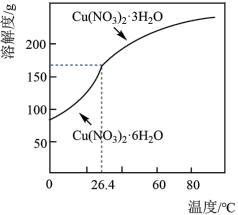
 )为原料,制取
)为原料,制取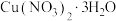 晶体的操作流程如下:
晶体的操作流程如下:先向工业废水中加入
 溶液,充分反应后,过滤,洗涤;向滤渣中加入稀硝酸至固体完全溶解,
溶液,充分反应后,过滤,洗涤;向滤渣中加入稀硝酸至固体完全溶解,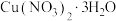 晶体。
晶体。
您最近一年使用:0次
解题方法
9 . 磷酸铁锂电池是以磷酸铁锂( )为正极材料的一种锂离子二次电池。一种由钛白副产物硫酸亚铁[主要成分为
)为正极材料的一种锂离子二次电池。一种由钛白副产物硫酸亚铁[主要成分为 ,还含有少量
,还含有少量 、
、 、
、 ]制备锂离子电池正极材料的前驱体
]制备锂离子电池正极材料的前驱体 的工艺流程如图所示:
的工艺流程如图所示: ,有关微粒浓度如下表所示:
,有关微粒浓度如下表所示:
②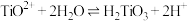 ,
, 时,
时, 沉淀完全。
沉淀完全。
③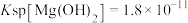
(1)为加快“酸溶”速率,可采取的措施有________ (写两点)。
(2)“除杂过滤”工序中,将 转化为
转化为 除去。加入铁粉的作用是
除去。加入铁粉的作用是______________ 。
(3)当 沉淀完全时,“滤渣”中是否含有
沉淀完全时,“滤渣”中是否含有 ?结合计算说明原因(忽略溶液体积的变化)
?结合计算说明原因(忽略溶液体积的变化)_______________ 。
(4)“结晶过滤”后从滤液中获得 的操作为
的操作为________ ,过滤。
(5)书写“氧化”时发生反应的离子方程式______________ 。
(6)工业上可以用电解磷铁渣(主要含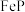 )的方法制备
)的方法制备 ,电解原理如图所示,溶液中的
,电解原理如图所示,溶液中的 向
向________ 极移动(填“石墨”或“磷铁渣”);生成 的电极反应式为
的电极反应式为______________ 。
 )为正极材料的一种锂离子二次电池。一种由钛白副产物硫酸亚铁[主要成分为
)为正极材料的一种锂离子二次电池。一种由钛白副产物硫酸亚铁[主要成分为 ,还含有少量
,还含有少量 、
、 、
、 ]制备锂离子电池正极材料的前驱体
]制备锂离子电池正极材料的前驱体 的工艺流程如图所示:
的工艺流程如图所示: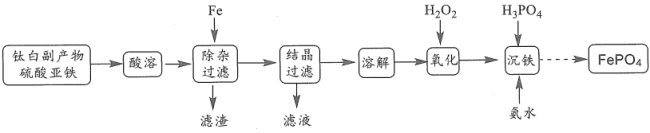
 ,有关微粒浓度如下表所示:
,有关微粒浓度如下表所示:微粒 |
|
|
浓度 | 0.0043 | 0.07 |
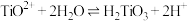 ,
, 时,
时, 沉淀完全。
沉淀完全。③
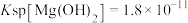
(1)为加快“酸溶”速率,可采取的措施有
(2)“除杂过滤”工序中,将
 转化为
转化为 除去。加入铁粉的作用是
除去。加入铁粉的作用是(3)当
 沉淀完全时,“滤渣”中是否含有
沉淀完全时,“滤渣”中是否含有 ?结合计算说明原因(忽略溶液体积的变化)
?结合计算说明原因(忽略溶液体积的变化)(4)“结晶过滤”后从滤液中获得
 的操作为
的操作为(5)书写“氧化”时发生反应的离子方程式
(6)工业上可以用电解磷铁渣(主要含
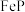 )的方法制备
)的方法制备 ,电解原理如图所示,溶液中的
,电解原理如图所示,溶液中的 向
向 的电极反应式为
的电极反应式为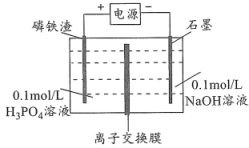
您最近一年使用:0次
解题方法
10 . I.某化学学习小组借助如图装置对浓硝酸的性质进行探究。_______ 后开始如下实验:将燃烧匙中的木炭在酒精灯上加热至红热状态,立即伸入三颈瓶中,并塞紧瓶塞滴加浓硝酸,可观察到瓶中产生红棕色的气体。
(2)装置C中盛有足量的Ba(OH)2溶液,反应一段时间后可观察到C中出现白色沉淀,该白色沉淀为_______ (写化学式)。
(3)装置D中收集到了无色气体,同学甲认为是NO,乙认为是O2,丙认为是NO和O2。
①甲、乙、丙三人的判断中肯定不合理的是_______ 。
②下列对该气体的检验方法合适的是_______ (填字母)。
A.敞口观察集气瓶内气体的颜色变化
B.将润湿的蓝色石蕊试纸伸入集气瓶内,观察试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
③如果集气瓶中收集到的无色气体是氧气,则氧气的来源是(用化学方程式表示)_______ 。
(4)将28.8g铜投入100mL浓硝酸中,最后铜有剩余,其NO 离子物质的量变化如图所示,请回答下列问题:
离子物质的量变化如图所示,请回答下列问题:_______ mol/L。
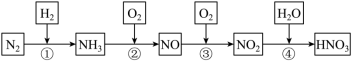
Ⅱ.硝酸在生产生活及国防建设中非常重要,工业制备硝酸的流程如下:_______ ,④反应中还原剂和氧化剂的物质的量之比为_______ 。
(6) 与稀硝酸反应的离子方程式为
与稀硝酸反应的离子方程式为_______ 。
(7)硝酸工厂产生的氮氧化物的尾气需处理后才能排放,可用 溶液吸收。主要反应为
溶液吸收。主要反应为 ,
,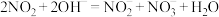 。下列措施能提高
。下列措施能提高 和
和 去除率的有(填字母)
去除率的有(填字母) _______ 。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
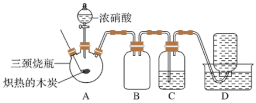
(2)装置C中盛有足量的Ba(OH)2溶液,反应一段时间后可观察到C中出现白色沉淀,该白色沉淀为
(3)装置D中收集到了无色气体,同学甲认为是NO,乙认为是O2,丙认为是NO和O2。
①甲、乙、丙三人的判断中肯定不合理的是
②下列对该气体的检验方法合适的是
A.敞口观察集气瓶内气体的颜色变化
B.将润湿的蓝色石蕊试纸伸入集气瓶内,观察试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
③如果集气瓶中收集到的无色气体是氧气,则氧气的来源是(用化学方程式表示)
(4)将28.8g铜投入100mL浓硝酸中,最后铜有剩余,其NO
 离子物质的量变化如图所示,请回答下列问题:
离子物质的量变化如图所示,请回答下列问题: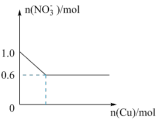
Ⅱ.硝酸在生产生活及国防建设中非常重要,工业制备硝酸的流程如下:
(6)
 与稀硝酸反应的离子方程式为
与稀硝酸反应的离子方程式为(7)硝酸工厂产生的氮氧化物的尾气需处理后才能排放,可用
 溶液吸收。主要反应为
溶液吸收。主要反应为 ,
,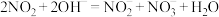 。下列措施能提高
。下列措施能提高 和
和 去除率的有(填字母)
去除率的有(填字母) A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
您最近一年使用:0次