名校
解题方法
1 . SiHCl3是制备半导体材料硅的重要原料,可由不同途径制备。
(1)由SiCl4制备SiHCl3:SiCl4(g)+H2(g)=SiHCl3(g)+HCl(g) △H1=+74.22kJ•mol-1(298K)
已知SiHCl3(g)+H2(g)=Si(s)+3HCl(g) △H2=+219.29kJ•mol-1(298K)
298K时,由SiCl4(g)+2H2(g)=Si(s)+4HCl(g)制备56g硅______ (填“吸”或“放”)热______ kJ。升高温度有利于制备硅的原因是_______ 。
(2)在催化剂作用下由粗硅制备SiHCl3:3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)。773K,2L密闭容器中,经不同方式处理的粗硅和催化剂混合物与3molSiCl4和4molH2气体反应,SiCl4转化率随时间的变化如图所示:
4SiHCl3(g)。773K,2L密闭容器中,经不同方式处理的粗硅和催化剂混合物与3molSiCl4和4molH2气体反应,SiCl4转化率随时间的变化如图所示:______ 处理后的反应速率最快;在此期间,经方式丙处理后的平均反应速率v(SiHCl3)=______ mol•L-1•min-1。
②当反应达平衡时,H2的浓度为______ mol•L-1,平衡常数K的计算式为______ 。
③增大容器体积,反应平衡向_______ 移动。
(1)由SiCl4制备SiHCl3:SiCl4(g)+H2(g)=SiHCl3(g)+HCl(g) △H1=+74.22kJ•mol-1(298K)
已知SiHCl3(g)+H2(g)=Si(s)+3HCl(g) △H2=+219.29kJ•mol-1(298K)
298K时,由SiCl4(g)+2H2(g)=Si(s)+4HCl(g)制备56g硅
(2)在催化剂作用下由粗硅制备SiHCl3:3SiCl4(g)+2H2(g)+Si(s)
 4SiHCl3(g)。773K,2L密闭容器中,经不同方式处理的粗硅和催化剂混合物与3molSiCl4和4molH2气体反应,SiCl4转化率随时间的变化如图所示:
4SiHCl3(g)。773K,2L密闭容器中,经不同方式处理的粗硅和催化剂混合物与3molSiCl4和4molH2气体反应,SiCl4转化率随时间的变化如图所示: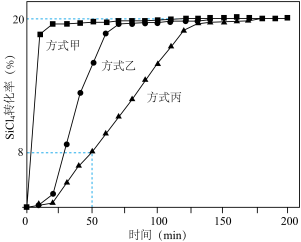
②当反应达平衡时,H2的浓度为
③增大容器体积,反应平衡向
您最近一年使用:0次
名校
解题方法
2 . IVA族元素具有丰富的化学性质,其化合物有着广泛的应用。回答下列问题:
(1)该族元素基态原子核外未成对电子数为_______ ,在与其他元素形成化合物时,呈现的最高化合价为_______ ;基态硅原子核外电子的空间运动状态有_______ 种。
(2)CaC2俗称电石,该化合物中不存在的化学键类型为______ (填标号)。
a.离子键 b.极性共价键 c.非极性共价键 d.配位键
(3)一种光刻胶薄膜成分为聚甲基硅烷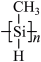 ,硅原子的杂化轨道类型为
,硅原子的杂化轨道类型为______ ,其中电负性最大的元素为______ ;已知电负性:H>Si,SiHCl3充分水解会生成两种酸和一种气体,写出该反应的化学方程式为______ 。
(4)键角:CH4______ H2O(填“>”、“<”或“=”),原因是______ 。H2O作为配体,形成[Cu(H2O)4]2+后H-O-H键角会______ (填“变大”、“变小”或“不变”)。
(5)早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如表,结合变化规律说明原因:_____ 。
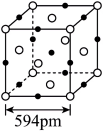
(6)结晶型PbS可作为放射性探测器元件材料,其立方晶胞如图所示。其中Pb的配位数为______ 。设NA为阿伏加德罗常数的值,则该晶体密度为______ g•cm-3 (列出计算式)。
(1)该族元素基态原子核外未成对电子数为
(2)CaC2俗称电石,该化合物中不存在的化学键类型为
a.离子键 b.极性共价键 c.非极性共价键 d.配位键
(3)一种光刻胶薄膜成分为聚甲基硅烷
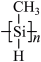 ,硅原子的杂化轨道类型为
,硅原子的杂化轨道类型为(4)键角:CH4
(5)早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如表,结合变化规律说明原因:
| 物质 | SnF4 | SnCl4 | SnBr4 | SnI4 |
| 熔点/℃ | 442 | -34 | 29 | 143 |
(6)结晶型PbS可作为放射性探测器元件材料,其立方晶胞如图所示。其中Pb的配位数为
您最近一年使用:0次
名校
3 . 黄酮哌酯是一种解痉药,可通过如下路线合成:
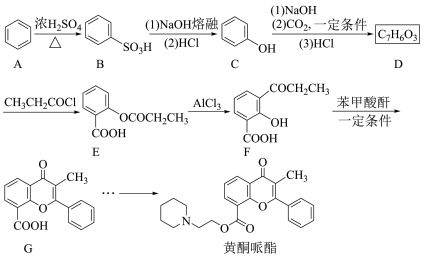
回答问题:
(1)A→B的反应类型为________ 。
(2)已知B为一元强酸,室温下B与 溶液反应的化学方程式为
溶液反应的化学方程式为________________ 。
(3)C的化学名称为________ ,D的结构简式为________ 。
(4)E和F可用________ (写出试剂)鉴别。
(5)X是F的同分异构体,符合下列条件,X可能的结构简式为________ (任写一种)。
①含有酯基 ②含有苯环 ③核磁共振氢谱有两组峰
(6)已知酸酐能与羟基化合物反应生成酯。写出下列F→G反应方程式中M和N的结构简式___________ 、____________ 。
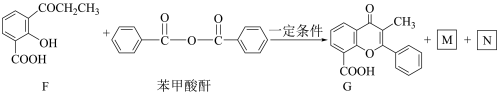
(7)参照题中信息补充完成设计路线:以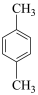 为原料合成
为原料合成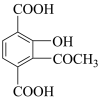 (其他试剂任选)。
(其他试剂任选)。
已知: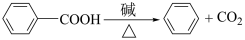

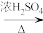
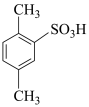

________________ 。

回答问题:
(1)A→B的反应类型为
(2)已知B为一元强酸,室温下B与
 溶液反应的化学方程式为
溶液反应的化学方程式为(3)C的化学名称为
(4)E和F可用
(5)X是F的同分异构体,符合下列条件,X可能的结构简式为
①含有酯基 ②含有苯环 ③核磁共振氢谱有两组峰
(6)已知酸酐能与羟基化合物反应生成酯。写出下列F→G反应方程式中M和N的结构简式

(7)参照题中信息补充完成设计路线:以
 为原料合成
为原料合成 (其他试剂任选)。
(其他试剂任选)。已知:
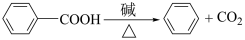

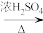


您最近一年使用:0次
名校
4 . 铁是人体必需的微量元素之一。黑木耳中的含铁量较高,为检验和测定干黑木耳样品中的铁元素,设计实验如下。回答下列问题:
Ⅰ.铁元素的检验

(1)“操作”是指________ ;上述流程中需要用到的仪器有托盘天平、烧杯、玻璃棒、酒精灯、漏斗,还有下图中的________ (填写仪器名称)。

(2)检验待测液中是否含有 、
、
Ⅱ.铁元素含量的测定
利用 标准溶液测定干黑木耳样品中铁元素的含量
标准溶液测定干黑木耳样品中铁元素的含量
步骤Ⅰ:取 待测液,加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
待测液,加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
步骤Ⅱ:向步骤Ⅰ所得的溶液中加入适量稀 溶液,用
溶液,用 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液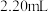 。
。
(3)步骤Ⅰ加入过量铜粉的目的是_________________________________ 。
(4)步骤Ⅱ滴加 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为_____________________ 。
(5)用 标准溶液滴定至终点的标志是:
标准溶液滴定至终点的标志是:___________ 。
(6)黑木耳中铁的含量为________ mg/100g(即每100g黑木耳中含铁元素质量)。
(7)若步骤Ⅰ过滤后未洗涤将使测定结果________ (填“偏大”或“偏小”或“无影响”)。
Ⅰ.铁元素的检验

(1)“操作”是指

(2)检验待测液中是否含有
 、
、
| 检验试剂 | 现象 | 结论 |
| KSCN溶液 | 溶液变为红色 | 滤液中含有 |
| ① | ② | 滤液中含有 |
Ⅱ.铁元素含量的测定
利用
 标准溶液测定干黑木耳样品中铁元素的含量
标准溶液测定干黑木耳样品中铁元素的含量步骤Ⅰ:取
 待测液,加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
待测液,加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。步骤Ⅱ:向步骤Ⅰ所得的溶液中加入适量稀
 溶液,用
溶液,用 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液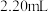 。
。(3)步骤Ⅰ加入过量铜粉的目的是
(4)步骤Ⅱ滴加
 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为(5)用
 标准溶液滴定至终点的标志是:
标准溶液滴定至终点的标志是:(6)黑木耳中铁的含量为
(7)若步骤Ⅰ过滤后未洗涤将使测定结果
您最近一年使用:0次
2024-04-03更新
|
189次组卷
|
2卷引用:天津市宁河区芦台第一中学2024届高三下学期适应性模拟训练(3月)化学试题
名校
解题方法
5 . TiO2和TiCl4均为重要的工业原料。已知:

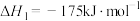 Ⅰ
Ⅰ
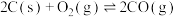
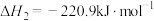 Ⅱ
Ⅱ
请回答下列问题:
(1)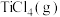 与
与 反应生成
反应生成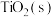 、
、 和氯气的热化学方程式为
和氯气的热化学方程式为___________ ;升高温度对该反应的影响为___________ 。
(2)若反应Ⅱ的逆反应的活化能为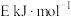 ,则E
,则E___________ (填“>”“<”或“=”)220.9。
(3)t℃时,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和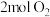 ,发生反应Ⅰ。
,发生反应Ⅰ。 时达到平衡,测得
时达到平衡,测得 的物质的量为
的物质的量为 。
。
①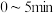 内,用
内,用 表示的反应速率
表示的反应速率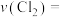
___________ 。
② 的平衡转化率为
的平衡转化率为___________ 。
③该反应的平衡常数为___________ (用分数表示)。
④下列措施,既能加快逆反应速率又能增大 平衡转化率的是
平衡转化率的是___________ (填字母)。
A.缩小容器容积 B.加入催化剂 C.分离出部分 D.增大
D.增大 浓度
浓度
(4)实验室各种浓度的硫酸是由浓硫酸稀释而得,
①以下配制过程中各操作的先后顺序是___________ 。
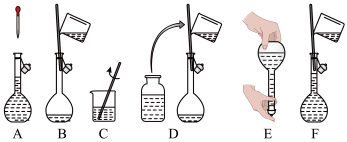
②下列情况会使配制结果偏大的是___________ 。
a.溶解后未冷却即转移、定容
b.定容时仰视容量瓶刻度线
c.用量筒量取一定体积的浓硫酸时俯视
d.将量筒、烧杯、玻璃棒洗涤2~3次,转移至容量瓶

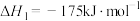 Ⅰ
Ⅰ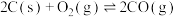
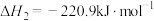 Ⅱ
Ⅱ请回答下列问题:
(1)
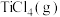 与
与 反应生成
反应生成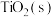 、
、 和氯气的热化学方程式为
和氯气的热化学方程式为(2)若反应Ⅱ的逆反应的活化能为
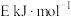 ,则E
,则E(3)t℃时,向
 恒容密闭容器中充入
恒容密闭容器中充入 和
和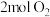 ,发生反应Ⅰ。
,发生反应Ⅰ。 时达到平衡,测得
时达到平衡,测得 的物质的量为
的物质的量为 。
。①
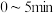 内,用
内,用 表示的反应速率
表示的反应速率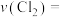
②
 的平衡转化率为
的平衡转化率为③该反应的平衡常数为
④下列措施,既能加快逆反应速率又能增大
 平衡转化率的是
平衡转化率的是A.缩小容器容积 B.加入催化剂 C.分离出部分
 D.增大
D.增大 浓度
浓度(4)实验室各种浓度的硫酸是由浓硫酸稀释而得,
①以下配制过程中各操作的先后顺序是

②下列情况会使配制结果偏大的是
a.溶解后未冷却即转移、定容
b.定容时仰视容量瓶刻度线
c.用量筒量取一定体积的浓硫酸时俯视
d.将量筒、烧杯、玻璃棒洗涤2~3次,转移至容量瓶
您最近一年使用:0次
6 . “碳达峰·碳中和”是我国社会发展重大战略之一。
Ⅰ. 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:

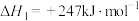

 请回答:
请回答:
(1)有利于提高 平衡转化率的条件是________。
平衡转化率的条件是________。
(2)反应 的
的
________  。
。
(3)恒压、750℃时, 和
和 按物质的量之比1:3投料,反应经如下流程(主要产物已标出)可实现
按物质的量之比1:3投料,反应经如下流程(主要产物已标出)可实现 高效转化。
高效转化。
Ⅱ.二氧化碳加氢制甲醇是研究的另一热点,其总反应可表示为:
反应1: ,该反应一般认为通过如下步骤来实现:
,该反应一般认为通过如下步骤来实现:
反应2:
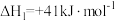
反应3:
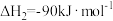
(4)反应2的 ________。
________。
(5)若反应2为慢反应,请在如图中画出上述两步反应能量变化的示意图________ 。 投料,实验测定
投料,实验测定 的平衡转化率随温度的变化关系如图所示。
的平衡转化率随温度的变化关系如图所示。 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是____________________ 。__________________ 。
Ⅰ.
 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:
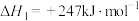

 请回答:
请回答:(1)有利于提高
 平衡转化率的条件是________。
平衡转化率的条件是________。| A.低温低压 | B.低温高压 | C.高温低压 | D.高温高压 |
(2)反应
 的
的
 。
。(3)恒压、750℃时,
 和
和 按物质的量之比1:3投料,反应经如下流程(主要产物已标出)可实现
按物质的量之比1:3投料,反应经如下流程(主要产物已标出)可实现 高效转化。
高效转化。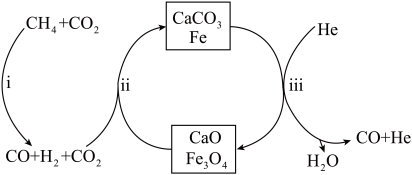
A. 可循环利用, 可循环利用, 不可循环利用 不可循环利用 |
B.过程ⅱ, 吸收 吸收 可促使 可促使 氧化 氧化 的平衡正移 的平衡正移 |
C.过程ⅱ产生的 最终未被 最终未被 吸收,在过程ⅲ被排出 吸收,在过程ⅲ被排出 |
D.相比于反应  ,该流程的总反应还原 ,该流程的总反应还原  需吸收的能量更多 需吸收的能量更多 |
Ⅱ.二氧化碳加氢制甲醇是研究的另一热点,其总反应可表示为:
反应1:
 ,该反应一般认为通过如下步骤来实现:
,该反应一般认为通过如下步骤来实现:反应2:

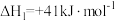
反应3:

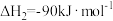
(4)反应2的
 ________。
________。| A.大于0 | B.小于0 | C.等于0 | D.无法判断 |
(5)若反应2为慢反应,请在如图中画出上述两步反应能量变化的示意图

 投料,实验测定
投料,实验测定 的平衡转化率随温度的变化关系如图所示。
的平衡转化率随温度的变化关系如图所示。 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是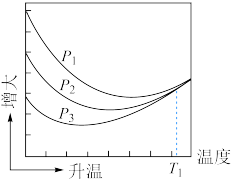
您最近一年使用:0次
名校
解题方法
7 . 含有吡喃萘醌骨架的化合物常具有抗菌、抗病毒等生物活性,一种合成该类化合物的路线如下(部分反应条件已简化):
(1)A到B所需的试剂和条件为___________ 。
(2)从F转化为G的过程中所涉及的反应类型有___________ 。
(3)物质G所含官能团的名称为___________ 。
(4)依据上述流程提供的信息,下列反应产物J的结构简式为___________ 。___________ (写标号)。___________ (碳原子上连有4个不同的原子或基团时,该碳称为手性碳)。
(7)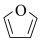 (呋喃)是一种重要的化工原料,其能够发生银镜反应的同分异构体中除H2C=C=CH-CHO外,还有
(呋喃)是一种重要的化工原料,其能够发生银镜反应的同分异构体中除H2C=C=CH-CHO外,还有___________ 种。
(8)已知:连在苯环上的-COOH为间位取代定位基团,依据由C到D的反应信息,设计以甲苯为原料选择性合成邻溴苯甲酸的路线(无机试剂任选)。___________ 。

(1)A到B所需的试剂和条件为
(2)从F转化为G的过程中所涉及的反应类型有
(3)物质G所含官能团的名称为
(4)依据上述流程提供的信息,下列反应产物J的结构简式为
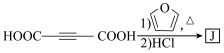
① ②
②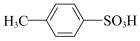 ③
③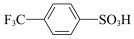
(7)
 (呋喃)是一种重要的化工原料,其能够发生银镜反应的同分异构体中除H2C=C=CH-CHO外,还有
(呋喃)是一种重要的化工原料,其能够发生银镜反应的同分异构体中除H2C=C=CH-CHO外,还有(8)已知:连在苯环上的-COOH为间位取代定位基团,依据由C到D的反应信息,设计以甲苯为原料选择性合成邻溴苯甲酸的路线(无机试剂任选)。
您最近一年使用:0次
解题方法
8 . 乙二酸二乙酯(D)可由石油气裂解得到的烯烃合成。回答下列问题:____________ ,B和A为同系物,则B的加聚产物的结构简式为____________ 。
(2)反应①的化学方程式为__________________________________ ,反应类型为____________ 。
(3)反应②的化学方程式为___________________________________ ,反应类型为____________ 。
(4)反应③的化学方程式为__________________________________ ,反应类型为____________ 。
(5)C的名称为____________ 。
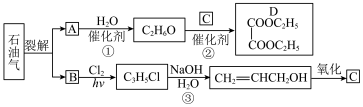
(2)反应①的化学方程式为
(3)反应②的化学方程式为
(4)反应③的化学方程式为
(5)C的名称为
您最近一年使用:0次
2023-12-03更新
|
177次组卷
|
2卷引用:天津市第四十一中学2024-2025学年高三上学期开学考试 化学试题
9 . 我国正在建造第四艘航空母舰,镍铬钢抗腐蚀性能强,可用于建造航母。
(1)航母甲板镍铬钢表面涂有一层耐高温的材料聚硅氧烷,基态 原子的价电子排布式为
原子的价电子排布式为____________ ,基态 原子电子占据最高能级的电子云轮廓图为
原子电子占据最高能级的电子云轮廓图为____________ 形,元素C、O、F的电负性由大到小的顺序为____________ 。
(2)海洋是航母的摇篮,也是元素的摇篮,海水中含有大量F、 、I元素。
、I元素。
① 的空间构型为
的空间构型为____________ ,其中O原子杂化方式为____________ 杂化。
②海水综合利用中用 水溶液吸收
水溶液吸收 ,吸收率可达95%,有关反应的离子方程式为
,吸收率可达95%,有关反应的离子方程式为____________ ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是____________ 。
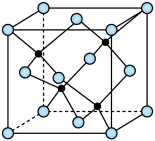
(3)海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。 与
与 形成的一种晶胞结构如下图所示(黑球表示
形成的一种晶胞结构如下图所示(黑球表示 ,白球表示
,白球表示 ),
), 的配位数为
的配位数为____________ 。晶胞边长为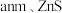 相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为
相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为____________  。
。
(1)航母甲板镍铬钢表面涂有一层耐高温的材料聚硅氧烷,基态
 原子的价电子排布式为
原子的价电子排布式为 原子电子占据最高能级的电子云轮廓图为
原子电子占据最高能级的电子云轮廓图为(2)海洋是航母的摇篮,也是元素的摇篮,海水中含有大量F、
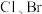 、I元素。
、I元素。①
 的空间构型为
的空间构型为②海水综合利用中用
 水溶液吸收
水溶液吸收 ,吸收率可达95%,有关反应的离子方程式为
,吸收率可达95%,有关反应的离子方程式为(3)海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。
 与
与 形成的一种晶胞结构如下图所示(黑球表示
形成的一种晶胞结构如下图所示(黑球表示 ,白球表示
,白球表示 ),
), 的配位数为
的配位数为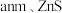 相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为
相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为 。
。
您最近一年使用:0次
2023-12-03更新
|
168次组卷
|
2卷引用:天津市第四十一中学2024-2025学年高三上学期开学考试 化学试题
名校
10 . 烟道气中含氧NO、 、
、 等多种有害气体,合理治理烟道气中具有重要意义。
等多种有害气体,合理治理烟道气中具有重要意义。
(1)烟道气中的氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:


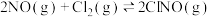

则反应: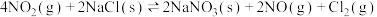

___________ (用含 、
、 的式子表示)。
的式子表示)。
(2)利用CO可将NO转化为无害的 ,其反应为:
,其反应为: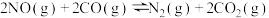 。在容积均为2L的甲、乙两个恒温(反应温度分别为
。在容积均为2L的甲、乙两个恒温(反应温度分别为 ℃、
℃、 ℃)恒容密闭容器中,分别加入物质的量之比为1∶1的NO和CO,测得各容器中
℃)恒容密闭容器中,分别加入物质的量之比为1∶1的NO和CO,测得各容器中 随反应时间t的变化情况如下表所示:
随反应时间t的变化情况如下表所示:
①已知 ,则该反应的△H
,则该反应的△H___________ 0(填“>”或“<”)。
②甲容器达平衡时,体系的压强与反应开始时体系的压强之比为___________ 。
(3)对烟道气中的 进行回收再利用具有较高的社会价值和经济价值。
进行回收再利用具有较高的社会价值和经济价值。
其反应为: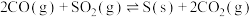
①写出该反应平衡常数表达式___________ 。
②由 和CO反应生成S和
和CO反应生成S和 的能量变化如图甲所示,在恒温恒容的密闭容器中进行反应,对此反应下列说法正确的是
的能量变化如图甲所示,在恒温恒容的密闭容器中进行反应,对此反应下列说法正确的是___________ 。
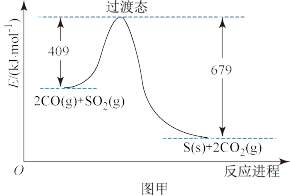
a.若混合气体密度保持不变,则已达平衡状态
b.从反应开始到平衡,容器内气体的压强保持不变
c.达平衡后若再充入一定量 ,新平衡体系混合气体中CO的体积分数增大
,新平衡体系混合气体中CO的体积分数增大
d.分离出一部分S,正、逆反应速率均保持不变
(4)用电化学法模拟工业处理对烟道气中的 。如图乙装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能。
。如图乙装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能。
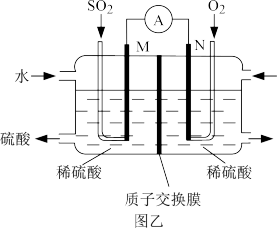
①M极发生的电极反应式为___________ 。
②当外电路通过0.2mol电子时,质子交换膜右侧的溶液质量___________ (填“增大”或“减小”),___________ g。
 、
、 等多种有害气体,合理治理烟道气中具有重要意义。
等多种有害气体,合理治理烟道气中具有重要意义。(1)烟道气中的氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:


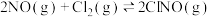

则反应:
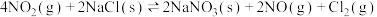

 、
、 的式子表示)。
的式子表示)。(2)利用CO可将NO转化为无害的
 ,其反应为:
,其反应为: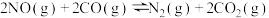 。在容积均为2L的甲、乙两个恒温(反应温度分别为
。在容积均为2L的甲、乙两个恒温(反应温度分别为 ℃、
℃、 ℃)恒容密闭容器中,分别加入物质的量之比为1∶1的NO和CO,测得各容器中
℃)恒容密闭容器中,分别加入物质的量之比为1∶1的NO和CO,测得各容器中 随反应时间t的变化情况如下表所示:
随反应时间t的变化情况如下表所示:t/min /mol /mol | 0 | 10 | 20 | 30 | 40 |
甲( ℃) ℃) | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙( ℃) ℃) | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
 ,则该反应的△H
,则该反应的△H②甲容器达平衡时,体系的压强与反应开始时体系的压强之比为
(3)对烟道气中的
 进行回收再利用具有较高的社会价值和经济价值。
进行回收再利用具有较高的社会价值和经济价值。其反应为:
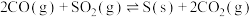
①写出该反应平衡常数表达式
②由
 和CO反应生成S和
和CO反应生成S和 的能量变化如图甲所示,在恒温恒容的密闭容器中进行反应,对此反应下列说法正确的是
的能量变化如图甲所示,在恒温恒容的密闭容器中进行反应,对此反应下列说法正确的是
a.若混合气体密度保持不变,则已达平衡状态
b.从反应开始到平衡,容器内气体的压强保持不变
c.达平衡后若再充入一定量
 ,新平衡体系混合气体中CO的体积分数增大
,新平衡体系混合气体中CO的体积分数增大d.分离出一部分S,正、逆反应速率均保持不变
(4)用电化学法模拟工业处理对烟道气中的
 。如图乙装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能。
。如图乙装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能。
①M极发生的电极反应式为
②当外电路通过0.2mol电子时,质子交换膜右侧的溶液质量
您最近一年使用:0次



