1 . 某工厂采用软锰矿(主要成分为 )与辉铋矿(主要成分为
)与辉铋矿(主要成分为 ,含有
,含有 、
、 杂质)联合焙烧法制备电池级的
杂质)联合焙烧法制备电池级的 和BiOCl,工艺流程如下:
和BiOCl,工艺流程如下:

已知:①焙烧时过量的 分解为
分解为 ,加热时
,加热时 在酸性溶液中转化为
在酸性溶液中转化为 和Mn²⁺,MnO与酸反应生成
和Mn²⁺,MnO与酸反应生成 ;
;
②金属活动性顺序:Fe>(H)>Bi>Cu;
③相关金属离子形成氢氧化物的pH范围:
④BiOCl的式量:260.5
回答下列问题:
(1)下列有关说法错误的是___________。
(2) 经热解、酸浸等步骤可制备
经热解、酸浸等步骤可制备 。
。 在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(某价态锰的元素的中锰元素质量×100%)随热解温度变化的曲线如图所示。为获得较高产率的
在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(某价态锰的元素的中锰元素质量×100%)随热解温度变化的曲线如图所示。为获得较高产率的 ,请选出正确操作并按序排列:取一定量
,请选出正确操作并按序排列:取一定量 置于热解装置中,通空气气流,
置于热解装置中,通空气气流,___________ ,充分反应后过滤、洗涤、干燥,得到 。
。

a.冷却至室温
b.加热到450℃分解一段时间
c.加热到480℃分解一段时间
d.边搅拌边加入一定量1 mol⋅L-1的 溶液
溶液
e.边搅拌边加入一定量1 mol⋅L-1的HCl溶液0
(3)BiOCl含量的测定。称取产品0.1302g于锥形瓶中,加15 mL 36%的盐酸溶解,加掩蔽剂防止杂质离子对终点判断产生干扰,调pH至1.5~1.8,加入饱和硫脲与 形成黄色络合物,再用0.0200 mol⋅L-1的EDTA滴定至终点,消耗溶液22.50 mL。已知EDTA与
形成黄色络合物,再用0.0200 mol⋅L-1的EDTA滴定至终点,消耗溶液22.50 mL。已知EDTA与 1∶1发生络合反应,所得产物的稳定性远大于硫脲与
1∶1发生络合反应,所得产物的稳定性远大于硫脲与 形成的黄色络合物。
形成的黄色络合物。
①根据滴定实验测得的数据计算,产品的质量分数为___________ 。
②临近滴定终点时的操作方法是:将旋塞稍稍转动,使半滴溶液悬于管口,___________ ,再用洗瓶以少量蒸馏水吹洗锥形瓶内壁,直到滴入最后半滴EDTA,溶液恰好由黄色变为无色,半分钟内不变色。
③下列关于滴定分析的操作,错误的是___________ 。
A.装入滴定管中的溶液无需用量筒量取
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.①中计算所得数据即为产品纯度
 )与辉铋矿(主要成分为
)与辉铋矿(主要成分为 ,含有
,含有 、
、 杂质)联合焙烧法制备电池级的
杂质)联合焙烧法制备电池级的 和BiOCl,工艺流程如下:
和BiOCl,工艺流程如下:
已知:①焙烧时过量的
 分解为
分解为 ,加热时
,加热时 在酸性溶液中转化为
在酸性溶液中转化为 和Mn²⁺,MnO与酸反应生成
和Mn²⁺,MnO与酸反应生成 ;
;②金属活动性顺序:Fe>(H)>Bi>Cu;
③相关金属离子形成氢氧化物的pH范围:
| 开始沉淀pH | 完全沉淀pH | |
 | 6.5 | 8.3 |
 | 1.6 | 2.8 |
 | 8.1 | 10.1 |
回答下列问题:
(1)下列有关说法错误的是___________。
A.焙烧时,只有 是还原剂 是还原剂 |
| B.为提高焙烧效率,鼓入适当过量的空气 |
C.滤渣A是 ,气体A是 ,气体A是 |
D.加入金属铋的作用是将 转化为Fe 转化为Fe |
 经热解、酸浸等步骤可制备
经热解、酸浸等步骤可制备 。
。 在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(某价态锰的元素的中锰元素质量×100%)随热解温度变化的曲线如图所示。为获得较高产率的
在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(某价态锰的元素的中锰元素质量×100%)随热解温度变化的曲线如图所示。为获得较高产率的 ,请选出正确操作并按序排列:取一定量
,请选出正确操作并按序排列:取一定量 置于热解装置中,通空气气流,
置于热解装置中,通空气气流, 。
。
a.冷却至室温
b.加热到450℃分解一段时间
c.加热到480℃分解一段时间
d.边搅拌边加入一定量1 mol⋅L-1的
 溶液
溶液e.边搅拌边加入一定量1 mol⋅L-1的HCl溶液0
(3)BiOCl含量的测定。称取产品0.1302g于锥形瓶中,加15 mL 36%的盐酸溶解,加掩蔽剂防止杂质离子对终点判断产生干扰,调pH至1.5~1.8,加入饱和硫脲与
 形成黄色络合物,再用0.0200 mol⋅L-1的EDTA滴定至终点,消耗溶液22.50 mL。已知EDTA与
形成黄色络合物,再用0.0200 mol⋅L-1的EDTA滴定至终点,消耗溶液22.50 mL。已知EDTA与 1∶1发生络合反应,所得产物的稳定性远大于硫脲与
1∶1发生络合反应,所得产物的稳定性远大于硫脲与 形成的黄色络合物。
形成的黄色络合物。①根据滴定实验测得的数据计算,产品的质量分数为
②临近滴定终点时的操作方法是:将旋塞稍稍转动,使半滴溶液悬于管口,
③下列关于滴定分析的操作,错误的是
A.装入滴定管中的溶液无需用量筒量取
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.①中计算所得数据即为产品纯度
您最近一年使用:0次
解题方法
2 . 甲烷水蒸气重整反应是工业制备氢气的重要方式,在催化剂(如镍)表面发生的主要反应有:
①
 kJ⋅mol-1
kJ⋅mol-1
②

副反应: ,
,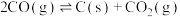 ,
,
Ⅰ.已知: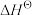 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其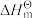 为零。
为零。
例如C(石墨)
 kJ·mol-1,则
kJ·mol-1,则 的标准生成焓为-393.5 kJ⋅mol-1。
的标准生成焓为-393.5 kJ⋅mol-1。
(1)
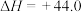 kJ⋅mol-1,结合表中数据计算反应
kJ⋅mol-1,结合表中数据计算反应
___________ 。
(2)在镍催化剂表面甲烷和水蒸气发生反应,最后生成CO、 和
和 ,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。
,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。
a. ;
;
b.___________ ;
c. ;
;
d.___________ ;
e.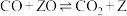
Ⅱ.在一体积可变的密闭容器中,投入一定量的 和
和 发生甲烷水蒸气重整反应。
发生甲烷水蒸气重整反应。
(3)下列有关说法正确的是___________。
(4)维持压强100 kPa,平衡时 、
、 、CO、
、CO、 的体积分数分别为a、b、c、d,反应①的平衡常数
的体积分数分别为a、b、c、d,反应①的平衡常数
___________  (用含字母的式子表示。
(用含字母的式子表示。 是以分压表示的平衡常数,分压=总压×体积分数)。
是以分压表示的平衡常数,分压=总压×体积分数)。
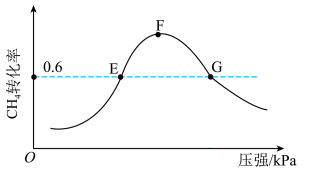
(5)500℃时,反应相同时间后测得 的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)
的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)___________ c(G)(填“>”“<”或“=”)。
(6)通过甲烷水蒸气重整反应的平衡含量计算,以及析碳条件的判断,该转化需适当增大水碳比[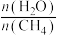 ],请分析可能的原因:
],请分析可能的原因:___________ 。
①

 kJ⋅mol-1
kJ⋅mol-1②


副反应:
 ,
,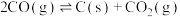 ,
,
Ⅰ.已知:
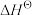 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其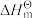 为零。
为零。例如C(石墨)

 kJ·mol-1,则
kJ·mol-1,则 的标准生成焓为-393.5 kJ⋅mol-1。
的标准生成焓为-393.5 kJ⋅mol-1。| 物质 |  |  | CO |
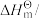 /kJ⋅mol-1 /kJ⋅mol-1 | -285.8 | -393.5 | -110.5 |

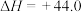 kJ⋅mol-1,结合表中数据计算反应
kJ⋅mol-1,结合表中数据计算反应
(2)在镍催化剂表面甲烷和水蒸气发生反应,最后生成CO、
 和
和 ,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。
,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。a.
 ;
; b.
c.
 ;
;d.
e.
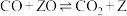
Ⅱ.在一体积可变的密闭容器中,投入一定量的
 和
和 发生甲烷水蒸气重整反应。
发生甲烷水蒸气重整反应。(3)下列有关说法正确的是___________。
A. 浓度不变,说明体系已达平衡状态 浓度不变,说明体系已达平衡状态 |
| B.反应②前后气体物质的量不变,所以此反应熵变为0 |
C.在催化剂表面, 、 、 分子中的化学键被削弱 分子中的化学键被削弱 |
D.在体系中通入适量的 ,有利于减少积碳,从而有利于反应进行 ,有利于减少积碳,从而有利于反应进行 |
 、
、 、CO、
、CO、 的体积分数分别为a、b、c、d,反应①的平衡常数
的体积分数分别为a、b、c、d,反应①的平衡常数
 (用含字母的式子表示。
(用含字母的式子表示。 是以分压表示的平衡常数,分压=总压×体积分数)。
是以分压表示的平衡常数,分压=总压×体积分数)。(5)500℃时,反应相同时间后测得
 的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)
的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)
(6)通过甲烷水蒸气重整反应的平衡含量计算,以及析碳条件的判断,该转化需适当增大水碳比[
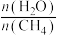 ],请分析可能的原因:
],请分析可能的原因:
您最近一年使用:0次
3 . 某化学兴趣小组在老师指导下进行课外实验,利用下列装置来探究磷单质在空气中燃烧后氧气浓度变化情况。
[提出问题]足量红磷在密闭的四颈平底烧瓶内燃烧熄灭后,容器中是否有氧气剩余
[猜想假设]猜想①:有氧气剩余
猜想②:无氧气剩余
[实验验证]该小组同学按图组装好实验装置,利用高能激光笔照射燃烧匙上的红磷,红磷燃烧直至熄灭;待装置完全冷却后,将装有白磷的燃烧匙提出水面,再次用高能激光笔照射,白磷居然也被点燃。

(1)激光笔的作用是_____ 。
(2)实验过程中,刚开始即使用激光笔照射,燃烧匙内的白磷也不会燃烧的原因是_____ 。
[实验结论]根据上述实验,得出结论如下:
(3)用“燃磷法测定空气中氧气含量”时,选择_____ (填“红磷”或“白磷”)更合适,理由是_____ 。
[拓展延伸]如图是该小组同学从开始实验到最后装置冷却后的整个实验过程中,用氧气传感器测量容器内氧气浓度变化的曲线图。

(4)请你解释上图曲线AB段氧气浓度变化的主要原因_____ 。
(5)小组同学通过查阅资料得知,验证空气中氧气体积分数较好的药品是铁丝绒,利用铁与氧气、水等的缓慢氧化,可将空气中氧气浓度消耗至0.2%。将足量细铁丝绒置于试管底部,并倒扣在装有水的烧杯中(如图),一段时间后你将看到的现象是_____ 。

[提出问题]足量红磷在密闭的四颈平底烧瓶内燃烧熄灭后,容器中是否有氧气剩余
[猜想假设]猜想①:有氧气剩余
猜想②:无氧气剩余
[实验验证]该小组同学按图组装好实验装置,利用高能激光笔照射燃烧匙上的红磷,红磷燃烧直至熄灭;待装置完全冷却后,将装有白磷的燃烧匙提出水面,再次用高能激光笔照射,白磷居然也被点燃。

(1)激光笔的作用是
(2)实验过程中,刚开始即使用激光笔照射,燃烧匙内的白磷也不会燃烧的原因是
[实验结论]根据上述实验,得出结论如下:
(3)用“燃磷法测定空气中氧气含量”时,选择
[拓展延伸]如图是该小组同学从开始实验到最后装置冷却后的整个实验过程中,用氧气传感器测量容器内氧气浓度变化的曲线图。

(4)请你解释上图曲线AB段氧气浓度变化的主要原因
(5)小组同学通过查阅资料得知,验证空气中氧气体积分数较好的药品是铁丝绒,利用铁与氧气、水等的缓慢氧化,可将空气中氧气浓度消耗至0.2%。将足量细铁丝绒置于试管底部,并倒扣在装有水的烧杯中(如图),一段时间后你将看到的现象是

您最近一年使用:0次
解题方法
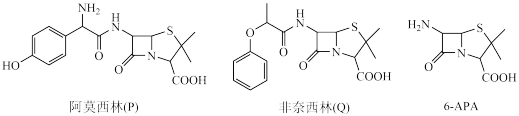
4 . 青霉素类药物是人类史上最重要的抗菌药物,其中两种药物阿莫西林(P)、非奈西林(Q)、重要中间体6-APA的结构以及阿莫西林的合成路线如下图所示。
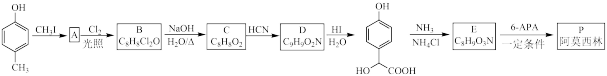
已知:①
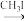

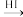
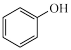
②RCHO + HCN → RCH(OH)CN
③RCN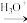 RCOOH + NH
RCOOH + NH
回答下列问题:
(1)C中含有的不饱和官能团的名称为_______ 。
(2)下列说法错误 的是_______。(填序号)
(3)D与足量氢碘酸反应的化学方程式为_______ 。
(4)写出6-APA满足下列条件的所有同分异构体的结构简式:__ 。
①含有苯环;
②含有磺酸基(-SO3H);
③核磁共振氢谱有4组峰
(5)试设计以苯酚、乙醛和6-APA为原料,制备非奈西林(Q)的合成路线__ 。(无机试剂任选)


已知:①

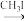

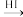
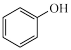
②RCHO + HCN → RCH(OH)CN
③RCN
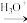 RCOOH + NH
RCOOH + NH
回答下列问题:
(1)C中含有的不饱和官能团的名称为
(2)下列说法
| A.1mol对甲基苯酚能与含2mol溴的溴水反应 |
| B.B能发生取代、加成、消去、氧化反应 |
| C.E能发生缩聚反应形成高分子 |
| D.阿莫西林分子中含有5个手性碳原子 |
(4)写出6-APA满足下列条件的所有同分异构体的结构简式:
①含有苯环;
②含有磺酸基(-SO3H);
③核磁共振氢谱有4组峰
(5)试设计以苯酚、乙醛和6-APA为原料,制备非奈西林(Q)的合成路线
您最近一年使用:0次
名校
解题方法
5 . 黄色固体X是由四种元素组成的化合物,用作颜料和食品的抗结剂,为测定其组成,进行如下实验。已知气体D能使澄清石灰水变浑浊,溶液F中只含有一种溶质。回答下列问题:
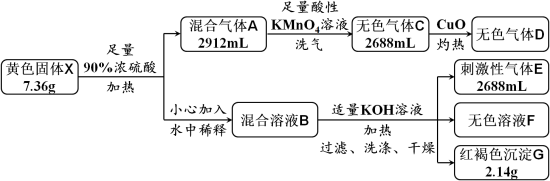
(1)固体X的组成元素是_______ 。
(2)混合气体A中所含物质的化学式为_______ 。
(3)实验中溶液B由X转化而来的溶质与KOH反应的总离子方程式为_______ 。
(4)证明沉淀G中的金属元素已完全沉淀的方法是_______ 。
(5)X与酸性KMnO4溶液反应,可生成一种与X组成元素相同,但式量比其小39的化合物,该反应的化学方程式为_______ 。

(1)固体X的组成元素是
(2)混合气体A中所含物质的化学式为
(3)实验中溶液B由X转化而来的溶质与KOH反应的总离子方程式为
(4)证明沉淀G中的金属元素已完全沉淀的方法是
(5)X与酸性KMnO4溶液反应,可生成一种与X组成元素相同,但式量比其小39的化合物,该反应的化学方程式为
您最近一年使用:0次
2022-12-09更新
|
422次组卷
|
4卷引用:浙江省诸暨海亮高级中学2021-2022学年高三12月份选考模拟化学试题
浙江省诸暨海亮高级中学2021-2022学年高三12月份选考模拟化学试题浙江省舟山中学2022-2023学年高三上学期首考模拟卷(三)化学试题(已下线)浙江省温州市普通高中2023届高三下学期第二次适应性考试化学试题变式题(无机推断题)甘肃省两县高中联考2023-2024学年高三上学期12月月考化学试题
解题方法
6 . 有A、B、C、D四种物质的溶液,在进行焰色试验时,火焰都呈黄色,它们之间可发生如图所示的转化。

(1)B物质的化学式为_______ 。
(2)C物质为钠盐,所属类别为_______ 。
A.酸式盐 B.碱式盐 C.正盐
(3)D转化为A的离子方程式_______ 。
(4)下列说法不正确的是_______。

(1)B物质的化学式为
(2)C物质为钠盐,所属类别为
A.酸式盐 B.碱式盐 C.正盐
(3)D转化为A的离子方程式
(4)下列说法不正确的是_______。
| A.A与C能进行化学反应 |
| B.上述反应均不属于氧化还原反应 |
| C.往固体B中加少量水,会发生放热现象 |
| D.等质量的B和C与足量盐酸反应,产生的二氧化碳一样多 |
您最近一年使用:0次
7 . 某地出产的矿石A可看作由主要成分硅酸铜盐X·7H2O (摩尔质量=406 g·mol-1 )与含氧酸盐杂质Y共同组成,X、Y均含三种元素,工业上利用下列流程制备铜盐,在溶液I和II中滴入KSCN溶液,前者无现象,后者显血红色。所有数据均已折算为标准状况。
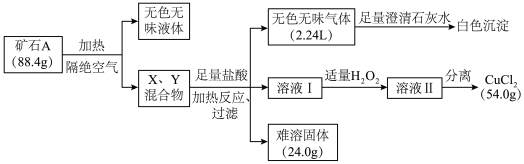
请回答:
(1)写出Y中除氧以外的元素符号_________ ,X的化学式为________ 。
(2)如果往溶液II中继续加入H2O2,发现有气泡产生,有观点认为是Y中的某元素离子将H2O2氧化所致,写出反应的离子方程式________ ; 加足量H2O2后对溶液II进行分离,可得到该元素的氧化物Z 4.0g,写出杂质Y与盐酸反应的化学方程式________ 。
(3)将Z与KNO3、KOH共熔,可制得一种绿色环保的高效净水剂M,同时生成KNO2和H2O。写出该反应的化学方程式________ 。
(4)通过完全电解上述流程所得的54.0 g CuCl2 (熔融状态)制备Cu,但还原产物也可能是Cu2O,试设计实验证明还原产物的组成__________ 。

请回答:
(1)写出Y中除氧以外的元素符号
(2)如果往溶液II中继续加入H2O2,发现有气泡产生,有观点认为是Y中的某元素离子将H2O2氧化所致,写出反应的离子方程式
(3)将Z与KNO3、KOH共熔,可制得一种绿色环保的高效净水剂M,同时生成KNO2和H2O。写出该反应的化学方程式
(4)通过完全电解上述流程所得的54.0 g CuCl2 (熔融状态)制备Cu,但还原产物也可能是Cu2O,试设计实验证明还原产物的组成
您最近一年使用:0次
8 . 请回答下列问题。
(1)金属铝的卤化物熔点如下表:
请画出其中不属于分子晶体的卤化铝的电子式_______ ,加热分解某种铵盐X,可以1:3的物质的量比获得该卤化铝与一种离子化合物Y,Y的阳离子与阴离子具有相同的核外电子数,写出X的化学式_______ 。
(2)广义氢键理论认为除了与N、O、F原子形成氢键外,H原子还可以与很多带部分负电荷的原子形成氢键,请用广义氢键理论解释氮硼烷(H3N-BH3) 的沸点比乙烷(H3C-CH3)高285°C的原因________ 。
(1)金属铝的卤化物熔点如下表:
| 化学式 | AlF3 | AlCl3 | AlBr3 | AlI3 |
| 熔点/°C | 1290 | 180 | 97.5 | 188 |
请画出其中不属于分子晶体的卤化铝的电子式
(2)广义氢键理论认为除了与N、O、F原子形成氢键外,H原子还可以与很多带部分负电荷的原子形成氢键,请用广义氢键理论解释氮硼烷(H3N-BH3) 的沸点比乙烷(H3C-CH3)高285°C的原因
您最近一年使用:0次
解题方法
9 . 我国承诺 2030年前做到“碳达峰和碳中和”,这里的碳主要指CO2, CO2与我们生活和生产息息相关。请回答:
(1)工业上常用CO和CO2与氢气反应制备甲醇,涉及的反应有:
主反应:
I . CO(g)+2H2(g) CH3OH(g) △H1= -90.7 kJ·mol-1
CH3OH(g) △H1= -90.7 kJ·mol-1
II. CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1
副反应:
III. CO(g)+H2O(g) CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3
IV. 2CH3OH(g) CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1
请回答:
①△H3=________ kJ·mol-1。
②现利用I和II两个反应合成CH3OH,已知CO可使反应的催化剂寿命降低。若氢碳比表示为x= ,则理论上x=
,则理论上x=_______ 时,原料气的利用率最高。但生产中往往采用略高于该值的氢碳比,理由是___________ 。
(2)CO2甲烷化技术是碳中和理念的落脚点之一,反应为CO2(g)+ 4H2(g) CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
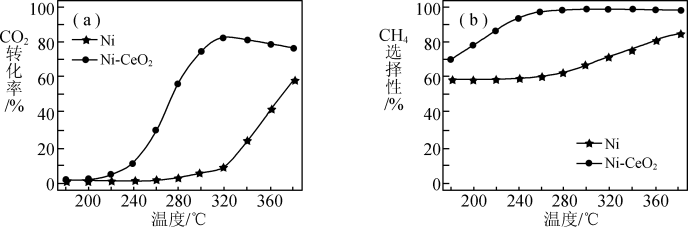
下列说法正确的是 。
(3)CO2可以与环氧丙烷反应合成碳酸丙烯酯:
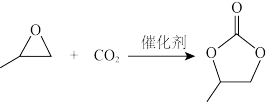 △H= - 110.5kJ·mol-1
△H= - 110.5kJ·mol-1
通过模型假设和理论计算,推测其反应历程如下图所示(*表示某催化剂的活化中心或活性基团):
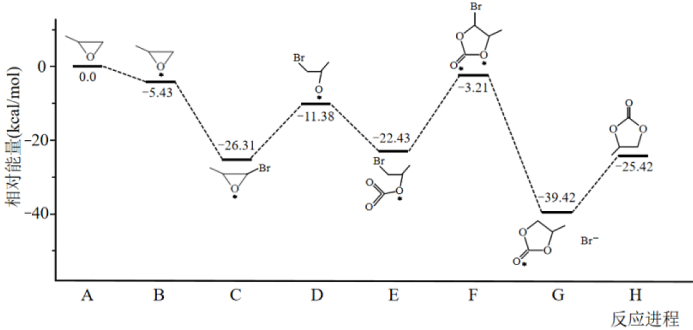
①决定总反应速率大小的步骤是______ (用图中字母表示), 该步骤的能垒(活化能)为_________ 。
②下列说法正确的是__________ 。
A.A →B能量降低,所以该过程必定自发
B.总反应为加成反应,D、F为过渡态,C、E为中间产物
C. D分子中氧原子带负电荷,强烈吸引CO2分子中的碳原子生成E,使体系能量降低
D.反应热的理论值(-25.42)与某次实测值(-110.5)相差太大,说明理论值几乎没有参考价值
(4)用CO2催化加氢可以合成低碳烯烃。反应开始时在0.1MPa 条件下,以n(H2) :n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
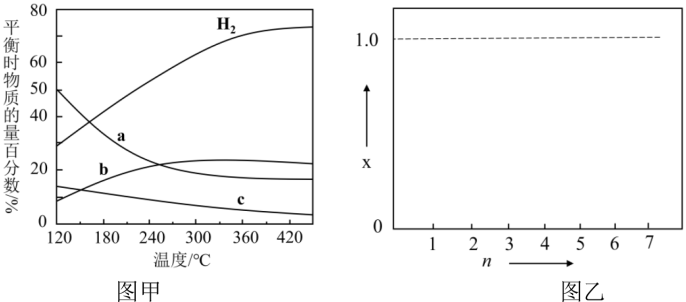
在120°C达到平衡时,CO2的转化率为________ ;若H2和CO2的物质的量之比为 n:1 (n≥3)进行投料,温度控制为120°C,相应平衡体系中CO2的转化率为x,在图乙中绘制x随n (n≥3 )变化的示意图________ (标出曲线的起点坐标)。
(1)工业上常用CO和CO2与氢气反应制备甲醇,涉及的反应有:
主反应:
I . CO(g)+2H2(g)
 CH3OH(g) △H1= -90.7 kJ·mol-1
CH3OH(g) △H1= -90.7 kJ·mol-1II. CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H2= -49.0 kJ·mol-1副反应:
III. CO(g)+H2O(g)
 CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3IV. 2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H4= -23.5 kJ·mol-1请回答:
①△H3=
②现利用I和II两个反应合成CH3OH,已知CO可使反应的催化剂寿命降低。若氢碳比表示为x=
 ,则理论上x=
,则理论上x=(2)CO2甲烷化技术是碳中和理念的落脚点之一,反应为CO2(g)+ 4H2(g)
 CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
CH4(g)+2H2O(g) △H= -165kJ·mol-1,其核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示。
下列说法正确的是 。
| A.高于320°C后,以Ni- CeO2为催化剂,CO2转化率略有下降的原因一定是CO2甲烷化反应已达平衡,升高温度平衡右移 |
| B.高于320°C后,以Ni为催化剂,CO2转化率上升的原因一定是CO2甲烷化反应速率较慢,升高温度反应速率加快,反应相同时间时CO2转化率增加 |
| C.工业上应选择的催化剂是Ni- CeO2 |
| D.工业上应使用的合适温度为360°C |
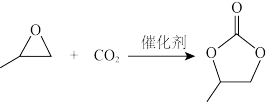 △H= - 110.5kJ·mol-1
△H= - 110.5kJ·mol-1通过模型假设和理论计算,推测其反应历程如下图所示(*表示某催化剂的活化中心或活性基团):

①决定总反应速率大小的步骤是
②下列说法正确的是
A.A →B能量降低,所以该过程必定自发
B.总反应为加成反应,D、F为过渡态,C、E为中间产物
C. D分子中氧原子带负电荷,强烈吸引CO2分子中的碳原子生成E,使体系能量降低
D.反应热的理论值(-25.42)与某次实测值(-110.5)相差太大,说明理论值几乎没有参考价值
(4)用CO2催化加氢可以合成低碳烯烃。反应开始时在0.1MPa 条件下,以n(H2) :n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
C2H4(g)+4H2O(g),不同温度下平衡时的四种气态物质的物质的量百分数如下图甲所示:
在120°C达到平衡时,CO2的转化率为
您最近一年使用:0次
名校
解题方法
10 . W、X、Y、Z、R、V、Q是七种短周期元素,原子序数依次增大。X原子的最外层电子数是次外层的2倍,Z为地壳中含量最多的元素,V的周期数和主族序数相等,W和R同主族,且都能与Z形成A2Z、A2Z2(A可以表示W或R)型的两种化合物,Q的单质为黄绿色有毒气体。请回答下列问题:
(1)W为____ (填元素名称),Q在元素周期表中的位置为_____ 。
(2)X和Y的气态氢化物中稳定性较强的是____ (填化学式)。
(3)写出XZ2的电子式____ 。
(4)请写出V的最高价氧化物对应的水化物与R的最高价氧化物对应的水化物反应的离子方程式_____ 。
(1)W为
(2)X和Y的气态氢化物中稳定性较强的是
(3)写出XZ2的电子式
(4)请写出V的最高价氧化物对应的水化物与R的最高价氧化物对应的水化物反应的离子方程式
您最近一年使用:0次
2022-08-30更新
|
103次组卷
|
2卷引用:浙江省吴兴高级中学2021-2022学年高一上学期12月月考化学试题



