名校
1 . 氯碱厂以食盐等为原料,生产烧碱、盐酸等化工产品。工艺流程可简单表示如下:
(1)工业电解饱和食盐水,要精制食盐水以除去SO 、Ca2+、Mg2+等杂质微粒,试剂加入顺序不正确的是_______。
、Ca2+、Mg2+等杂质微粒,试剂加入顺序不正确的是_______。
(2)步骤②的化学方程式为:_______ ,氯气在___ (选填“阳极”或“阴极”)产生。
(3)③步骤之后获得干燥烧碱产品的有关操作有___ 、___ 、干燥。进行④步骤的生产设备A、B之间传递的是(选填编号) ___ 。
A.只有物料 B.既有物料又有能量
C.只有能量 D.既无物料也无能量
(4)如果下列装置在实验室进行⑤步骤的实验,正确的是(选填编号)_______。
(5)已知市售浓盐酸的浓度为37%,密度为1.19g/cm3,其物质的量浓度为_______ (结果保留两位小数)。检验工业烧碱中是否含氯化钠的方法是_______ 。

(1)工业电解饱和食盐水,要精制食盐水以除去SO
 、Ca2+、Mg2+等杂质微粒,试剂加入顺序不正确的是_______。
、Ca2+、Mg2+等杂质微粒,试剂加入顺序不正确的是_______。| A.Na2CO3、BaCl2、NaOH、HCl | B.NaOH、BaCl2、Na2CO3、HCl |
| C.BaCl2、NaOH、Na2CO3、HCl | D.BaCl2、Na2CO3、NaOH、HCl |
(3)③步骤之后获得干燥烧碱产品的有关操作有
A.只有物料 B.既有物料又有能量
C.只有能量 D.既无物料也无能量
(4)如果下列装置在实验室进行⑤步骤的实验,正确的是(选填编号)_______。
A. | B. | C. | D. |
您最近一年使用:0次
2022-10-31更新
|
86次组卷
|
2卷引用:上海市格致中学2020-2021学年高一上学期期中考试化学试题
名校
解题方法
2 . 向10.00mL0.01mol·L-1某一元酸HA溶液中逐滴加入0.01mol·L-1NaOH溶液,溶液pH变化曲线如图所示。下列说法不正确 的是
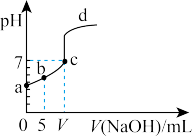

| A.HA是弱酸 |
| B.b点表示的溶液中:2c(Na+)=c(A-)+c(HA) |
| C.c点时:V=10.00mL |
| D.b、c、d点表示的溶液中:c(Na+)+c(H+)=c(A-)+c(OH-) |
您最近一年使用:0次
2022-10-31更新
|
538次组卷
|
2卷引用:北京师范大学附属中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
3 . 亚硫酸盐是一种常见的食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组同学设计了如下实验方案。
Ⅰ、称取样品Wg;
Ⅱ、向样品中加入足量稀硫酸;
Ⅲ、将Ⅱ中产生的SO2用足量H2O2溶液吸收;
Ⅳ、将Ⅲ所得硫酸溶液用氢氧化钠标准液滴定;
Ⅴ、数据处理。
(1)Na2SO3是一种食品添加剂。写出Na2SO3与稀硫酸反应的离子方程式:___________ 。
(2)步骤Ⅲ中H2O2的作用是___________ 。
(3)步骤Ⅳ中可选用的指示剂为___________ 。下图显示滴定终点时,滴定管(量程为25mL)读数为___________ 。

(4)步骤Ⅳ中消耗0.010mol/LNaOH溶液VmL,则1kg样品中含SO2的质量是___________ g(用含W、V的代数式表示)。
(5)步骤Ⅳ中的下列操作会造成该实验亚硫酸盐含量测定结果偏低的有___________
a、量取一定体积待测硫酸溶液前,酸式滴定管未用待测硫酸溶液润洗
b、装入氢氧化钠标准液前,碱式滴定管未用氢氧化钠标准液润洗
c、锥形瓶内用水冲洗后未干燥
d、在滴定过程中发现局部溶液发生色变就立即停止滴定
e、滴定终点读数是俯视读数
Ⅰ、称取样品Wg;
Ⅱ、向样品中加入足量稀硫酸;
Ⅲ、将Ⅱ中产生的SO2用足量H2O2溶液吸收;
Ⅳ、将Ⅲ所得硫酸溶液用氢氧化钠标准液滴定;
Ⅴ、数据处理。
(1)Na2SO3是一种食品添加剂。写出Na2SO3与稀硫酸反应的离子方程式:
(2)步骤Ⅲ中H2O2的作用是
(3)步骤Ⅳ中可选用的指示剂为

(4)步骤Ⅳ中消耗0.010mol/LNaOH溶液VmL,则1kg样品中含SO2的质量是
(5)步骤Ⅳ中的下列操作会造成该实验亚硫酸盐含量测定结果偏低的有
a、量取一定体积待测硫酸溶液前,酸式滴定管未用待测硫酸溶液润洗
b、装入氢氧化钠标准液前,碱式滴定管未用氢氧化钠标准液润洗
c、锥形瓶内用水冲洗后未干燥
d、在滴定过程中发现局部溶液发生色变就立即停止滴定
e、滴定终点读数是俯视读数
您最近一年使用:0次
名校
解题方法
4 . 用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
(1)已知:ⅰ、反应A中,4molHCl被氧化,放出115.6kJ的热量。
ⅱ、
①反应A的热化学方程式是___________ 。
②A中反应物所具有的焓___________ 生成物所具有的焓(填“大于”或“小于”)。
③断开1molH-O键与断开1molH-Cl键所需能量相差约为___________ kJ,H2O中H-O键比HCl中H-Cl键(填“强”或“弱”)___________ 。
(2)对于反应A,下图是在4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。
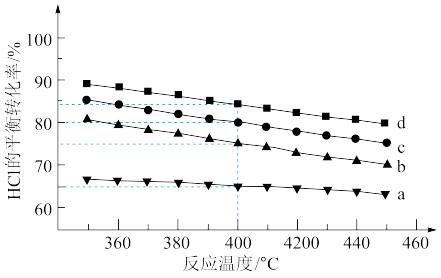
①曲线b对应的投料比是___________ 。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是___________ 。
③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是___________ 。
反应A:4HCl+O2
 2Cl2+2H2O
2Cl2+2H2O(1)已知:ⅰ、反应A中,4molHCl被氧化,放出115.6kJ的热量。
ⅱ、

①反应A的热化学方程式是
②A中反应物所具有的焓
③断开1molH-O键与断开1molH-Cl键所需能量相差约为
(2)对于反应A,下图是在4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。

①曲线b对应的投料比是
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是
③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是
您最近一年使用:0次
名校
解题方法
5 . 室温下,将0.05molNa2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是
| 加入的物质 | 结论 | |
| A | 50mL1mol/LH2SO4 | 反应结束后,c(Na+)=c( ) ) |
| B | 0.05molCaO | 溶液中,c(OH-)/c( )增大 )增大 |
| C | 50mLH2O | 溶液中的c(H+)·c(OH-)减小 |
| D | 0.1molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 . 下列物质属于强电解质的是
| A.SO3 | B.Fe(OH)3 | C.盐酸 | D.NaOH |
您最近一年使用:0次
2022-10-31更新
|
144次组卷
|
2卷引用:北京师范大学附属中学2020-2021学年高二上学期期中考试化学试题
名校
7 . 研究弱电解质的电离,有重要的实际意义。
Ⅰ、醋酸是一种常见的有机酸
(1)醋酸的电离方程式为___________ 。
(2)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是___________。
(3)将0.1mol·L-1CH3COOH溶液中加水稀释,c(CH3COO-)/c(CH3COOH)的比值将___________ (填“变大”、“不变”或“变小”)。
(4)下列事实不能 说明CH3COOH是弱电解质的是___________(填字母)。
Ⅱ、对比酸性的相对强弱
(5)某些弱酸在25℃时的电离常数如下:
①下列反应可以发生的是___________ (填字母)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
②将20mL1mol·L-1CH3COOH溶液和20mL1mol·L-1HSCN溶液分别与20mL1mol·L-1NaHCO3溶液混合,画出产生的CO2气体体积(V)随时间(t)的变化关系图,并注明对应酸的化学式___________ 。

Ⅰ、醋酸是一种常见的有机酸
(1)醋酸的电离方程式为
(2)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是___________。
| A.c(CH3COO-) | B.c(H+) | C.c(OH-) | D.CH3COOH电离平衡常数 |
(4)下列事实
| A.相同温度下,浓度均为1mol·L-1的盐酸和醋酸的导电性对比:盐酸>醋酸 |
| B.1mol·L-1CH3COONa溶液能使紫色石蕊试液变蓝 |
| C.25℃时,1mol·L-1CH3COOH溶液的pH约为2 |
| D.10mL1mol·L-1的CH3COOH溶液恰好与10mL1mol·L-1NaOH溶液完全反应 |
Ⅱ、对比酸性的相对强弱
(5)某些弱酸在25℃时的电离常数如下:
| 化学式 | CH3COOH | HSCN | HCN | HClO | H2CO3 |
| 电离常数 | 1.8×10-5 | 1.3×10-1 | 4.9×10-10 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
②将20mL1mol·L-1CH3COOH溶液和20mL1mol·L-1HSCN溶液分别与20mL1mol·L-1NaHCO3溶液混合,画出产生的CO2气体体积(V)随时间(t)的变化关系图,并注明对应酸的化学式

您最近一年使用:0次
8 . 下列事实中,能用勒夏特列原理解释的是
| A.火电厂中燃烧煤粉以提高燃煤效率 |
| B.工业合成氨时采用较高的温度(400℃~500℃) |
| C.密闭的注射器中装有NO2和N2O4的混合气体,向外拉活塞,最终气体颜色变浅 |
| D.实验室用排饱和食盐水法收集氯气 |
您最近一年使用:0次
2022-10-31更新
|
187次组卷
|
2卷引用:北京师范大学附属中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
9 . 用O2将HCl转化为Cl2,反应方程式为:4HCl(g)+O2(g) 2H2O(g)+2Cl2(g) △H<0。一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是
2H2O(g)+2Cl2(g) △H<0。一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是
 2H2O(g)+2Cl2(g) △H<0。一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是
2H2O(g)+2Cl2(g) △H<0。一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是| t/min | 0 | 2 | 4 | 6 |
| c(Cl2)/10-3mol·L-1 | 0 | 1.8 | 3.7 | 5.4 |
| A.0~2min的反应速率小于4~6min的反应速率 |
| B.2~6min用O2表示的反应速率为0.910-3mol/(L·min) |
| C.增大压强可以提高HCl转化率 |
| D.平衡常数K(200℃)<K(400℃) |
您最近一年使用:0次
名校
解题方法
10 . 在一定条件下,利用CO2合成CH3OH的反应如下:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
研究发现,反应过程中会有副反应:
②CO2(g)+H2(g) CO(g)+H2O(g) △H2。
CO(g)+H2O(g) △H2。
温度对CH3OH、CO的产率影响如图所示。下列说法中,不正确 的是

①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1研究发现,反应过程中会有副反应:
②CO2(g)+H2(g)
 CO(g)+H2O(g) △H2。
CO(g)+H2O(g) △H2。温度对CH3OH、CO的产率影响如图所示。下列说法中,

| A.△H1<0,△H2>0 |
| B.增大压强有利于提高CH3OH的产率 |
| C.生产过程中,升温加快①的速率,减慢②的速率 |
D.合成CH3OH反应的平衡常数表达式是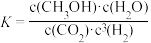 |
您最近一年使用:0次



