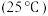名校
解题方法
1 . 某实验小组探究过量甲醛与新制氢氧化铜的反应。
提出猜想:
已知:ⅰ.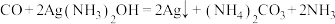
ⅱ.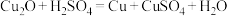
下列说法不正确 的是
提出猜想:

已知:ⅰ.
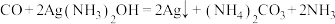
ⅱ.
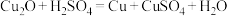

实验步骤 | 实验装置及内容 | 实验现象 |
步骤1 | 如上图装置 | 反应结束后,A中生成红色固体,C无明显变化 |
步骤2 | 将A中混合物过滤,洗涤所得固体,取少量固体于试管中,加入稀硫酸,振荡 | 无明显现象 |
步骤3 | 取步骤2中的滤液于试管中,加入足量稀盐酸 | 无明显现象 |
A.配制银氨溶液时,应向稀 溶液中加入稀氨水,至产生的沉淀恰好溶解 溶液中加入稀氨水,至产生的沉淀恰好溶解 |
B.步骤3目的是检验反应后溶液中是否存在 |
| C.装置B的主要作用是除去挥发的甲酸,防止干扰CO的检验 |
D.该实验中,过量甲醛与新制氢氧化铜可能发生的反应为: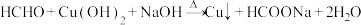 |
您最近一年使用:0次
昨日更新
|
166次组卷
|
3卷引用:北京市东直门中学2023-2024学年高三下学期开学考化学试卷
2 . 一种稳定的水溶性(Co)配合物的结构简式如图(Ac表示 ),该分子可做催化剂,具有高氧态,可以促进水氧化,具有很好的发展前景。
),该分子可做催化剂,具有高氧态,可以促进水氧化,具有很好的发展前景。

回答下列问题:
(1)基态Co的价电子排布式为______ 。Co元素在元素周期表的位置为______ 。
(2)Na、K等金属在焰色试验中可以观察到焰色,Fe、Co等金属则观察不到焰色,请解释原因:______ 。
(3)关于如图所示的配合物,下列说法正确的是______(填标号)。
(4)Co可以形成多种配合物,一种配合物的化学式为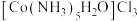 ,该配合物的配体为
,该配合物的配体为______ (填化学式),配位原子的杂化方式为______ 。
(5) 具有钙钛矿型结构,其晶胞结构如图所示,晶胞的另一种表示中Co原子处在各顶点位置,则F原子处于
具有钙钛矿型结构,其晶胞结构如图所示,晶胞的另一种表示中Co原子处在各顶点位置,则F原子处于______ 位置(填“顶点”“棱心”“面心”或“体心”)。已知 的晶体密度为
的晶体密度为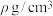 ),晶胞中两个相邻的F原子间的距离为a pm,则阿伏加德罗常数的
),晶胞中两个相邻的F原子间的距离为a pm,则阿伏加德罗常数的 可表示为
可表示为______  (填表达式)。
(填表达式)。

 ),该分子可做催化剂,具有高氧态,可以促进水氧化,具有很好的发展前景。
),该分子可做催化剂,具有高氧态,可以促进水氧化,具有很好的发展前景。
回答下列问题:
(1)基态Co的价电子排布式为
(2)Na、K等金属在焰色试验中可以观察到焰色,Fe、Co等金属则观察不到焰色,请解释原因:
(3)关于如图所示的配合物,下列说法正确的是______(填标号)。
| A.中心原子Co的配体数为6 |
| B.分子式中所含元素电负性最大的是O |
| C.分子中第二周期元素中第一电离能最大的是N |
| D.分子中2个六元环都是平面正六边形 |
(4)Co可以形成多种配合物,一种配合物的化学式为
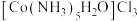 ,该配合物的配体为
,该配合物的配体为(5)
 具有钙钛矿型结构,其晶胞结构如图所示,晶胞的另一种表示中Co原子处在各顶点位置,则F原子处于
具有钙钛矿型结构,其晶胞结构如图所示,晶胞的另一种表示中Co原子处在各顶点位置,则F原子处于 的晶体密度为
的晶体密度为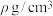 ),晶胞中两个相邻的F原子间的距离为a pm,则阿伏加德罗常数的
),晶胞中两个相邻的F原子间的距离为a pm,则阿伏加德罗常数的 可表示为
可表示为 (填表达式)。
(填表达式)。
您最近一年使用:0次
2024-05-11更新
|
71次组卷
|
2卷引用:陕西省延安市黄龙县中学2023-2024学年高三下学期开学考试理综试卷-高中化学
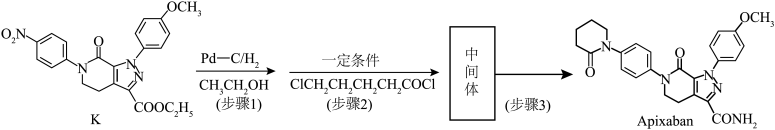
3 . 阿哌沙班(Apixaban)可用于预防膝关节置换手术患者静脉血栓栓塞的发生。下图是阿哌沙班中间体K的一种合成路线:
ii.RCOOR′
______ 。
(2)B→C的化学方程式是
(3)D的分子式为C7H12O4,D的结构简式是______
(4)G→H的化学方程式是______
(5)与F含有相同官能团的同分异构体有______ 种(不考虑手性异构,不含F)
(6)K经多步合成阿哌沙班,结合K的合成路线图,写出中间体的结构简式______ ,步骤3的试剂和反应条件是______ 。
____________________________________________________
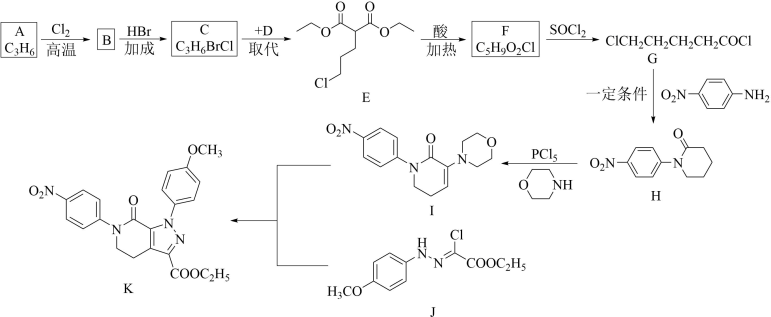

ii.RCOOR′

ⅲ.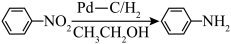
(2)B→C的化学方程式是
(3)D的分子式为C7H12O4,D的结构简式是
(4)G→H的化学方程式是
(5)与F含有相同官能团的同分异构体有
(6)K经多步合成阿哌沙班,结合K的合成路线图,写出中间体的结构简式
元素 | H | C | O |
电负性 | 2.1 | 2.5 | 3.5 |
您最近一年使用:0次
4 . I.硅、锗(32Ge,熔点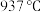 )和镓(32Ga)都是重要的半导体材料,在航空航天测控、核物理探测、光纤通讯、红外光学、太阳能电池、化学催化剂、生物医学等领域都有广泛而重要的应用。锗与硅是同主族元素。
)和镓(32Ga)都是重要的半导体材料,在航空航天测控、核物理探测、光纤通讯、红外光学、太阳能电池、化学催化剂、生物医学等领域都有广泛而重要的应用。锗与硅是同主族元素。
(1)硅在元素周期表中的位置是_______ 。
(2)硅和锗与氯元素都能形成氯化物RCl4(R代表Si和Ge)从原子结构角度解释原因
(3)镓(31Ga)是化学史上第一种先经过理论预言,后在自然界中被发现并验证的元素。基态Ga原子中,核外电子占据的最高能层的符号是______ 。
Ⅱ.氮化硼(BN)是-种高硬度、耐高温、耐腐蚀、高绝缘性的材料。一种获得氮化硼的方法如下:

已知:1.电负性:H 2.1 B 2.0 N 3.0 O 3.5
2.SiC与BN晶体的熔点和硬度数据如下:
(4)NaBH4被认为是有机化学上的“万能还原剂”。从化合价角度分析NaBH4具有强还原性的原因:______ 。
(5)硼酸的化学式为B(OH)3是一元弱酸。
硼酸产生H+过程为: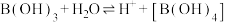
①硼酸分子的空间构型为______ 。
②硼酸具有弱酸性是由于B与水中的OH-形成配位键,描述配位键的形成过程______ 。
(6)某一种氮化硼晶体的晶胞结构如下图:
①B原子的轨道杂化类型为______ 。
②该种氮化硼的熔点和硬度均高于SiC的原因是:______ 。
③已知该晶体的密度为 ,阿伏伽德罗常数为NA,则晶胞的边长为
,阿伏伽德罗常数为NA,则晶胞的边长为______ cm(列计算式)。
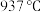 )和镓(32Ga)都是重要的半导体材料,在航空航天测控、核物理探测、光纤通讯、红外光学、太阳能电池、化学催化剂、生物医学等领域都有广泛而重要的应用。锗与硅是同主族元素。
)和镓(32Ga)都是重要的半导体材料,在航空航天测控、核物理探测、光纤通讯、红外光学、太阳能电池、化学催化剂、生物医学等领域都有广泛而重要的应用。锗与硅是同主族元素。(1)硅在元素周期表中的位置是
(2)硅和锗与氯元素都能形成氯化物RCl4(R代表Si和Ge)从原子结构角度解释原因
(3)镓(31Ga)是化学史上第一种先经过理论预言,后在自然界中被发现并验证的元素。基态Ga原子中,核外电子占据的最高能层的符号是
Ⅱ.氮化硼(BN)是-种高硬度、耐高温、耐腐蚀、高绝缘性的材料。一种获得氮化硼的方法如下:

已知:1.电负性:H 2.1 B 2.0 N 3.0 O 3.5
2.SiC与BN晶体的熔点和硬度数据如下:
物质 | 熔点/ | 硬度 |
碳化硅(SiC) | 2830 | 9-9.5 |
氮化棚(BN) | 3000 | 9.5 |
(5)硼酸的化学式为B(OH)3是一元弱酸。
硼酸产生H+过程为:
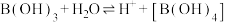
①硼酸分子的空间构型为
②硼酸具有弱酸性是由于B与水中的OH-形成配位键,描述配位键的形成过程
(6)某一种氮化硼晶体的晶胞结构如下图:
①B原子的轨道杂化类型为
②该种氮化硼的熔点和硬度均高于SiC的原因是:
③已知该晶体的密度为
 ,阿伏伽德罗常数为NA,则晶胞的边长为
,阿伏伽德罗常数为NA,则晶胞的边长为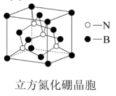
您最近一年使用:0次
5 . 烟气脱硫脱硝技术是环境科学研究的热点。某小组模拟O3氧化结合(NH4)2SO3溶液吸收法同时脱除SO2和NO。气体反应器中的主要反应原理及相关数据如下表。
不正确 的是
反应 | 平衡常数 | 活化能/ |
 |  | 24.6 |
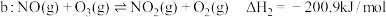 | 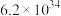 | 3.17 |
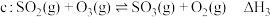 | 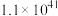 | 58.17 |
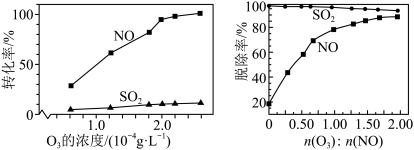
A.已知: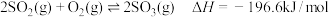 则 则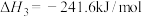 |
| B.其他条件不变,在相同时间内,SO2和NO的转化率均随温度升高而降低 |
| C.其他条件不变,在相同时间内,随O3浓度的升高,NO的转化率远远高于SO2的转化率 |
| D.其他条件不变,在相同时间内,O3的浓度很低时,SO2的脱除率远高于NO的脱除率,因为反应c速率大于反应b |
您最近一年使用:0次
6 . 下列事实能用平衡移动原理解释的是
| A.合成氨工业中使用铁触媒作催化剂 |
B.铁钉放入浓 中不再变化后,加热能产生大量红棕色气体 中不再变化后,加热能产生大量红棕色气体 |
C.氯碱工业中阳极区的溶液用盐酸调pH为2~3,促进 的产生 的产生 |
D.锌片与稀 反应过程中,加入少量 反应过程中,加入少量 固体,促进 固体,促进 的产生 的产生 |
您最近一年使用:0次
名校
解题方法
7 . 治疗心力衰竭药物沙库巴曲的合成路线如下:_______ 。
(2)A→B的反应中,已知NaClO被还原为NaCl,理论上反应 物质A,至少需要NaClO的物质的量为
物质A,至少需要NaClO的物质的量为_______ 。
(3)B的结构简式是_______ 。
(4)D→E中步骤i反应的化学方程式是_______ 。
(5)E→F反应类型是_______ ,F→G反应类型是_______ 。
(6)G与H生成沙库巴曲的反应原子利用率为100%,H分子中只有一种化学环境的氢。
①下列关于H的说法正确的是_______ (填字母序号)。
a.分子式为C4H4O3
b.分子中所有碳原子的杂化类型均相同
c.官能团为酯基和酮羰基
d.存在同时含有碳碳三键、羧基和羟基的同分异构体
已知i.
ⅱ.C2H2与甲醛反应和苯酚与甲醛反应类型相同,且产物中包含相同种类官能团。
请参照题干合成路线的表示方法,设计以C2H2、HCHO为有机原料(无机原料任选)合成H的路线_______ 。
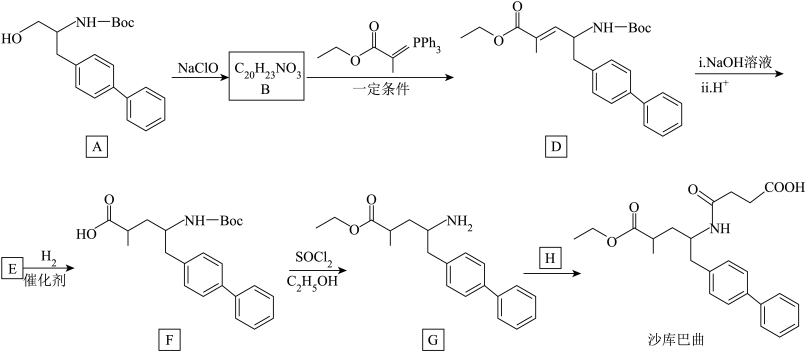
已知:-Boc结构简式为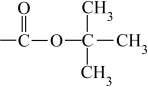
(2)A→B的反应中,已知NaClO被还原为NaCl,理论上反应
 物质A,至少需要NaClO的物质的量为
物质A,至少需要NaClO的物质的量为(3)B的结构简式是
(4)D→E中步骤i反应的化学方程式是
(5)E→F反应类型是
(6)G与H生成沙库巴曲的反应原子利用率为100%,H分子中只有一种化学环境的氢。
①下列关于H的说法正确的是
a.分子式为C4H4O3
b.分子中所有碳原子的杂化类型均相同
c.官能团为酯基和酮羰基
d.存在同时含有碳碳三键、羧基和羟基的同分异构体
②H与另一有机物I在一定条件下可以反应生成聚合物PBS(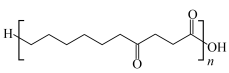 ),写出该反应的化学方程式
),写出该反应的化学方程式
已知i.

ⅱ.C2H2与甲醛反应和苯酚与甲醛反应类型相同,且产物中包含相同种类官能团。
请参照题干合成路线的表示方法,设计以C2H2、HCHO为有机原料(无机原料任选)合成H的路线

您最近一年使用:0次
解题方法
8 . 利用 合成甲醇可减少
合成甲醇可减少 的排放,反应方程式为
的排放,反应方程式为
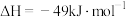 。回答下列问题:
。回答下列问题:
(1)该反应一般认为通过如下步骤来实现:
①

②
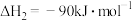
基态C原子的价电子排布图为___________ 。
___________  ;若反应①为慢反应,请画出上述反应过程的能量变化示意图。
;若反应①为慢反应,请画出上述反应过程的能量变化示意图。___________ 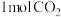 和
和 充入容积为1 L的恒容密闭容器中,通过两种不同的催化剂(
充入容积为1 L的恒容密闭容器中,通过两种不同的催化剂( 、
、 )进行合成甲醇的总反应,相同时间内测得
)进行合成甲醇的总反应,相同时间内测得 的转化率a(
的转化率a( )随温度变化的曲线如图所示。
)随温度变化的曲线如图所示。___________ (填“是”或“不是”)反应的平衡点。
②催化剂 条件下,当温度高于
条件下,当温度高于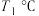 时,
时, 转化率随温度升高而降低的原因可能是
转化率随温度升高而降低的原因可能是___________ 。
③假设催化剂 在所给温度范围内活性无明显变化,根据图中数据计算
在所给温度范围内活性无明显变化,根据图中数据计算 下该反应的平衡常数为
下该反应的平衡常数为___________  (保留两位有效数字)。
(保留两位有效数字)。
(3)某科学实验小组将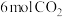 和
和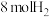 充入一容积为2 L的恒容、恒温密闭容器中发生合成甲醇的总反应,测得
充入一容积为2 L的恒容、恒温密闭容器中发生合成甲醇的总反应,测得 的物质的量随时间的变化如图中实线所示(图中字母后的数字表示对应的坐标)。
的物质的量随时间的变化如图中实线所示(图中字母后的数字表示对应的坐标)。___________ 。
A.与实线相比,曲线 改变的条件可能是升高温度
改变的条件可能是升高温度
B.与实线相比,曲线 改变的条件可能是增大压强
改变的条件可能是增大压强
C.实线中在0~3 min和3~8 min内 的平均反应速率:
的平均反应速率: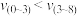
D.容器中混合气体的密度不变说明反应已达到平衡状态
②若实线对应条件下平衡常数为K,曲线 对应条件下平衡常数为
对应条件下平衡常数为 ,曲线
,曲线 对应条件下平衡常数为
对应条件下平衡常数为 ,则K、
,则K、 和
和 的大小关系是
的大小关系是___________ 。
 合成甲醇可减少
合成甲醇可减少 的排放,反应方程式为
的排放,反应方程式为
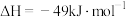 。回答下列问题:
。回答下列问题:(1)该反应一般认为通过如下步骤来实现:
①


②

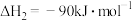
基态C原子的价电子排布图为

 ;若反应①为慢反应,请画出上述反应过程的能量变化示意图。
;若反应①为慢反应,请画出上述反应过程的能量变化示意图。
 和
和 充入容积为1 L的恒容密闭容器中,通过两种不同的催化剂(
充入容积为1 L的恒容密闭容器中,通过两种不同的催化剂( 、
、 )进行合成甲醇的总反应,相同时间内测得
)进行合成甲醇的总反应,相同时间内测得 的转化率a(
的转化率a( )随温度变化的曲线如图所示。
)随温度变化的曲线如图所示。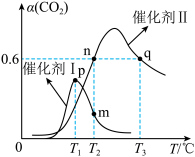
②催化剂
 条件下,当温度高于
条件下,当温度高于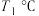 时,
时, 转化率随温度升高而降低的原因可能是
转化率随温度升高而降低的原因可能是③假设催化剂
 在所给温度范围内活性无明显变化,根据图中数据计算
在所给温度范围内活性无明显变化,根据图中数据计算 下该反应的平衡常数为
下该反应的平衡常数为 (保留两位有效数字)。
(保留两位有效数字)。(3)某科学实验小组将
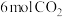 和
和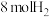 充入一容积为2 L的恒容、恒温密闭容器中发生合成甲醇的总反应,测得
充入一容积为2 L的恒容、恒温密闭容器中发生合成甲醇的总反应,测得 的物质的量随时间的变化如图中实线所示(图中字母后的数字表示对应的坐标)。
的物质的量随时间的变化如图中实线所示(图中字母后的数字表示对应的坐标)。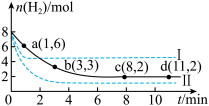
A.与实线相比,曲线
 改变的条件可能是升高温度
改变的条件可能是升高温度B.与实线相比,曲线
 改变的条件可能是增大压强
改变的条件可能是增大压强C.实线中在0~3 min和3~8 min内
 的平均反应速率:
的平均反应速率: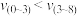
D.容器中混合气体的密度不变说明反应已达到平衡状态
②若实线对应条件下平衡常数为K,曲线
 对应条件下平衡常数为
对应条件下平衡常数为 ,曲线
,曲线 对应条件下平衡常数为
对应条件下平衡常数为 ,则K、
,则K、 和
和 的大小关系是
的大小关系是
您最近一年使用:0次
解题方法
9 . 消毒剂对新冠疫情防控有着重要作用。过氧乙酸( )是一种常用的消毒剂,易溶于水,有强氧化性,温度高于40 ℃易分解。制备过氧乙酸的一种方法如下(装置如图所示)。
)是一种常用的消毒剂,易溶于水,有强氧化性,温度高于40 ℃易分解。制备过氧乙酸的一种方法如下(装置如图所示)。 .将冰醋酸、
.将冰醋酸、 在三颈烧瓶中混合,置于冰水浴中,不断搅拌下,分批缓慢加入浓硫酸。
在三颈烧瓶中混合,置于冰水浴中,不断搅拌下,分批缓慢加入浓硫酸。
 .常温下搅拌48小时。
.常温下搅拌48小时。
 .分离出过氧乙酸。
.分离出过氧乙酸。
 .检测产品纯度。
.检测产品纯度。
回答下列问题:
(1)仪器a的名称是___________ ,该仪器的出水口是___________ (填“b”或“c”)。
(2)步骤 中,分批缓慢加入浓硫酸并使用冰水浴,目的是
中,分批缓慢加入浓硫酸并使用冰水浴,目的是___________ 。
(3)制备过氧乙酸反应的化学方程式是___________ 。
(4)步骤 中,分离出过氧乙酸的方法是减压蒸馏,采用该方法的原因是
中,分离出过氧乙酸的方法是减压蒸馏,采用该方法的原因是___________ 。
(5)步骤 检测产品(含有杂质
检测产品(含有杂质 和
和 )中过氧乙酸的含量的方法如下。
)中过氧乙酸的含量的方法如下。
i.称取3.000 g样品,溶解,在100 mL容量瓶中定容。
ii.在锥形瓶中加入10.00 mL待测液、5 mL硫酸,用 高锰酸钾标准溶液滴定至溶液呈浅红色,消耗高锰酸钾标准溶液
高锰酸钾标准溶液滴定至溶液呈浅红色,消耗高锰酸钾标准溶液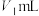 ,高锰酸钾完全参与反应。
,高锰酸钾完全参与反应。
iii.再向锥形瓶中加入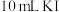 溶液(足量),摇匀后在暗处放置5 min,用
溶液(足量),摇匀后在暗处放置5 min,用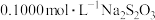 ,标准溶液滴定(指示剂是淀粉),消耗
,标准溶液滴定(指示剂是淀粉),消耗 标准溶液
标准溶液 。
。
已知:(i)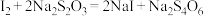 。
。
(ii)酸性环境中 和
和 都能将
都能将 氧化为
氧化为 。
。
(iii)酸性环境中 不能氧化
不能氧化 。
。
①步骤iii中判断滴定终点的现象是___________ 。
②步骤ii的作用是___________ 。
③产品中过氧乙酸的质量分数是___________ (用代数式表示)。
 )是一种常用的消毒剂,易溶于水,有强氧化性,温度高于40 ℃易分解。制备过氧乙酸的一种方法如下(装置如图所示)。
)是一种常用的消毒剂,易溶于水,有强氧化性,温度高于40 ℃易分解。制备过氧乙酸的一种方法如下(装置如图所示)。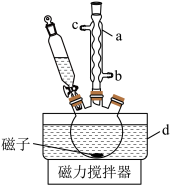
 .将冰醋酸、
.将冰醋酸、 在三颈烧瓶中混合,置于冰水浴中,不断搅拌下,分批缓慢加入浓硫酸。
在三颈烧瓶中混合,置于冰水浴中,不断搅拌下,分批缓慢加入浓硫酸。 .常温下搅拌48小时。
.常温下搅拌48小时。 .分离出过氧乙酸。
.分离出过氧乙酸。 .检测产品纯度。
.检测产品纯度。回答下列问题:
(1)仪器a的名称是
(2)步骤
 中,分批缓慢加入浓硫酸并使用冰水浴,目的是
中,分批缓慢加入浓硫酸并使用冰水浴,目的是(3)制备过氧乙酸反应的化学方程式是
(4)步骤
 中,分离出过氧乙酸的方法是减压蒸馏,采用该方法的原因是
中,分离出过氧乙酸的方法是减压蒸馏,采用该方法的原因是(5)步骤
 检测产品(含有杂质
检测产品(含有杂质 和
和 )中过氧乙酸的含量的方法如下。
)中过氧乙酸的含量的方法如下。i.称取3.000 g样品,溶解,在100 mL容量瓶中定容。
ii.在锥形瓶中加入10.00 mL待测液、5 mL硫酸,用
 高锰酸钾标准溶液滴定至溶液呈浅红色,消耗高锰酸钾标准溶液
高锰酸钾标准溶液滴定至溶液呈浅红色,消耗高锰酸钾标准溶液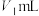 ,高锰酸钾完全参与反应。
,高锰酸钾完全参与反应。iii.再向锥形瓶中加入
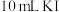 溶液(足量),摇匀后在暗处放置5 min,用
溶液(足量),摇匀后在暗处放置5 min,用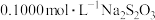 ,标准溶液滴定(指示剂是淀粉),消耗
,标准溶液滴定(指示剂是淀粉),消耗 标准溶液
标准溶液 。
。已知:(i)
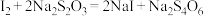 。
。(ii)酸性环境中
 和
和 都能将
都能将 氧化为
氧化为 。
。(iii)酸性环境中
 不能氧化
不能氧化 。
。①步骤iii中判断滴定终点的现象是
②步骤ii的作用是
③产品中过氧乙酸的质量分数是
您最近一年使用:0次
10 . 标准状况下,反应物和生成物的相对能量与反应历程示意图如图所示[已知 的相对能量为0],下列说法错误的是
的相对能量为0],下列说法错误的是
 的相对能量为0],下列说法错误的是
的相对能量为0],下列说法错误的是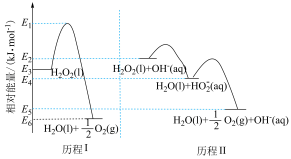
| A.E2-E3=E5-E6 |
| B.相同条件下,H2O2的平衡转化率:历程I=历程Ⅱ |
C.由历程Ⅱ可计算H2O2中H-O键的键能为2(E2-E4) |
D.历程I、历程Ⅱ中速率最快的一步的热化学方程式:H2O2(l)+OH-(aq)=H2O(l)+HO (aq) (aq)  (E4-E2) (E4-E2) |
您最近一年使用:0次