解题方法
1 . 黄铜矿的主要成份是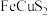 ,以
,以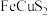 为原料实现如下转化:
为原料实现如下转化:
(1)写出溶液A中的所有阳离子___________ , 的作用
的作用___________ 。
(2)下列说法正确的是___________。
(3) 等锰(Ⅱ)的化合物可制备
等锰(Ⅱ)的化合物可制备 。
。 隔绝空气受热分解生成
隔绝空气受热分解生成 ,产物中无单质,写出该反应的化学方程式
,产物中无单质,写出该反应的化学方程式___________ 。请设计实验方案验证气体产物___________ 。
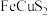 ,以
,以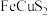 为原料实现如下转化:
为原料实现如下转化: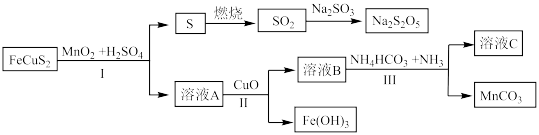
(1)写出溶液A中的所有阳离子
 的作用
的作用(2)下列说法正确的是___________。
| A.S单质存在于火山口或地壳的岩层中 |
B.溶液C含有 |
C. 的水溶液显碱性 的水溶液显碱性 |
D.依据转化关系可知: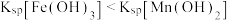 |
(3)
 等锰(Ⅱ)的化合物可制备
等锰(Ⅱ)的化合物可制备 。
。 隔绝空气受热分解生成
隔绝空气受热分解生成 ,产物中无单质,写出该反应的化学方程式
,产物中无单质,写出该反应的化学方程式
您最近一年使用:0次
解题方法
2 . 硼酸(H3BO3)是一种一元弱酸,微溶于水,回答下列问题.
(1)H3BO3本身不能电离,只能通过结合来自水中的OH-而释放出H+,试写出H3BO3溶液的电离方程式______ ,该物质的电离方式和中学另一种常见物质的电离相似,该物质是(写化学式)______ ;
(2)硼砂(Na2B4O7▪10H2O)是硼酸的一种重要钠盐,工业上可利用碳碱法制取,以下是某化工集团利用合成氨脱碳尾气生产硼砂及其它化工产品的流程图.

回答下列问题:
①合成氨常用CH4与水蒸气反应,制取H2的同时获得脱碳尾气(上述流程图中的某物质),所发生的化学方程式为___________________ .
②轻质碳酸镁的组成可表示为xMgCO3.yMg(OH)2.zH2O,某小组为测定其成份,准确称取2.33g样品,充分加热后称得剩余物质质量为1.00g,所得气体经浓硫酸吸收,浓硫酸增重0.45g,则该轻质碳酸镁的化学式为:______________________ .
③结合②中的结论,推测该工厂生产硼砂溶液的化学方程式为:_________________ .
④a处的操作为:____________________ .
⑤该工艺可实现多种产品的联产,其中属于联产产品的是_______________________ .
a.轻质碳酸镁 b.轻质氧化镁 c.液态二氧化碳 d.纯碱.
(1)H3BO3本身不能电离,只能通过结合来自水中的OH-而释放出H+,试写出H3BO3溶液的电离方程式
(2)硼砂(Na2B4O7▪10H2O)是硼酸的一种重要钠盐,工业上可利用碳碱法制取,以下是某化工集团利用合成氨脱碳尾气生产硼砂及其它化工产品的流程图.

回答下列问题:
①合成氨常用CH4与水蒸气反应,制取H2的同时获得脱碳尾气(上述流程图中的某物质),所发生的化学方程式为
②轻质碳酸镁的组成可表示为xMgCO3.yMg(OH)2.zH2O,某小组为测定其成份,准确称取2.33g样品,充分加热后称得剩余物质质量为1.00g,所得气体经浓硫酸吸收,浓硫酸增重0.45g,则该轻质碳酸镁的化学式为:
③结合②中的结论,推测该工厂生产硼砂溶液的化学方程式为:
④a处的操作为:
⑤该工艺可实现多种产品的联产,其中属于联产产品的是
a.轻质碳酸镁 b.轻质氧化镁 c.液态二氧化碳 d.纯碱.
您最近一年使用:0次
名校
解题方法
3 . 已知 在
在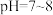 时溶解度最小。某工厂利用钒铬渣提取液(主要成分为
时溶解度最小。某工厂利用钒铬渣提取液(主要成分为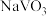 和
和 )制备
)制备 和
和 晶体,流程如下:
晶体,流程如下:
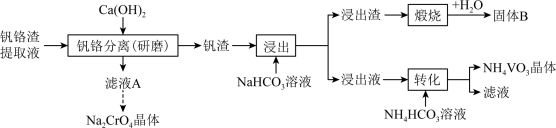
不同温度下相关物质的溶解度
(1)关于“钒铬分离”过程,下列说法正确的是_______。
(2)从滤液A中获取 晶体时,应采用的结晶方法为
晶体时,应采用的结晶方法为_______ ;残留的含铬废水不能直接排放,处理时需要经过“酸化→还原→沉降”三个步骤用 溶液还原时,还原产物为
溶液还原时,还原产物为 ,则反应的离子方程式
,则反应的离子方程式_______ 。
(3)钒渣成份是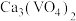 ,“浸出”过程中生成
,“浸出”过程中生成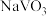 的离子方程式为
的离子方程式为_______ 。
(4)“转化”过程中选用 溶液不选用
溶液不选用 溶液的可能原因为
溶液的可能原因为_______ 。(写一条原因即可)
(5)该流程中可循环利用的物质有_______ 。
(6)研究表明 固体(固体的组成用
固体(固体的组成用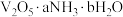 表示)热分解得到
表示)热分解得到 的过程可分为四步,每一步产生
的过程可分为四步,每一步产生 和
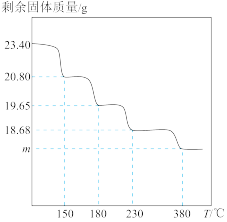
和 的物质的量之比依次为2∶1、3∶1、3∶2、3∶2,取
的物质的量之比依次为2∶1、3∶1、3∶2、3∶2,取 固体进行热重分析,剩余固体质量与温度关系如图,
固体进行热重分析,剩余固体质量与温度关系如图, 时剩余固体的组成可表示为:
时剩余固体的组成可表示为:_______ 。
 在
在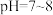 时溶解度最小。某工厂利用钒铬渣提取液(主要成分为
时溶解度最小。某工厂利用钒铬渣提取液(主要成分为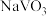 和
和 )制备
)制备 和
和 晶体,流程如下:
晶体,流程如下:
不同温度下相关物质的溶解度
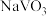 |  | 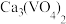 | 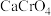 | |
 | 19.3 | 84.0 | 0.1 | 5.5 |
 | 22.5 | 96.5 | 0.09 | 2.49 |
 | 26.3 | 102 | 0.09 | 1.3 |
A.研磨可防止生成的沉淀覆在 表面,提高 表面,提高 利用率 利用率 |
| B.研磨减小了所得钒渣的粒径,提高了后续步骤中钒渣的浸出率 |
C.相对于 、 、 ,工业上更宜选用 ,工业上更宜选用 |
| D.该过程发生了氧化还原反应 |
 晶体时,应采用的结晶方法为
晶体时,应采用的结晶方法为 溶液还原时,还原产物为
溶液还原时,还原产物为 ,则反应的离子方程式
,则反应的离子方程式(3)钒渣成份是
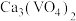 ,“浸出”过程中生成
,“浸出”过程中生成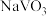 的离子方程式为
的离子方程式为(4)“转化”过程中选用
 溶液不选用
溶液不选用 溶液的可能原因为
溶液的可能原因为
(5)该流程中可循环利用的物质有
(6)研究表明
 固体(固体的组成用
固体(固体的组成用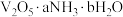 表示)热分解得到
表示)热分解得到 的过程可分为四步,每一步产生
的过程可分为四步,每一步产生 和
和 的物质的量之比依次为2∶1、3∶1、3∶2、3∶2,取
的物质的量之比依次为2∶1、3∶1、3∶2、3∶2,取 固体进行热重分析,剩余固体质量与温度关系如图,
固体进行热重分析,剩余固体质量与温度关系如图, 时剩余固体的组成可表示为:
时剩余固体的组成可表示为:
您最近一年使用:0次
13-14高三上·江苏扬州·阶段练习
4 . 以钡矿粉(主要成份为BaCO3,含有Ca2+、Fe2+、Fe3+、Mg2+等)制备BaCl2·2H2O的流程如下:
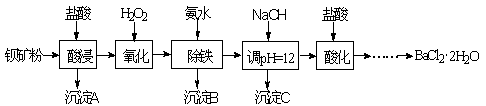
(1)氧化过程主要反应的离子方程式为______ 。
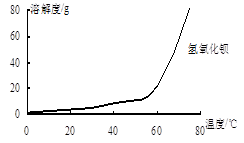
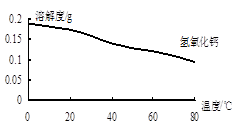
(2)沉淀C的主要成分是Ca(OH)2和______ 。由图可知,为了更好的使Ca2+沉淀,还应采取的措施为______ 。
(3)用BaSO4重量法测定产品纯度的步骤为:
步骤1:准确称取0.4~0.6 g BaCl2·2H2O试样,加入100 ml 水,3 ml 2 mol·L-1的HCl溶液加热溶解。
步骤2:边搅拌,边逐滴加入0.1 mol·L-1 H2SO4溶液。
步骤3:待BaSO4沉降后,______,确认已完全沉淀。
步骤4:过滤,用0.01 mol·L-1的稀H2SO4洗涤沉淀3~4次,直至洗涤液中不含Cl-为止。
步骤5:将折叠的沉淀滤纸包置于______中,经烘干、炭化、灰化后在800℃灼烧至恒重。称量计算BaCl2·2H2O中Ba2+的含量。
①步骤3所缺的操作为______ 。
②若步骤1称量的样品过少,则在步骤4洗涤时可能造成的影响为______ 。
③步骤5所用瓷质仪器名称为______ 。滤纸灰化时空气要充足,否则BaSO4易被残留的炭还原生成BaS,该反应的化学方程式为______ 。
④有同学认为用K2CrO4代替H2SO4作沉淀剂效果更好,请说明原因______ 。[已知:Ksp(BaSO4)=1.1×10-10 Ksp(BaCrO4)=1.2×10-10]

(1)氧化过程主要反应的离子方程式为
(2)沉淀C的主要成分是Ca(OH)2和


(3)用BaSO4重量法测定产品纯度的步骤为:
步骤1:准确称取0.4~0.6 g BaCl2·2H2O试样,加入100 ml 水,3 ml 2 mol·L-1的HCl溶液加热溶解。
步骤2:边搅拌,边逐滴加入0.1 mol·L-1 H2SO4溶液。
步骤3:待BaSO4沉降后,______,确认已完全沉淀。
步骤4:过滤,用0.01 mol·L-1的稀H2SO4洗涤沉淀3~4次,直至洗涤液中不含Cl-为止。
步骤5:将折叠的沉淀滤纸包置于______中,经烘干、炭化、灰化后在800℃灼烧至恒重。称量计算BaCl2·2H2O中Ba2+的含量。
①步骤3所缺的操作为
②若步骤1称量的样品过少,则在步骤4洗涤时可能造成的影响为
③步骤5所用瓷质仪器名称为
④有同学认为用K2CrO4代替H2SO4作沉淀剂效果更好,请说明原因
您最近一年使用:0次
名校
5 . 化学小组实验探究SO2与新制氢氧化铜悬浊液的反应。
(1)实验一:试剂瓶丙盛有新制纯净的Cu(OH)2悬浊液,制备SO2(夹持、加热仪器略),并向丙中通入足量SO2。开始可观察到丙中局部有浅黄色固体生成,Cu(OH)2全部溶解后得到蓝色溶液A和少量紫红色固体B。
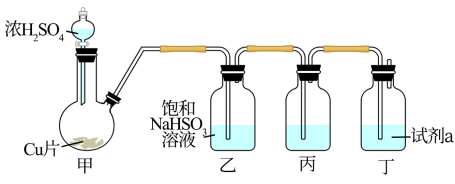
①浓H2SO4与Cu片反应的化学方程式是___ 。
②试剂a为____ 。
(2)分析物质性质,紫红色固体B应为___ 。用pH试纸测定淡绿色溶液A的pH约为3,向该溶液中鼓入足量氮气后溶液变蓝,预测浅黄色固体物质为中间产物Cu2O,写出生成Cu2O的化学反应方程式____ (资料:Cu2O酸性条件下不稳定,Cu2O+2H+=Cu+Cu2++H2O)
(3)为进一步验证SO2与Cu(OH)2悬浊液反应过程中产生Cu(I)。
实验二:向CuCl2溶液中加入NaOH溶液至恰好完全反应,得含NaCl的Cu(OH)2悬浊液,将此悬浊液加入丙中,重复上述实验。开始可观察到局部有浅黄色固体物质生成,Cu(OH)2全部溶解后丙底部有较多的白色沉淀C,上层是淡绿色的溶液A。
(资料:[Cu(NH3)2]+]无色,易被氧化为深蓝色[Cu(NH3)4]2+])
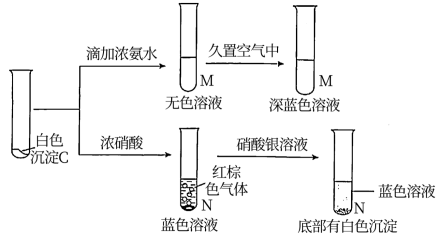
①试管N中加入硝酸银溶液后生成白色沉淀,证明白色沉淀C中含有的阴离子为___ ;试管M中无色溶液的主要成份为____ (写化学式)。
②C与浓硝酸反应的离子方程式为___ 。
(1)实验一:试剂瓶丙盛有新制纯净的Cu(OH)2悬浊液,制备SO2(夹持、加热仪器略),并向丙中通入足量SO2。开始可观察到丙中局部有浅黄色固体生成,Cu(OH)2全部溶解后得到蓝色溶液A和少量紫红色固体B。

①浓H2SO4与Cu片反应的化学方程式是
②试剂a为
(2)分析物质性质,紫红色固体B应为
(3)为进一步验证SO2与Cu(OH)2悬浊液反应过程中产生Cu(I)。
实验二:向CuCl2溶液中加入NaOH溶液至恰好完全反应,得含NaCl的Cu(OH)2悬浊液,将此悬浊液加入丙中,重复上述实验。开始可观察到局部有浅黄色固体物质生成,Cu(OH)2全部溶解后丙底部有较多的白色沉淀C,上层是淡绿色的溶液A。
(资料:[Cu(NH3)2]+]无色,易被氧化为深蓝色[Cu(NH3)4]2+])

①试管N中加入硝酸银溶液后生成白色沉淀,证明白色沉淀C中含有的阴离子为
②C与浓硝酸反应的离子方程式为
您最近一年使用:0次
6 . 在众多的新能源中,氢能将会成为21世纪最理想的能源。
Ⅰ. 已知101kPa、25℃时,1mol下列物质完全燃烧生成稳定状态化合物时放出的热量数据如下:
(1)H2燃烧的热化学方程式是_____________________ 。
(2)H2可以代替原煤和汽油作为新能源的依据是_____________________ 。
(3)工业上电解饱和食盐水的副产物之一是H2,反应的离子方程式是_____________ 。
Ⅱ. 如图所示,硫酸工业中产生的SO2通过下列过程既能制得H2SO4又能制得H2。
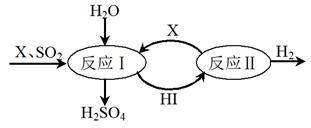
请回答:
(1)该过程可循环利用的物质是_______________ (写化学式)。
(2)该过程总反应的化学方程式是_____________________ 。
(3)尾气中的SO2可用NaOH溶液吸收,同时可得含Na2SO3的样品,为测定样品中Na2SO3的质量分数,甲同学设计实验如下(夹持及加热装置略):
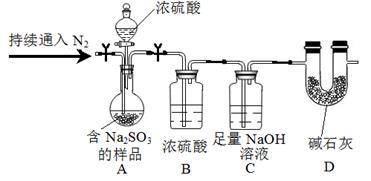
① 装置B的作用是____________ 。
② 测定样品中Na2SO3的质量分数所需的数据是_____________ 。
Ⅰ. 已知101kPa、25℃时,1mol下列物质完全燃烧生成稳定状态化合物时放出的热量数据如下:
| 物质 | 氢气 | 原煤 (主要成份是C) | 汽油 (主要成份C8H18) |
| 热量(kJ) | 285.8 | 250.9 | 4910 |
(1)H2燃烧的热化学方程式是
(2)H2可以代替原煤和汽油作为新能源的依据是
(3)工业上电解饱和食盐水的副产物之一是H2,反应的离子方程式是
Ⅱ. 如图所示,硫酸工业中产生的SO2通过下列过程既能制得H2SO4又能制得H2。

请回答:
(1)该过程可循环利用的物质是
(2)该过程总反应的化学方程式是
(3)尾气中的SO2可用NaOH溶液吸收,同时可得含Na2SO3的样品,为测定样品中Na2SO3的质量分数,甲同学设计实验如下(夹持及加热装置略):

① 装置B的作用是
② 测定样品中Na2SO3的质量分数所需的数据是
您最近一年使用:0次
7 . 硫代硫酸钠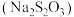 是一种常见的滴定剂和重要化工原料。工业上常用硫化碱法制备硫代硫酸钠(将
是一种常见的滴定剂和重要化工原料。工业上常用硫化碱法制备硫代硫酸钠(将 和
和 以
以 的物质的量之比配成溶液,再通入
的物质的量之比配成溶液,再通入 ),实验室模拟该制备原理设计的装置如图所示。
),实验室模拟该制备原理设计的装置如图所示。 固体的仪器的名称是
固体的仪器的名称是___________ ;装置B的作用是___________ 。
(2)配制混合溶液a的步骤:i.将 固体溶于“去氧水”中配成溶液(“去氧水”是指先煮沸一段时间,然后冷却至室温的蒸馏水);ⅱ.将
固体溶于“去氧水”中配成溶液(“去氧水”是指先煮沸一段时间,然后冷却至室温的蒸馏水);ⅱ.将 固体溶于
固体溶于 溶液中。第i步采用“去氧水”的目的是
溶液中。第i步采用“去氧水”的目的是___________ ,装置C中发生反应的化学方程式为___________ 。
(3)装置C中 不宜通入过多,其原因是
不宜通入过多,其原因是___________ 。
(4) 容易变质,可利用氧化还原反应测定其纯度(假设杂质不参加反应):称取
容易变质,可利用氧化还原反应测定其纯度(假设杂质不参加反应):称取 样品,配制成
样品,配制成 溶液。取
溶液。取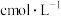 的
的 标准溶液
标准溶液 ,用硫酸酸化后加入过量
,用硫酸酸化后加入过量 ,摇匀后置于暗处,充分反应后加入少量淀粉溶液,然后用
,摇匀后置于暗处,充分反应后加入少量淀粉溶液,然后用 样品溶液滴定,恰好消耗
样品溶液滴定,恰好消耗 时达到滴定终点[已知:
时达到滴定终点[已知: (未配平)、
(未配平)、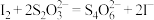 ]。
]。
①达到滴定终点的标志为___________ 。
②样品中 的纯度为
的纯度为___________ %(用含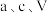 的代数式表示)。
的代数式表示)。
③诺样品中有未反应的 ,会导致测得的
,会导致测得的 的纯度
的纯度___________ (填“偏高”“偏低”或“无影响”)。
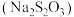 是一种常见的滴定剂和重要化工原料。工业上常用硫化碱法制备硫代硫酸钠(将
是一种常见的滴定剂和重要化工原料。工业上常用硫化碱法制备硫代硫酸钠(将 和
和 以
以 的物质的量之比配成溶液,再通入
的物质的量之比配成溶液,再通入 ),实验室模拟该制备原理设计的装置如图所示。
),实验室模拟该制备原理设计的装置如图所示。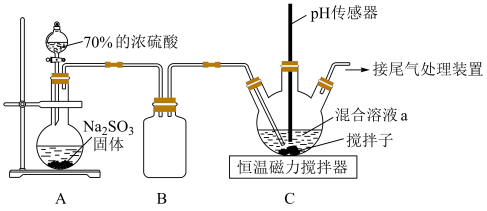
 固体的仪器的名称是
固体的仪器的名称是(2)配制混合溶液a的步骤:i.将
 固体溶于“去氧水”中配成溶液(“去氧水”是指先煮沸一段时间,然后冷却至室温的蒸馏水);ⅱ.将
固体溶于“去氧水”中配成溶液(“去氧水”是指先煮沸一段时间,然后冷却至室温的蒸馏水);ⅱ.将 固体溶于
固体溶于 溶液中。第i步采用“去氧水”的目的是
溶液中。第i步采用“去氧水”的目的是(3)装置C中
 不宜通入过多,其原因是
不宜通入过多,其原因是(4)
 容易变质,可利用氧化还原反应测定其纯度(假设杂质不参加反应):称取
容易变质,可利用氧化还原反应测定其纯度(假设杂质不参加反应):称取 样品,配制成
样品,配制成 溶液。取
溶液。取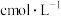 的
的 标准溶液
标准溶液 ,用硫酸酸化后加入过量
,用硫酸酸化后加入过量 ,摇匀后置于暗处,充分反应后加入少量淀粉溶液,然后用
,摇匀后置于暗处,充分反应后加入少量淀粉溶液,然后用 样品溶液滴定,恰好消耗
样品溶液滴定,恰好消耗 时达到滴定终点[已知:
时达到滴定终点[已知: (未配平)、
(未配平)、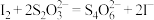 ]。
]。①达到滴定终点的标志为
②样品中
 的纯度为
的纯度为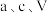 的代数式表示)。
的代数式表示)。③诺样品中有未反应的
 ,会导致测得的
,会导致测得的 的纯度
的纯度
您最近一年使用:0次
解题方法
8 . 铁酸锌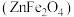 是一种性能优良的软磁材料,可作烯类有机化合物氧化脱氢的催化剂。实验室制备铁酸锌可采用如下步骤:
是一种性能优良的软磁材料,可作烯类有机化合物氧化脱氢的催化剂。实验室制备铁酸锌可采用如下步骤:
Ⅰ.制备前驱物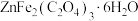
①分别配制 溶液和
溶液和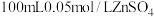 溶液,并将二者混合备用。
溶液,并将二者混合备用。
②另外称取 溶于
溶于 蒸馏水中。
蒸馏水中。
③将①和②所得溶液混合加热到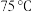 ,并在
,并在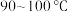 加热搅拌
加热搅拌 ;待溶液冷却后进行减压过滤、洗涤,干燥,得到前驱物。
;待溶液冷却后进行减压过滤、洗涤,干燥,得到前驱物。
Ⅱ.制备铁酸锌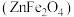
将步骤Ⅰ所得前驱物在 灼烧
灼烧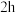 ,冷却后称量质量为
,冷却后称量质量为 ,计算产率。
,计算产率。
回答下列问题:
(1)步骤Ⅰ中配制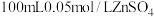 溶液需要的玻璃仪器有烧杯、量筒、胶头滴管、
溶液需要的玻璃仪器有烧杯、量筒、胶头滴管、 容量瓶和
容量瓶和___________ 。下列关于容量瓶的操作,正确的是___________ (填标号)。 晶体,加水溶解,滴加
晶体,加水溶解,滴加___________ (填写试剂名称),无明显现象,由此可知样品___________ (填“已”或“未”)变质。
(3)步骤Ⅰ中检验沉淀是否洗涤干净的操作是___________ 。
(4)步骤Ⅱ中“灼烧”发生的反应属于分解反应,其化学方程式为___________ 。
(5)该实验的总产率为___________ 。
(6)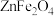 晶体的一种晶胞结构如图所示,晶胞可看成由A、B单元按C方式交替排布构成,“○”表示
晶体的一种晶胞结构如图所示,晶胞可看成由A、B单元按C方式交替排布构成,“○”表示 。则“●”表示的微粒是
。则“●”表示的微粒是___________ (填符号),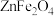 晶体的密度为
晶体的密度为___________  (已知晶胞参数为
(已知晶胞参数为 ,列出计算式)。
,列出计算式)。
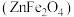 是一种性能优良的软磁材料,可作烯类有机化合物氧化脱氢的催化剂。实验室制备铁酸锌可采用如下步骤:
是一种性能优良的软磁材料,可作烯类有机化合物氧化脱氢的催化剂。实验室制备铁酸锌可采用如下步骤:Ⅰ.制备前驱物
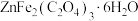
①分别配制
 溶液和
溶液和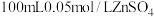 溶液,并将二者混合备用。
溶液,并将二者混合备用。②另外称取
 溶于
溶于 蒸馏水中。
蒸馏水中。③将①和②所得溶液混合加热到
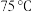 ,并在
,并在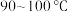 加热搅拌
加热搅拌 ;待溶液冷却后进行减压过滤、洗涤,干燥,得到前驱物。
;待溶液冷却后进行减压过滤、洗涤,干燥,得到前驱物。Ⅱ.制备铁酸锌
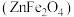
将步骤Ⅰ所得前驱物在
 灼烧
灼烧 ,冷却后称量质量为
,冷却后称量质量为 ,计算产率。
,计算产率。回答下列问题:
(1)步骤Ⅰ中配制
 溶液需要的玻璃仪器有烧杯、量筒、胶头滴管、
溶液需要的玻璃仪器有烧杯、量筒、胶头滴管、 容量瓶和
容量瓶和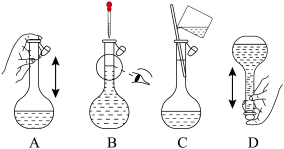
 晶体,加水溶解,滴加
晶体,加水溶解,滴加(3)步骤Ⅰ中检验沉淀是否洗涤干净的操作是
(4)步骤Ⅱ中“灼烧”发生的反应属于分解反应,其化学方程式为
(5)该实验的总产率为
(6)
 晶体的一种晶胞结构如图所示,晶胞可看成由A、B单元按C方式交替排布构成,“○”表示
晶体的一种晶胞结构如图所示,晶胞可看成由A、B单元按C方式交替排布构成,“○”表示 。则“●”表示的微粒是
。则“●”表示的微粒是 晶体的密度为
晶体的密度为 (已知晶胞参数为
(已知晶胞参数为 ,列出计算式)。
,列出计算式)。
您最近一年使用:0次
解题方法
9 . 热敏材料VO2可用于航天器的智能热辐射器,可用氧钒(Ⅳ)碱式碳酸铵[化学式为(NH4)5[(VO)6(CO3)4(OH)9]•10H2O]为原料制备。已知VO2+在酸性条件下易被氧化,氧钒(Ⅳ)碱式碳酸铵的制备流程如图:
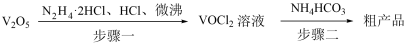
回答下列问题:
(1)步骤一盐酸不宜过量,原因可能______ ;生成VOCl2的同时,还生成一种无色无污染的气体,该反应的化学方程式为______ 。
(2)步骤二可在如图装置中进行。
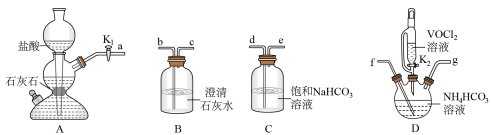
①仪器A的名称是_______ 。
②接口的连接顺序为a→_______ 。
③实验开始时,先关闭K2,打开K1,当_______ 时(写实验现象),再关闭K1,打开K2,充分反应,静置,得到固体。
(3)测定产品纯度
称取ag样品用稀硫酸溶解后,加入25.00mL0.02mol•L-1KMnO4溶液,VO2+化成VO ,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液20.00mL。
,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液20.00mL。
①取用KMnO4溶液不能使用_______ 式滴定管,滴定至反应终点的实验现象为_______ 。
②下列情况会导致产品纯度偏小的是_______ (填标号)。
A.用标准液润洗滴定管后,液体从上口倒出
B.滴定达终点时,发现滴定管尖嘴内有气泡生成
C.Na2SO3溶液部分变质
D.滴定达终点时,俯视刻度线读数
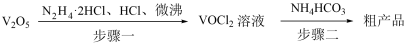
回答下列问题:
(1)步骤一盐酸不宜过量,原因可能
(2)步骤二可在如图装置中进行。

①仪器A的名称是
②接口的连接顺序为a→
③实验开始时,先关闭K2,打开K1,当
(3)测定产品纯度
称取ag样品用稀硫酸溶解后,加入25.00mL0.02mol•L-1KMnO4溶液,VO2+化成VO
 ,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液20.00mL。
,向反应后溶液中滴加0.025mol•L-1Na2SO3标准液,至剩余的KMnO4溶液恰好反应完全,消耗Na2SO3标准液20.00mL。①取用KMnO4溶液不能使用
②下列情况会导致产品纯度偏小的是
A.用标准液润洗滴定管后,液体从上口倒出
B.滴定达终点时,发现滴定管尖嘴内有气泡生成
C.Na2SO3溶液部分变质
D.滴定达终点时,俯视刻度线读数
您最近一年使用:0次
解题方法
10 . 下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 将金属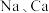 分别切成体积相等的颗粒,投入蒸馏水中,金属 分别切成体积相等的颗粒,投入蒸馏水中,金属 与水反应更加剧烈 与水反应更加剧烈 |  的金属性强于 的金属性强于 |
B | 向 溶液中滴加几滴 溶液中滴加几滴 溶液,振荡,无明显现象,再滴加几滴新制氯水,溶液变红 溶液,振荡,无明显现象,再滴加几滴新制氯水,溶液变红 | 一定是 将 将 氧化为 氧化为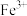 |
C | 向盛有淀粉溶液的试管中加入适量稀硫酸,水浴加热,冷却至室温后加入 溶液调至碱性,再加入新制氢氧化铜悬浊液,加热,试管中出现砖红色沉淀 溶液调至碱性,再加入新制氢氧化铜悬浊液,加热,试管中出现砖红色沉淀 | 淀粉一定发生了水解 |
D | 向久置的 样品中加入足量 样品中加入足量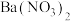 溶液,再加入足量稀盐酸,出现白色沉淀,且沉淀不溶解 溶液,再加入足量稀盐酸,出现白色沉淀,且沉淀不溶解 |  样品一定变质 样品一定变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



