1 . 图表、坐标系、转化图等都是化学学科学习中常用的表达形式和工具,是高中生必备的基本技能之一。请大家通过阅读和分析,发现图示背后的化学原理,完成下列各题,并体会和感悟自然科学的研究方法和价值。
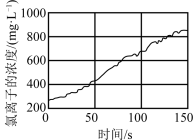
(1)某兴趣小组利用数字化实验测定光照过程中氯水中氯离子的浓度实验结果如图所示,请解释原因是___________ (用化学方程式表示)。 在空气中灼烧,测得灼烧过程中剩余固体的质量与起始
在空气中灼烧,测得灼烧过程中剩余固体的质量与起始 的质量的比值随温度变化的曲线如图所示。根据灼烧过程中铁元素守恒,可以通过计算确定800℃时,
的质量的比值随温度变化的曲线如图所示。根据灼烧过程中铁元素守恒,可以通过计算确定800℃时, 氧化成含有两种元素的固体产物为
氧化成含有两种元素的固体产物为___________ (化学式),请写出该反应的化学方程式___________ 。 可用于水体中
可用于水体中 的去除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得
的去除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得 浓度随反应时间的变化如图所示。
浓度随反应时间的变化如图所示。 转化为
转化为 ,
, 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
②反应相同时间,水体中 浓度随pH增大而降低的原因是
浓度随pH增大而降低的原因是___________ 。
(4)某校科研人员利用NaOH溶液实现“碳捕获”的技术的装置如图所示,在整个“捕捉”过程中,将NaOH溶液喷成雾状是为了___________ ,如果想要实现NaOH溶液的循环利用,你采取的措施是___________ 。
(1)某兴趣小组利用数字化实验测定光照过程中氯水中氯离子的浓度实验结果如图所示,请解释原因是
 在空气中灼烧,测得灼烧过程中剩余固体的质量与起始
在空气中灼烧,测得灼烧过程中剩余固体的质量与起始 的质量的比值随温度变化的曲线如图所示。根据灼烧过程中铁元素守恒,可以通过计算确定800℃时,
的质量的比值随温度变化的曲线如图所示。根据灼烧过程中铁元素守恒,可以通过计算确定800℃时, 氧化成含有两种元素的固体产物为
氧化成含有两种元素的固体产物为
 可用于水体中
可用于水体中 的去除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得
的去除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得 浓度随反应时间的变化如图所示。
浓度随反应时间的变化如图所示。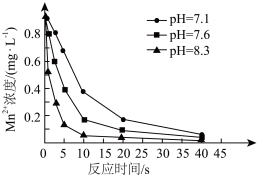
 转化为
转化为 ,
,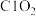 转化为
转化为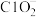 ,该反应的离子方程式为
,该反应的离子方程式为②反应相同时间,水体中
 浓度随pH增大而降低的原因是
浓度随pH增大而降低的原因是(4)某校科研人员利用NaOH溶液实现“碳捕获”的技术的装置如图所示,在整个“捕捉”过程中,将NaOH溶液喷成雾状是为了

您最近一年使用:0次
解题方法
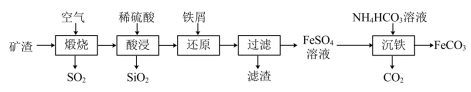
2 . 利用金属矿渣(含有FeS2、SiO2及Cu2O)制备FeCO3的实验流程如下。已知煅烧过程中FeS2和Cu2O转化为Fe2O3和CuO。 的反应外,还发生反应的
的反应外,还发生反应的离子方程式 有___________ 、___________ 。
(2)检验Fe3+是否完全被还原的实验操作是___________ 。
(3)FeSO4溶液浓度的测定。取制得的FeSO4溶液25.00mL,置于锥形瓶中,加入一定量的酸溶液,用0.1000mol/L的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液19.50mL。计算FeSO4溶液的物质的是浓度___________ 。(写出计算过程)
(4)制备 FeCO3.写出“沉铁”步骤发生反应的离子方程式 :___________ 。
 的反应外,还发生反应的
的反应外,还发生反应的(2)检验Fe3+是否完全被还原的实验操作是
(3)FeSO4溶液浓度的测定。取制得的FeSO4溶液25.00mL,置于锥形瓶中,加入一定量的酸溶液,用0.1000mol/L的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液19.50mL。计算FeSO4溶液的物质的是浓度
(4)制备 FeCO3.写出“沉铁”步骤发生反应的
您最近一年使用:0次
3 . 工业上用白磷(P4)与Ba(OH)2反应生成PH3和一种盐,该盐可与H2SO4反应制备一元弱酸H3PO2。下列化学反应表示不正确 的是
A.NO2制HNO3的离子方程式: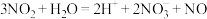 |
B.白磷与 溶液反应: 溶液反应: |
C.H3PO2与足量的NaOH溶液反应的离子方程式:H3PO2+3OH-=PO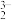 +3H2O +3H2O |
D.过量铁粉与稀硝酸反应离子方程式:3Fe+8H++2NO =3Fe2++2NO↑ + 4H2O =3Fe2++2NO↑ + 4H2O |
您最近一年使用:0次
解题方法
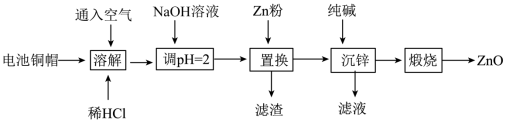
4 . 实验室利用废弃旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的实验流程如下:___________ 。
(2)“溶解”可适当升高温度以加快反应速率,但温度不宜过高。温度不宜过高的原因是___________ 。
(3)用NaOH溶液调节pH=2的目的是___________ 。
(4)滤渣中的主要物质是___________ (填化学式)。
(5)“沉锌”时生成碱式碳酸锌[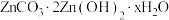 ],碱式碳酸锌在空气中加热可转化为ZnO,过程中固体质量随温度的变化关系如下图所示。已知:
],碱式碳酸锌在空气中加热可转化为ZnO,过程中固体质量随温度的变化关系如下图所示。已知: 加热至125℃、
加热至125℃、 加热至350℃均分解成ZnO,该碱式碳酸锌失去结晶水的温度与
加热至350℃均分解成ZnO,该碱式碳酸锌失去结晶水的温度与 的分解温度接近。
的分解温度接近。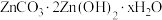 中x的值为
中x的值为___________ (写出计算过程)。
(2)“溶解”可适当升高温度以加快反应速率,但温度不宜过高。温度不宜过高的原因是
(3)用NaOH溶液调节pH=2的目的是
(4)滤渣中的主要物质是
(5)“沉锌”时生成碱式碳酸锌[
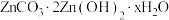 ],碱式碳酸锌在空气中加热可转化为ZnO,过程中固体质量随温度的变化关系如下图所示。已知:
],碱式碳酸锌在空气中加热可转化为ZnO,过程中固体质量随温度的变化关系如下图所示。已知: 加热至125℃、
加热至125℃、 加热至350℃均分解成ZnO,该碱式碳酸锌失去结晶水的温度与
加热至350℃均分解成ZnO,该碱式碳酸锌失去结晶水的温度与 的分解温度接近。
的分解温度接近。
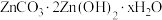 中x的值为
中x的值为
您最近一年使用:0次
名校
5 . 下列物质性质实验对应的反应方程式书写正确的是
| A.Cl2溶于水:Cl2+H2O=2H++Cl-+ClO- |
| B.铜丝插入浓硫酸中:Cu+H2SO4(浓)=CuSO4+H2↑ |
C.KAl(SO4)2溶液与过量氨水反应:Al3++3NH3·H2O=Al(OH)3↓+3NH |
D.NaHSO4溶液中滴加Ba(OH)2溶液至中性:Ba2++SO +H++OH-=BaSO4↓+H2O +H++OH-=BaSO4↓+H2O |
您最近一年使用:0次
名校
6 . 某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)甲组同学取2mLFeSO4溶液,加入1滴KSCN溶液,再加入几滴氯水,溶液变红,说明Cl2可将Fe2+氧化。FeSO4溶液与氯水反应的离子方程式为___________ 。
(2)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeSO4溶液中先加入0.5mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是___________ 。
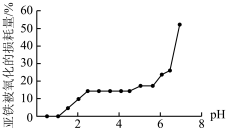
(3)丙组同学研究pH对FeSO4稳定性的影响,得到如图所示结果,增强Fe2+稳定性的措施为___________ 。(写出一条即可)
(4)丁组同学为了探究Fe2(SO4)3与Cu的反应,做了如图所示实验:

①Fe3+与Cu反应的离子方程式为___________ 。
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN-的化学性质与I-相似;
iii.2Cu2++4I-=2CuI↓+I2。
填写实验方案:
Cu2+与SCN-反应的离子方程式为___________ 。
(1)甲组同学取2mLFeSO4溶液,加入1滴KSCN溶液,再加入几滴氯水,溶液变红,说明Cl2可将Fe2+氧化。FeSO4溶液与氯水反应的离子方程式为
(2)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeSO4溶液中先加入0.5mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是
(3)丙组同学研究pH对FeSO4稳定性的影响,得到如图所示结果,增强Fe2+稳定性的措施为

(4)丁组同学为了探究Fe2(SO4)3与Cu的反应,做了如图所示实验:

①Fe3+与Cu反应的离子方程式为
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN-的化学性质与I-相似;
iii.2Cu2++4I-=2CuI↓+I2。
填写实验方案:
| 实验方案 | 现象 |
| 步骤1:取4mL0.2mol/L的FeSO4溶液,向其中滴加3滴0.1mol/L的KSCN溶液。 | 无明显现象 |
| 步骤2:取4mL | 产生白色沉淀 |
您最近一年使用:0次
名校
解题方法
7 . 工业上将电石渣浆中的S2-转化为SO ,工艺流程如图。
,工艺流程如图。

下列说法正确的是
 ,工艺流程如图。
,工艺流程如图。
下列说法正确的是
| A.过程Ⅰ中,Mn(OH)2被还原 |
| B.该流程中发生的反应均为氧化还原反应 |
C.过程Ⅱ中发生的反应为2S2-+4MnO +9H2O=S2O +9H2O=S2O +4Mn(OH)2+10OH- +4Mn(OH)2+10OH- |
D.将10L480mg/LS2-转化为SO ,理论上需要O26.67L ,理论上需要O26.67L |
您最近一年使用:0次
8 . 回答下列问题
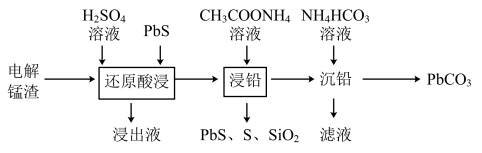
(1)电解锰渣主要含MnSO4、MnO2、PbSO4、CaSO4及少量的SiO2、Fe2(SO4)3。利用电解锰渣回收铅的工艺如下图所示:
已知: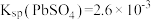 ,
,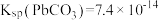 ,
,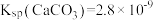 ,回答下列问题:
,回答下列问题:
①“还原酸浸”时,MnO2氧化PbS生成S的离子方程式为_____________ 。
②“浸出液”含有的盐类主要有MnSO4和少量的CaSO4、______ (填物质的化学式)。
③从平衡移动的角度看“浸铅”反应中PbSO4转化为______ (填物质的化学式)。若“浸铅”后所得溶液中c(Pb2+)=c(Ca2+)=0.1 mol/L,为实现铅与钙的分离,应控制溶液中c( )的范围是
)的范围是______ 。(当溶液中金属离子浓度小于10-5 mol/L,可以认为该离子沉淀完全。)
④“沉铅”时滤液主要的主要成分除CH3COONH4外,还有______ (填物质的化学式)。
(2)利用 PbSO4可制备PbCrO4:以PbSO4、Na2Cr2O7和NaOH为原料,通过混合后进行沉淀转化可制得PbCrO4。
已知:PbCrO4的产率(η)随pH的变化如图所示。
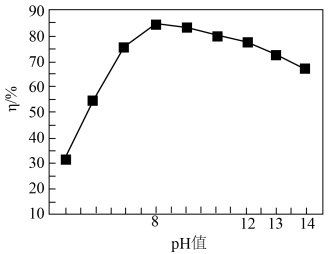
①加入NaOH的作用为______ .
②pH>8时,PbCrO4产率下降的原因为______ .
(3)25℃时,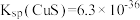 ,H2S的Ka1=1.1×10-7,Ka2=1.3×10-13。
,H2S的Ka1=1.1×10-7,Ka2=1.3×10-13。
反应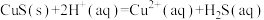 的平衡常数K=
的平衡常数K=______ (用Ksp、Ka1、Ka2表示),经计算可判断CuS难溶于稀硫酸。
(1)电解锰渣主要含MnSO4、MnO2、PbSO4、CaSO4及少量的SiO2、Fe2(SO4)3。利用电解锰渣回收铅的工艺如下图所示:

已知:
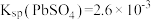 ,
,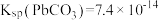 ,
,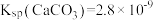 ,回答下列问题:
,回答下列问题:①“还原酸浸”时,MnO2氧化PbS生成S的离子方程式为
②“浸出液”含有的盐类主要有MnSO4和少量的CaSO4、
③从平衡移动的角度看“浸铅”反应中PbSO4转化为
 )的范围是
)的范围是④“沉铅”时滤液主要的主要成分除CH3COONH4外,还有
(2)利用 PbSO4可制备PbCrO4:以PbSO4、Na2Cr2O7和NaOH为原料,通过混合后进行沉淀转化可制得PbCrO4。
已知:PbCrO4的产率(η)随pH的变化如图所示。

①加入NaOH的作用为
②pH>8时,PbCrO4产率下降的原因为
(3)25℃时,
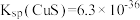 ,H2S的Ka1=1.1×10-7,Ka2=1.3×10-13。
,H2S的Ka1=1.1×10-7,Ka2=1.3×10-13。反应
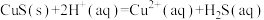 的平衡常数K=
的平衡常数K=
您最近一年使用:0次
名校
9 . 氨气的燃烧热316.25kJ·mol-1.肼(N2H4)为无色油状液体,有类似于氨的刺鼻气味,是一种强极性化合物。下列说法正确的是
| A.氨气燃烧的热化学方程式:4NH3(g)+3O2(g)=6H2O(g)+2N2(g) ΔH=-1265kJ·mol-1 |
B.HNO2与KMnO4酸性溶液反应:5 +2 +2 +6H+=5 +6H+=5 +2Mn2++3H2O +2Mn2++3H2O |
| C.肼(N2H4)—空气碱性燃料电池的负极反应:N2H4+4e-=4H++N2↑ |
| D.氢氧化铜溶于氨水的化学方程式:Cu(OH)2+4NH3=[Cu(NH3)4](OH)2 |
您最近一年使用:0次
名校
解题方法
10 . 下列指定反应的离子方程式不正确的是
A.氯碱工业: |
| B.用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |
C.向 溶液中加入过量NaOH溶液: 溶液中加入过量NaOH溶液: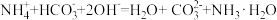 |
D.用氨水吸收少量 : : |
您最近一年使用:0次



