1 . 氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂。一种由海绵铜(Cu和少量CuO等)为原料制备CuCl的工艺流程如下:
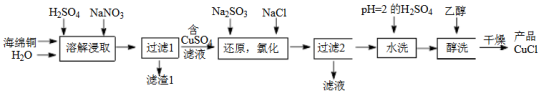
(1)“溶解浸取”时,需将海绵铜粉碎成细颗粒,其目的是___________ 。
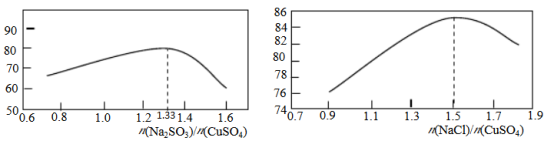
(2)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图所示:
①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为___________ 。
②当n(Na2SO3)/n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是___________ 。
③当1.0<n(NaCl)/n(CuSO4)<1.5时,比值越大CuCl产率越大,其原因是___________ 。
(3)“粗产品”用pH=2的H2SO4水洗,若不慎用稀硝酸进行稀释,则对产品有何影响___________ 。
(4)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为______________________ 。
(5)某同学拟测定产品中氯化亚铜的质量分数。实验过程如下:准确称取制备的氯化亚铜产品1.600g,将其置于足量的FeCl3溶液中,待样品全部溶解后,加入适量稀硫酸,用0.2000mol·L-1的KMnO4标准溶液滴定到终点,消耗KMnO4溶液15.00mL,反应中MnO4-被还原为Mn2+,则产品中氯化亚铜的质量分数为______________________ 。

(1)“溶解浸取”时,需将海绵铜粉碎成细颗粒,其目的是

(2)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图所示:
①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为
②当n(Na2SO3)/n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是
③当1.0<n(NaCl)/n(CuSO4)<1.5时,比值越大CuCl产率越大,其原因是
(3)“粗产品”用pH=2的H2SO4水洗,若不慎用稀硝酸进行稀释,则对产品有何影响
(4)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为
(5)某同学拟测定产品中氯化亚铜的质量分数。实验过程如下:准确称取制备的氯化亚铜产品1.600g,将其置于足量的FeCl3溶液中,待样品全部溶解后,加入适量稀硫酸,用0.2000mol·L-1的KMnO4标准溶液滴定到终点,消耗KMnO4溶液15.00mL,反应中MnO4-被还原为Mn2+,则产品中氯化亚铜的质量分数为
您最近一年使用:0次
名校
解题方法
2 . 聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,将所得溶液平均分为两份。向一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.747 5 g。取另一份溶液,先将Fe3+还原为Fe2+(还原剂不是Fe,且加入的还原剂恰好将Fe3+还原为Fe2+),再用0.020 00 mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液50.00 mL。该聚合硫酸铁样品中a∶b为[已知:K2Cr2O7+6FeSO4+7H2SO4=K2SO4+Cr2(SO4)3+3Fe2(SO4)3+7H2O]( )
| A.1∶1 | B.2∶1 | C.3∶1 | D.2∶5 |
您最近一年使用:0次
2018-12-15更新
|
1547次组卷
|
7卷引用:辽宁省铁岭市六校2020-2021学年高二下学期期末联考化学试题
辽宁省铁岭市六校2020-2021学年高二下学期期末联考化学试题2016-2017学年江苏省徐州一中高一上期中化学卷(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第3讲 氧化还原反应 (题型专练)(已下线)2019年1月2日 《每日一题》高考二轮复习-以物质的量为核心的计算【全国百强校】内蒙古鄂尔多斯市第一中学2018-2019学年高二下学期第三次月考化学试题辽宁省沈阳市东北育才学校2020届高三上学期第一次模拟考试化学试题苏教2020版化学必修第二册专题9第三单元 金属材料的性能及应用课后习题
名校
3 . 铝与NO3-在酸性或碱性条件下均可反应,回答下列问题:
(1)为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,完善并配平该反应:__ Al +___NO3- + ___OH- = ___ _________+ ____N2↑ + ____H2O。每消耗1mol NO3-,转移的电子数目为_____ 。
(2)某同学取一定质量的铁铝合金与100mLxmol/L稀硝酸充分反应,反应过程中没有气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)的关系如图所示。
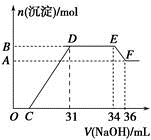
①写出EF段发生反应的离子方程式_________________________________________ 。
② C点对应的溶液中含有的阳离子除Na+外,还含有___________________________ 。
③ x=_________ 。
④铁铝合金中铝的物质的量分数为______________________ 。
(1)为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,完善并配平该反应:
(2)某同学取一定质量的铁铝合金与100mLxmol/L稀硝酸充分反应,反应过程中没有气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)的关系如图所示。

①写出EF段发生反应的离子方程式
② C点对应的溶液中含有的阳离子除Na+外,还含有
③ x=
④铁铝合金中铝的物质的量分数为
您最近一年使用:0次
2018-02-06更新
|
1136次组卷
|
2卷引用:重庆一中2017-2018学年高一上学期期末化学试题
名校
4 . A2、B2、C23种单质和它们离子间能发生下列反应2A- + C2 = 2C- + A2、2C- + B2 = 2B- + C2。若X-能与C2发生反应2X- + C2 = 2C- + X2有关说法中不正确的是( )
| A.氧化性B2>C2>A2 | B.还原性X->C->B- |
| C.X2与B-能发生反应 | D.B2与X-能发生反应 |
您最近一年使用:0次
2017-11-16更新
|
146次组卷
|
4卷引用:河南省许昌市长葛市第一高级中学2019-2020学年高一下学期期末考试化学试题
名校
5 . NH3和NO2在催化剂作用下反应:8NH3+6NO2=7N2+12H2O。若还原产物比氧化产物少0.1 mol,则下列判断正确的是( )
| A.转移电子3.6NA | B.生成气体的体积32.56 L(标准状况) |
| C.还原剂比氧化剂多0.2 mol | D.被还原的氮原子是11.2 g |
您最近一年使用:0次
2017-10-17更新
|
1385次组卷
|
7卷引用:辽宁省朝阳市第一高级中学2020-2021学年高一上学期期末考试化学试题
名校
6 . 5.76 g部分氧化的Fe、Cu合金样品(氧化产物为Fe2O3、CuO),经如下处理,下列说法正确的是
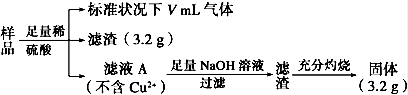

| A.V=224 |
| B.样品中Fe的质量为2.14 g |
| C.未氧化前Fe元素的质量分数约为41.2% |
| D.样品中CuO的质量为3.52 g |
您最近一年使用:0次
名校
7 . 黑火药是我国的四大发明之一,深受世人称赞,其反应原理为:S+3C+2KNO3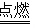 N2↑+3CO2↑+K2S请回答下列相关问题:
N2↑+3CO2↑+K2S请回答下列相关问题:
(1)当产生0.1molN2时,反应中共转移电子数为___________ ,还原剂的物质的量为___________ mol.
(2)若生成标准状况下33.6LCO2,则被S氧化的C的物质的量是___________ mol.
 N2↑+3CO2↑+K2S请回答下列相关问题:
N2↑+3CO2↑+K2S请回答下列相关问题:(1)当产生0.1molN2时,反应中共转移电子数为
(2)若生成标准状况下33.6LCO2,则被S氧化的C的物质的量是
您最近一年使用:0次
2017-02-28更新
|
937次组卷
|
2卷引用:2016-2017学年安徽省宿州市高一上学期期末教学质量检测(a卷)化学试卷
名校
8 . A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为__________________ 。写出E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式____________________________________ 。
(2)由A、B、W三种元素组成的18电子微粒的分子式为____________________ 。
(3)经测定A2W2为二元弱酸,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式_________________________________________ 。
(4)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I-时,共转移3mol电子,该反应的离子方程式是___________________________________ 。
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是_________ L(标准状况下)。
(1)E元素在周期表中的位置为
(2)由A、B、W三种元素组成的18电子微粒的分子式为
(3)经测定A2W2为二元弱酸,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式
(4)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I-时,共转移3mol电子,该反应的离子方程式是
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是
您最近一年使用:0次
2016-12-09更新
|
1339次组卷
|
4卷引用:2016届山东省泰安市高三上学期期末考试化学试卷
解题方法
9 . 含氮的化合物在化学反应中变化复杂。I.现用下图所示仪器(夹持装置已省略及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。已知:①NO+NO2+2OH-=2NO2-+H2O;②气体液化的温度:NO2 21℃、NO -152℃。
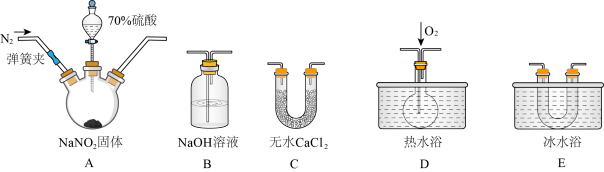
(1)为了检验装置A中生成的气体产物,上述仪器的连接顺序(按左→右连接)为__________ 。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是:____________ 。
(3)在关闭弹簧夹,滴入70%硫酸后,A中产生红棕色气体。
①盛装70%浓硫酸的仪器名称是___________ ;
②实验确认有NO的现象是______________________ 。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是______________ 。
Ⅱ.NH3经一系列反应可以得到HNO3和NH4NO3,如图1所示。


图1 图2
【资料卡片】
a.NH4NO3是一种白色晶体,易溶于水,微溶于乙醇.
b.在230℃ 以上时,同时有弱光:2NH4NO3=2N2↑+ O2↑+ 4H2O
c.在400℃以上时,剧烈分解发生爆炸:4NH4NO3=3N2↑+ 2NO2↑+ 8H2O
(5)如图2 将水滴入盛有硝酸铵的试管中,观察到的A处液面上升,B处液面下降,产生该现象的原因_______________ 。
(6)实验室可以用氯化铵和熟石灰反应来制备氨气,该反应的化学方程式是____________ (填“能”或“不能”)_____ 用硝酸铵代替氯化铵。
(7)在汽车发生碰撞时,NaN3会产生________ (填化学式)气体充满安全气囊来减轻碰撞事故中乘员伤害程度。
(8)完成离子反应IV:______ NO+ _______ H2O=______ +______ +____ H+。

(1)为了检验装置A中生成的气体产物,上述仪器的连接顺序(按左→右连接)为
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是:
(3)在关闭弹簧夹,滴入70%硫酸后,A中产生红棕色气体。
①盛装70%浓硫酸的仪器名称是
②实验确认有NO的现象是
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是
Ⅱ.NH3经一系列反应可以得到HNO3和NH4NO3,如图1所示。


图1 图2
【资料卡片】
a.NH4NO3是一种白色晶体,易溶于水,微溶于乙醇.
b.在230℃ 以上时,同时有弱光:2NH4NO3=2N2↑+ O2↑+ 4H2O
c.在400℃以上时,剧烈分解发生爆炸:4NH4NO3=3N2↑+ 2NO2↑+ 8H2O
(5)如图2 将水滴入盛有硝酸铵的试管中,观察到的A处液面上升,B处液面下降,产生该现象的原因
(6)实验室可以用氯化铵和熟石灰反应来制备氨气,该反应的化学方程式是
(7)在汽车发生碰撞时,NaN3会产生
(8)完成离子反应IV:
您最近一年使用:0次
2016-12-09更新
|
749次组卷
|
2卷引用:河南省中原名校(即豫南九校)2017-2018学年高一上学期期末联考化学试题
解题方法
10 . 海带中含有丰富的碘,,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
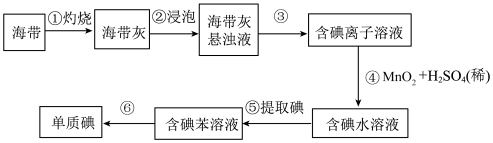
请填写下列空白:
(1)步骤①所需要的硅酸盐仪器是___________ ,步骤③的实验操作是___________ 。
(2)步骤⑤中,某学生选择用苯来提取碘水中的单质碘的理由是_____ 。(选填序号)
a.单质碘与苯不发生化学反应 b.碘在苯中溶解度小
c.碘在苯中溶解度大 d.苯与水互不相溶
(3)提取碘的过程中,不能使用的有机溶剂是_________ 。(选填序号)
a.酒精 b.汽油 c.四氯化碳
(4)步骤④中所发生的离子反应方程式______________ 。
(5)已知:2Fe3++2I-→2Fe2++I2氯气既可以氧化Fe2+,也可以氧化I-。 往FeI2溶液中通入一定量的 Cl2,反应完成后,溶液中有1/2Fe2+被氧化,请写出该反应的化学反应方程式:____________ 。

请填写下列空白:
(1)步骤①所需要的硅酸盐仪器是
(2)步骤⑤中,某学生选择用苯来提取碘水中的单质碘的理由是
a.单质碘与苯不发生化学反应 b.碘在苯中溶解度小
c.碘在苯中溶解度大 d.苯与水互不相溶
(3)提取碘的过程中,不能使用的有机溶剂是
a.酒精 b.汽油 c.四氯化碳
(4)步骤④中所发生的离子反应方程式
(5)已知:2Fe3++2I-→2Fe2++I2氯气既可以氧化Fe2+,也可以氧化I-。 往FeI2溶液中通入一定量的 Cl2,反应完成后,溶液中有1/2Fe2+被氧化,请写出该反应的化学反应方程式:
您最近一年使用:0次



