名校
解题方法
1 . 有关 反应的叙述正确的为
反应的叙述正确的为
 反应的叙述正确的为
反应的叙述正确的为| A.还原剂与氧化剂物质的量之比为5:3 |
| B.生成lmolO2,反应共转移4mol电子 |
C.若有5mol水做还原剂时,被BrF3还原的BrF3为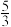 mol mol |
| D.若有5mol水参与反应时,被水还原的BrF3为2mol |
您最近一年使用:0次
2019-11-24更新
|
2666次组卷
|
7卷引用:重庆市育才中学2019-2020学年高一上学期期中考试化学试题
解题方法
2 . 无机化合物X与Y均由三种相同短周期的非金属元素组成(X比Y的相对分子质量大),常温下均为无色液体,易水解,均产生酸性白雾。取1.35gX与足量水完全反应,向反应后的溶液中滴加1.00 mol·L-1的NaOH溶液40.0mL恰好反应,溶液呈中性,继续滴加BaCl2溶液至过量,产生不溶于稀盐酸的2.33g白色沉淀。Y水解得到两种产物,其物质的量之比1:2,且产物之一能使品红溶液褪色。请回答:
(1)X的化学式______________ 。白色沉淀属于_____________ (填“强”、“弱”或“非”)电解质。
(2)Y与水反应的化学方程式_________________ 。
(3)二元化合物Z能与X化合生成Y。一定条件下,0.030 mol Z与足量氨反应生成0.92gA(原子个数之比1:1,其相对分子量为184)和淡黄色单质B及离子化合物M,且M的水溶液的pH<7。将0.92gA隔绝空气加强热可得到0.64gB和气体单质C。
①写出Z与足量氨反应的化学方程式____________ 。
②亚硝酸钠和M固体在加热条件下_____________ (填“可能”或“不能”)发生反应,判断理由是_________________ 。
③请设计检验离子化合物M中阳离子的实验方案:_________________ 。
(1)X的化学式
(2)Y与水反应的化学方程式
(3)二元化合物Z能与X化合生成Y。一定条件下,0.030 mol Z与足量氨反应生成0.92gA(原子个数之比1:1,其相对分子量为184)和淡黄色单质B及离子化合物M,且M的水溶液的pH<7。将0.92gA隔绝空气加强热可得到0.64gB和气体单质C。
①写出Z与足量氨反应的化学方程式
②亚硝酸钠和M固体在加热条件下
③请设计检验离子化合物M中阳离子的实验方案:
您最近一年使用:0次
名校
3 . 高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:
(1) KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列_____ 物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.“84”消毒液(NaClO溶液)
(2)操作Ⅰ的名称是________ ;操作Ⅱ是根据KMnO4和K2CO3两物质在__________ (填性质)上差异,采用 __________ (填操作步骤)、趁热过滤得到KMnO4粗晶体的。
(3)上述流程中可以循环使用的物质有石灰、CO2、____ 和____ (写化学式)。
(4) 向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是_______ 。
(5) 铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋元素的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式:__________________ 。
(6) 写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:________________ 。
(7)若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得_____ mol KMnO4。

(1) KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列
A.75%酒精 B.双氧水 C.苯酚 D.“84”消毒液(NaClO溶液)
(2)操作Ⅰ的名称是
(3)上述流程中可以循环使用的物质有石灰、CO2、
(4) 向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是
(5) 铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋元素的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式:
(6) 写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
(7)若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得
您最近一年使用:0次
2019-09-24更新
|
1215次组卷
|
3卷引用:湖北省宜昌市部分示范高中教学协作体2020届高三9月联考化学试题
4 . 含有a mol FeI2的溶液中,通入x mol Cl2。下列各项为通入Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
| A.x≤a,2I−+Cl2=I2+2Cl− |
| B.x=1.2a,10Fe2++14I−+12Cl2=10Fe3++7I2+24Cl− |
| C.x=1.4a,4Fe2++10I−+7Cl2=4Fe3++5I2+14Cl− |
| D.x≥1.5a,2Fe2++4I−+3Cl2=2Fe3++2I2+6Cl− |
您最近一年使用:0次
2019-07-07更新
|
1335次组卷
|
3卷引用:辽宁省凤城市第一中学2018-2019学年高二6月月考化学试题
名校
5 . 汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断不正确的是
| A.生成44.8L N2(标准状况) |
| B.有0.25 mol KNO3被还原 |
| C.转移电子的物质的量为1.75mol |
| D.被氧化的N原子的物质的量为3.75mol |
您最近一年使用:0次
2019-07-05更新
|
9182次组卷
|
8卷引用:湖南省湘东六校2018-2019学年高二下学期期末联考化学试题
名校
6 . 碱性锌锰电池的工作原理:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnxZn(1−x)Fe2O4,其工艺流程如图所示:
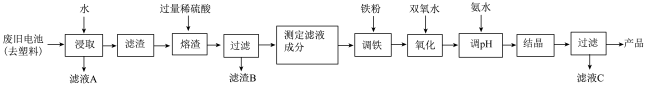
(1)已知MnxZn(1−x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中的锰相同,则铁元素的化合价为___________ 。
(2)滤液A中溶质的电子式为___________ 。
(3)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:___________________________________ 。
(4)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1−x)Fe2O4相符合。
①写出“调铁”工序中发生反应的离子方程式:__________________ 、_______________ 。
②若测得滤液的成分为c(Mn2+)+c(Zn2+)=a mol·L−1,c(Fe2+)+c(Fe3+)=b mol·L−1,滤液体积为1m3,“调铁”工序中,需加入的铁粉质量为___________ kg(忽略溶液体积变化,用含a、b的代数式表示)。
(5)在“氧化”工序中,加入双氧水的目的是_________________ ,生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是______________________ 。
(6)用氨水“调pH”后,经“结晶”、“过滤”可得到产品和滤液C(C为正盐),从滤液C中还可分离出一种氮肥,该氮肥的溶液中离子浓度由大到小的排序为_____________ 。

(1)已知MnxZn(1−x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中的锰相同,则铁元素的化合价为
(2)滤液A中溶质的电子式为
(3)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:
(4)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1−x)Fe2O4相符合。
①写出“调铁”工序中发生反应的离子方程式:
②若测得滤液的成分为c(Mn2+)+c(Zn2+)=a mol·L−1,c(Fe2+)+c(Fe3+)=b mol·L−1,滤液体积为1m3,“调铁”工序中,需加入的铁粉质量为
(5)在“氧化”工序中,加入双氧水的目的是
(6)用氨水“调pH”后,经“结晶”、“过滤”可得到产品和滤液C(C为正盐),从滤液C中还可分离出一种氮肥,该氮肥的溶液中离子浓度由大到小的排序为
您最近一年使用:0次
2019-07-04更新
|
255次组卷
|
2卷引用:辽宁省大连市第四十八中学2019届高三高考考前模拟理综化学试题
真题
名校
7 . 聚合硫酸铁[Fe(OH)SO4]n能用作净水剂(絮凝剂),可由绿矾(FeSO4·7H2O)和KClO3在水溶液中反应得到。下列说法不正确 的是
| A.KClO3作氧化剂,每生成1 mol [Fe(OH)SO4]n消耗6/n mol KClO3 |
| B.生成聚合硫酸铁后,水溶液的pH增大 |
| C.聚合硫酸铁可在水中形成氢氧化铁胶体而净水 |
| D.在相同条件下,Fe3+比[Fe(OH)]2+的水解能力更强 |
您最近一年使用:0次
2019-04-12更新
|
5924次组卷
|
36卷引用:2019年4月浙江省普通高校招生选考科目考试化学试题
2019年4月浙江省普通高校招生选考科目考试化学试题福建省华安一中2018-2019学年高二下学期期末考试化学试题湖南省长沙市第一中学2020届高三第一次月考化学试题江西省宜春市奉新县第一中学2020届高三上学期第二次月考化学试题黑龙江省牡丹江市第一高级中学2020届高三10月月考化学试题河北省邯郸市2019-2020学年高三上学期期中考试化学试题2020届高考化学小题狂练(全国通用版)专练5 氧化还原反应辽宁省抚顺市第一中学2020届高三上学期期中考试化学试题江西省吉安市五校2019-2020学年高二上学期第二次联考化学试题2020届高三化学化学二轮复习——高考常考题:氧化还原反应的实际应用【精编选择25题】专题1.3 氧化还原反应(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题六 元素化合物的性质、应用及转化(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训(已下线)小题必刷08 氧化还原反应的规律及应用——2021年高考化学一轮复习小题必刷(通用版)广东省佛山市第一中学2020-2021学年高二上学期期中考试化学(选考)试题安徽省池州市第一中学2020-2021学年高二12月月考化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练上海交通大学附属中学2021届高三下学期3月月考化学试题(已下线)课时17 铁及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)3.3.1 盐类的水解-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)专题05.元素及其化合物-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)考向26 盐类的水解-备战2022年高考化学一轮复习考点微专题(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)湖南省长沙市雅礼中学2022-2023学年高三上学期第五次月考化学试题第三章 金属及其化合物 第13讲 铁及其重要化合物湖南省株洲市第四中学2023届高三第六次月考化学试题(已下线)题型27 铁及其化合物的性质、用途及相关计算重庆市万州第二高级中学2022-2023学年高三下学期5月月考化学试题新疆喀什地区伽师县2022-2023学年高三上学期11月期中考试化学试题(已下线)2019年高考浙江卷化学试题变式题(单选题21-25)北京市第八十中学2024届高三上学期10月月考化学试题化学江苏省扬州市宝应区2023-2024学年曹甸高级中学高三上学期9月化学试卷
8 . 二氧化氯(ClO2)和臭氧(O3)均具有强氧化性,可用于水处理。ClO2是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸;O3是一种微溶于水的蓝色气体,其体积分数超过25%时容易引起爆炸。
(1)以FeS2作还原剂,在硫酸介质中还原NaClO3制备ClO2,同时得到Fe2(SO4)3、Na2SO4,该反应的化学方程式为___________________________________________________ 。
(2)以过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2处理含CN-废水。实验室模拟该过程的实验装置(夹持装置略)如图1所示。
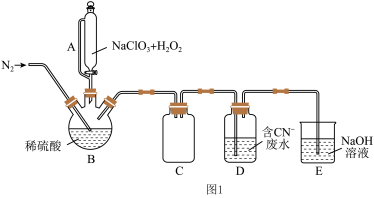
①反应容器B应置于30 ℃左右的水浴中,目的是__________________________________ 。
②通入氮气的目的除了有利于将ClO2排出,还有_________________________________ 。
③ClO2处理含CN-废水的离子方程式为_______________________________________ 。
④装置D的作用是________________________________ 。
(3)某科研机构经多次实验,利用O3、KCl和工业废渣(主要成分为NaNO3和NaNO2)制得KNO3,相关工艺参数如图2和图3[浓缩蒸发水量=m(反应液蒸发的水量)/m(反应液的总质量)]。
请选择最佳实验方案,参与完成他们的制备:将100 g废渣加入80 mL热水中,充分搅拌,__________________________________________ ,在50 ℃恒温水浴锅中充分反应后,过滤,__________________________ ,趁热过滤,________________________ , 过滤得KNO3粗品,再重结晶提纯得到KNO3。(需使用的试剂及用量:60 L 0.008 g/L O3和80 g KCl固体)

(1)以FeS2作还原剂,在硫酸介质中还原NaClO3制备ClO2,同时得到Fe2(SO4)3、Na2SO4,该反应的化学方程式为
(2)以过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2处理含CN-废水。实验室模拟该过程的实验装置(夹持装置略)如图1所示。

①反应容器B应置于30 ℃左右的水浴中,目的是
②通入氮气的目的除了有利于将ClO2排出,还有
③ClO2处理含CN-废水的离子方程式为
④装置D的作用是
(3)某科研机构经多次实验,利用O3、KCl和工业废渣(主要成分为NaNO3和NaNO2)制得KNO3,相关工艺参数如图2和图3[浓缩蒸发水量=m(反应液蒸发的水量)/m(反应液的总质量)]。
请选择最佳实验方案,参与完成他们的制备:将100 g废渣加入80 mL热水中,充分搅拌,

您最近一年使用:0次
2019-02-20更新
|
959次组卷
|
3卷引用:【市级联考】江苏省泰州市2019届高三上学期期末考试化学试题
【市级联考】江苏省泰州市2019届高三上学期期末考试化学试题(已下线)专题讲座(九) 热点实验综合探究 (精练)-2021年高考化学一轮复习讲练测江西省瑞金市第二中学2022-2023学年高三上学期开学考试化学试题
9 . 将甘油(C3H8O3)转化成高附加值产品是当前热点研究方向,甘油和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ: C3H8O3(l)+3H2O(g) 3CO2(g)+7H2(g) ΔH1
3CO2(g)+7H2(g) ΔH1
反应Ⅱ: 2C3H8O3(l)+3O2(g)⇌6CO2(g)+8H2(g) ΔH2=a kJ·mol-1
反应Ⅲ: 2H2(g)+O2(g)⇌2H2O(g) ΔH3=b kJ·mol-1
(1)ΔH1=__________ 。
(2)酸性条件下,甘油可在纳米TiO2Pt复合膜阳极上转化为甘油醛(C3H6O3),该电极方程式为________________________________ 。
(3)硝化甘油(C3H5O9N3)是治疗心绞痛的速效药,也可用作开采矿物的炸药。
①硝化甘油能治疗心绞痛的原理是在人体中释放NO,实验室中也可通过干法制备NO,方程式为3KNO2+KNO3+Cr2O3 2K2CrO4+4NO↑。若有1 mol NO生成,则被KNO3氧化的Cr2O3的物质的量为
2K2CrO4+4NO↑。若有1 mol NO生成,则被KNO3氧化的Cr2O3的物质的量为________ mol。
②硝化甘油爆炸时会彻底分解为N2、O2、CO2和H2O,反应的化学方程式为__________________________________________ 。
(4)①反应Ⅰ制备H2时的副产物很多,主要有CH4、C2H4等,生产过程中必须采取措施抑制副产物产生,目的是__________________________________________________________ 。
②为了有效提高反应Ⅰ氢气的产率,研究人员还采用CaO吸附增强制氢的方法。如图1所示,请分析加入CaO提高氢气产率的原因_________________________________________ 。
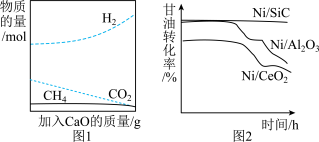
(5)高效的催化剂是这种制氢方法能大规模应用的重要因素。图2为三种不同催化剂在一段时间内与甘油转化率的关系,则Ni/SiC催化剂的优点是________________________________________________________________________ 。
反应Ⅰ: C3H8O3(l)+3H2O(g)
 3CO2(g)+7H2(g) ΔH1
3CO2(g)+7H2(g) ΔH1反应Ⅱ: 2C3H8O3(l)+3O2(g)⇌6CO2(g)+8H2(g) ΔH2=a kJ·mol-1
反应Ⅲ: 2H2(g)+O2(g)⇌2H2O(g) ΔH3=b kJ·mol-1
(1)ΔH1=
(2)酸性条件下,甘油可在纳米TiO2Pt复合膜阳极上转化为甘油醛(C3H6O3),该电极方程式为
(3)硝化甘油(C3H5O9N3)是治疗心绞痛的速效药,也可用作开采矿物的炸药。
①硝化甘油能治疗心绞痛的原理是在人体中释放NO,实验室中也可通过干法制备NO,方程式为3KNO2+KNO3+Cr2O3
 2K2CrO4+4NO↑。若有1 mol NO生成,则被KNO3氧化的Cr2O3的物质的量为
2K2CrO4+4NO↑。若有1 mol NO生成,则被KNO3氧化的Cr2O3的物质的量为②硝化甘油爆炸时会彻底分解为N2、O2、CO2和H2O,反应的化学方程式为
(4)①反应Ⅰ制备H2时的副产物很多,主要有CH4、C2H4等,生产过程中必须采取措施抑制副产物产生,目的是
②为了有效提高反应Ⅰ氢气的产率,研究人员还采用CaO吸附增强制氢的方法。如图1所示,请分析加入CaO提高氢气产率的原因

(5)高效的催化剂是这种制氢方法能大规模应用的重要因素。图2为三种不同催化剂在一段时间内与甘油转化率的关系,则Ni/SiC催化剂的优点是
您最近一年使用:0次
10 . I.在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入0.1 molCH3COONa固体,溶液中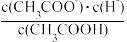
_______ (填“增大”、“减小”或“不变”);溶液中各微粒浓度由大到小的顺序为:_______
(2)常温下,向20 ml0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液40 mL,溶液中含碳元素的微粒(CO2)因逸出未画出)物质的量分数随溶液pH变化的情况如下:
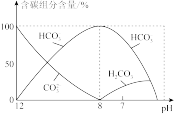
回答下列问题:
①所得溶液中含量最多的三种微粒的物质的量浓度的大小关系为_______
②已知在25℃时,CO 水解反应的平衡常数即水解常数Kh=2×10-4mol/L,当溶液中c(HCO
水解反应的平衡常数即水解常数Kh=2×10-4mol/L,当溶液中c(HCO ):c(CO
):c(CO )=2:1时,溶液的pH=
)=2:1时,溶液的pH=_______ 。
Ⅱ.金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性强,更易被人体吸收且在体内蓄积。工业上处理酸性含Cr2O 废水的方法如下:
废水的方法如下:
(1)向含Cr2O 的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式:
的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式:_______ 。
(2)调节溶液的pH,使Cr3+完全沉淀。25℃时,若调节溶液的pH=8,则溶液中残余Cr3+的物质的量浓度为_______ mol/L(已知25℃时,Ksp[Cr(OH) 3]=6.3×10-31)。
(3)铬元素总浓度的测定:准确移取25.00 mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O ,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015 mol/L的Na2 S2O3标准溶液,终点时消耗Na2S2O3溶液20.00 ml)。计算废水中铬元素总浓度
,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015 mol/L的Na2 S2O3标准溶液,终点时消耗Na2S2O3溶液20.00 ml)。计算废水中铬元素总浓度_______ (单位:mg/L,写出计算过程)。 已知测定过程中发生的反应如下:
①2Cr3++3S2O +7H2O= Cr2O
+7H2O= Cr2O +6SO
+6SO +14H+
+14H+
②Cr2O +6I-+14H+=2Cr3++3I2+7H2O
+6I-+14H+=2Cr3++3I2+7H2O
③I2+ S2O = 2I-+ S4O
= 2I-+ S4O
(1)一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入0.1 molCH3COONa固体,溶液中
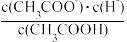
(2)常温下,向20 ml0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液40 mL,溶液中含碳元素的微粒(CO2)因逸出未画出)物质的量分数随溶液pH变化的情况如下:

回答下列问题:
①所得溶液中含量最多的三种微粒的物质的量浓度的大小关系为
②已知在25℃时,CO
 水解反应的平衡常数即水解常数Kh=2×10-4mol/L,当溶液中c(HCO
水解反应的平衡常数即水解常数Kh=2×10-4mol/L,当溶液中c(HCO ):c(CO
):c(CO )=2:1时,溶液的pH=
)=2:1时,溶液的pH=Ⅱ.金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性强,更易被人体吸收且在体内蓄积。工业上处理酸性含Cr2O
 废水的方法如下:
废水的方法如下:(1)向含Cr2O
 的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式:
的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式:(2)调节溶液的pH,使Cr3+完全沉淀。25℃时,若调节溶液的pH=8,则溶液中残余Cr3+的物质的量浓度为
(3)铬元素总浓度的测定:准确移取25.00 mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O
 ,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015 mol/L的Na2 S2O3标准溶液,终点时消耗Na2S2O3溶液20.00 ml)。计算废水中铬元素总浓度
,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015 mol/L的Na2 S2O3标准溶液,终点时消耗Na2S2O3溶液20.00 ml)。计算废水中铬元素总浓度①2Cr3++3S2O
 +7H2O= Cr2O
+7H2O= Cr2O +6SO
+6SO +14H+
+14H+②Cr2O
 +6I-+14H+=2Cr3++3I2+7H2O
+6I-+14H+=2Cr3++3I2+7H2O③I2+ S2O
 = 2I-+ S4O
= 2I-+ S4O
您最近一年使用:0次



