19-20高三·浙江·阶段练习
1 . I.为探究矿物样品M(仅含三种元素)的组成和性质,某实验小组设计并完成如下实验:

请回答下列问题:
(1)矿物样品M的化学式为_________________ 。
(2)在通入氧气条件下,矿物样品M也能与足量稀H2SO4反应得到暗绿色溶液,写出发生反应的离子方程式_____________________________ 。
(3)如何检验上述不含结晶水的盐中的阳离子?__________________________________ (写出实验操作、现象及结论)。
II.碱式碳酸镁可表示为xMg(OH)2·yMgCO3,某研究小组利用如下装置(装置图中部分夹持仪器已省略)测定其组成。
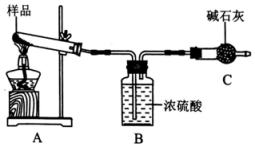
请回答:
(1)装置 C的仪器名称是______________ 。
(2)装置B中浓硫酸的作用是_____________________ 。
(3)利用此装置会使测定结果存在误差,为提高测定准确度,需对装置进行改进,其措施为__________________________________________________________________ (写两种)。

请回答下列问题:
(1)矿物样品M的化学式为
(2)在通入氧气条件下,矿物样品M也能与足量稀H2SO4反应得到暗绿色溶液,写出发生反应的离子方程式
(3)如何检验上述不含结晶水的盐中的阳离子?
II.碱式碳酸镁可表示为xMg(OH)2·yMgCO3,某研究小组利用如下装置(装置图中部分夹持仪器已省略)测定其组成。

请回答:
(1)装置 C的仪器名称是
(2)装置B中浓硫酸的作用是
(3)利用此装置会使测定结果存在误差,为提高测定准确度,需对装置进行改进,其措施为
您最近一年使用:0次
19-20高三·浙江·阶段练习
解题方法
2 . 一定量Fe和Fe2O3的混合物投入250mL 1mol/L HNO3溶液中,固体完全溶解后,生成0.56L(标准状况)NO(HNO3的还原产物假定仅此一种)。再向反应后的溶液中加1mol/L NaOH溶液,要使铁元素完全面淀下来,所加入的NaOH溶液的体积最少是
| A.225mL | B.250mL | C.200mL | D.无法确定 |
您最近一年使用:0次
名校
解题方法
3 . 已知还原性:SO >I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )
>I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )
 >I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )
>I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )A.当a=b时,发生的离子反应为SO +Cl2+H2O=SO +Cl2+H2O=SO +2H++2Cl- +2H++2Cl- |
B.当5a=4b时,发生的离子反应为4SO +2I-+5Cl2+4H2O=4SO +2I-+5Cl2+4H2O=4SO +I2+8H++10Cl- +I2+8H++10Cl- |
C.当a≤b≤ a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol |
D.当a<b< a时,溶液中SO a时,溶液中SO 、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b 、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b |
您最近一年使用:0次
2020-08-18更新
|
3396次组卷
|
7卷引用:浙江省瑞安市上海新纪元高级中学2019-2020学年高一下学期期末考试化学试题(2)
浙江省瑞安市上海新纪元高级中学2019-2020学年高一下学期期末考试化学试题(2)(已下线)解密04 离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密04 离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练黑龙江省哈尔滨师范大学附属中学2020-2021学年高二下学期期末考试化学试题(已下线)课时06 与量有关的离子方程式书写-2022年高考化学一轮复习小题多维练(全国通用)辽宁省实验中学2021-2022学年高一上学期11月期中阶段测试化学试题福建省泉州市永春第一中学2022-2023学年高一上学期期末考试化学试题
名校
4 . 足量的铜与一定量的浓硝酸充分反应,得到4.48L(标准状况)NO2与NO的混合气体,这些气体与一定体积的O2混合后通入水中,恰好被完全吸收生成硝酸。向所得硝酸铜溶液中加入100mL4mol·L-1NaOH溶液,Cu2+恰好沉淀完全。下列说法正确的是
| A.此反应过程中转移了0.5mol的电子 |
| B.消耗氧气的体积为1.12L(标准状况) |
| C.参加反应的HNO3是0.45mol |
| D.混合气体中含2.24L(标准状况)NO |
您最近一年使用:0次
2020-07-22更新
|
3004次组卷
|
11卷引用:辽宁省大连市旅顺口区2019-2020学年高一下学期期末考试化学试题
辽宁省大连市旅顺口区2019-2020学年高一下学期期末考试化学试题辽宁省大连市2019-2020学年高一下学期期末考试化学试题重庆市缙云教育联盟2020-2021学年高一9月月考化学试题辽宁省部分中学2019-2020高一下学期期末考试化学试题山西省实验中学2020-2021学年高一下学期第一次月考化学试题辽宁省大连市一0三中学2020-2021学年高一4月月考化学试题黑龙江省鹤岗市第一中学2021-2022学年高一下学期4月月考化学试题云南省曲靖市第一中学2022-2023学年高一下学期期末考试化学试题安徽省铜陵市第一中学2022-2023 学年高一下学期期中教学质量检测化学试题云南省开远市第一中学校2022-2023学年高一下学期期末考试化学试题重庆市万州第二高级中学2023-2024学年高一下学期3月月考试题 化学试题
解题方法
5 . 草酸合铁(Ⅲ)酸钾晶体{Ka[Fe(C2O4)b]·cH2O}易溶于水,难溶于乙醇,110℃可完全失去结晶水,是制备某些铁触媒的主要原料。实验室通过下列方法制备Ka[Fe(C2O4)b]·cH2O并测定其组成:
Ⅰ.草酸合铁酸钾晶体的制备
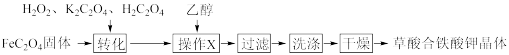
(1)“转化”过程中若条件控制不当,会发生H2O2氧化H2C2O4的副反应,写出该副反应的化学方程式:_________________________ 。
(2)“操作X”中加入乙醇的目的是_______________________ 。
Ⅱ.草酸合铁酸钾组成的测定
步骤1:准确称取两份质量均为0.4910 g的草酸合铁酸钾样品。
步骤2:一份在N2氛围下保持110℃加热至恒重,称得残留固体质量为0.4370 g。
步骤3:另一份完全溶于水后,让其通过装有某阴离子交换树脂的交换柱,发生反应:aRCl+[Fe(C2O4)b]a-=Ra[Fe(C2O4)b]+aCl-,用蒸馏水冲洗交换柱,收集交换出的Cl-,以K2CrO4为指示剂,用0.1500 mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液20.00 mL。
(3)若步骤3中未用蒸馏水冲洗交换柱,则测得的样品中K+的物质的量________ (填“偏大”“偏小”或“不变”)。
(4)通过计算确定草酸合铁酸钾样品的化学式(写出计算过程)。________
Ⅰ.草酸合铁酸钾晶体的制备

(1)“转化”过程中若条件控制不当,会发生H2O2氧化H2C2O4的副反应,写出该副反应的化学方程式:
(2)“操作X”中加入乙醇的目的是
Ⅱ.草酸合铁酸钾组成的测定
步骤1:准确称取两份质量均为0.4910 g的草酸合铁酸钾样品。
步骤2:一份在N2氛围下保持110℃加热至恒重,称得残留固体质量为0.4370 g。
步骤3:另一份完全溶于水后,让其通过装有某阴离子交换树脂的交换柱,发生反应:aRCl+[Fe(C2O4)b]a-=Ra[Fe(C2O4)b]+aCl-,用蒸馏水冲洗交换柱,收集交换出的Cl-,以K2CrO4为指示剂,用0.1500 mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液20.00 mL。
(3)若步骤3中未用蒸馏水冲洗交换柱,则测得的样品中K+的物质的量
(4)通过计算确定草酸合铁酸钾样品的化学式(写出计算过程)。
您最近一年使用:0次
6 . 用磷铁渣(含Fe、FeP、Fe2P及少量杂质)制备FePO4·2H2O(磷酸铁)的工艺流程如下:
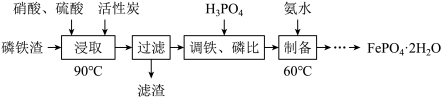
(1)“浸取”时,在密闭反应器中加入硝酸、硫酸及活性炭,硝酸首先分解生成NO2和O2,O2将铁和磷分别氧化为Fe2O3、P2O5。
①Fe2P与O2反应的化学方程式为__________ 。
②加入硫酸的目的是__________ ;加入活性炭能降低有害气体的产生,这是因为__________ 。
③c(HNO3)与磷铁渣溶解率关系,如题图-1所示,当c(HNO3)在1.5~2.0mol·L-1时,磷铁渣溶解率随硝酸的浓度增大而减小的原因是__________
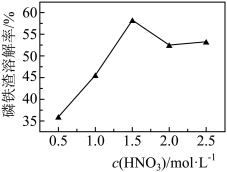 图-1
图-1
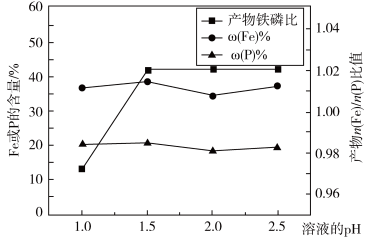 图-2
图-2
(2)“制备”时,溶液的pH对磷酸铁产品中铁和磷的含量及n(Fe)/n(P)比值的影响,如题图-2所示(考虑到微量金属杂质,在pH=1时,n(Fe)/n(P)为0.973最接近理论值])。在pH范围为1~1.5时,随pH增大,n(Fe)/n(P)明显增大,其原因是___________ ;写出生成FePO4·2H2O的离子方程式:__________________________ 。

(1)“浸取”时,在密闭反应器中加入硝酸、硫酸及活性炭,硝酸首先分解生成NO2和O2,O2将铁和磷分别氧化为Fe2O3、P2O5。
①Fe2P与O2反应的化学方程式为
②加入硫酸的目的是
③c(HNO3)与磷铁渣溶解率关系,如题图-1所示,当c(HNO3)在1.5~2.0mol·L-1时,磷铁渣溶解率随硝酸的浓度增大而减小的原因是
 图-1
图-1 图-2
图-2(2)“制备”时,溶液的pH对磷酸铁产品中铁和磷的含量及n(Fe)/n(P)比值的影响,如题图-2所示(考虑到微量金属杂质,在pH=1时,n(Fe)/n(P)为0.973最接近理论值])。在pH范围为1~1.5时,随pH增大,n(Fe)/n(P)明显增大,其原因是
您最近一年使用:0次
名校
7 . 铋(Bi)位于元素周期表中第VA族,其价态为+3时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取一定量的硫酸锰MnSO4溶液,向其中依次滴加下列溶液,对应现象如表所示:
在上述实验条件下,下列结论正确的是
| 加入溶液 | ①适量铋酸钠溶液 | ②过量双氧水 | ③适量KI-淀粉溶液 |
| 实验现象 | 溶液呈紫红色 | 溶液紫红色消失,产生气泡 | 溶液缓慢变成蓝色 |
| A.氧化性强弱顺序为:BiO3->MnO4->H2O2>I2 |
| B.H2O2被高锰酸根离子还原成O2 |
| C.H2O2具有氧化性,把KI氧化成I2 |
| D.KI-淀粉溶液中滴加铋酸钠溶液,溶液不一定变蓝色 |
您最近一年使用:0次
2020-04-30更新
|
1219次组卷
|
3卷引用:山东省潍坊市临朐县2020届高三第一次综合模拟考试化学试题
2020·全国·零模
解题方法
8 . 某磷灰石主要成分有羟磷灰石[Ca5(PO4)3OH]和氟磷灰石[Ca5(PO4)3F];制备磷酸的两种工艺流程如图(部分产物和条件省略):
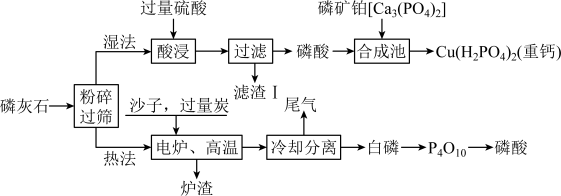
试回答下列问题:
(1)Ca5(PO4)3OH改写成“碱和盐”形式为:___ ;从组成看,Ca5(PO4)3F,类似下列盐的是___ (填字母)。
A.(NH4)2Fe(SO4)2 B.CaOCl2
C.BiOCl(Bi为+3价) D.Cu2(OH)2CO3
(2)提高“酸浸”速率的措施有___ (填一条即可)。
(3)“酸浸”中Ca5(PO4)3F和H2SO4反应的化学方程式为___ (要求:x用数字表示)。
(4)沙子、过量焦炭、氟磷灰石在电炉中反应生成CaSiO3、白磷、SiF4和另一种还原性气体,写出该反应的化学程式:___ ,在该反应中氧化产物与还原产物的物质的量之比为___ 。
(5)常温下,Ksp(CaSO4)=7.1×10-5,Ksp[Ca3(PO4)2]=2.1×10-33。H3PO4的电离常数:pK1=-lgK1=2.12,pK2=7.21,pK3=12.67,从离子积和浓度积关系角度分析Ca3(PO4)2和H2SO4反应生成CaSO4和H3PO4的主要原因是___ 。
(6)相对于湿法,热法的主要缺点有能耗高等,优点有___ (答一条即可)

试回答下列问题:
(1)Ca5(PO4)3OH改写成“碱和盐”形式为:
A.(NH4)2Fe(SO4)2 B.CaOCl2
C.BiOCl(Bi为+3价) D.Cu2(OH)2CO3
(2)提高“酸浸”速率的措施有
(3)“酸浸”中Ca5(PO4)3F和H2SO4反应的化学方程式为
(4)沙子、过量焦炭、氟磷灰石在电炉中反应生成CaSiO3、白磷、SiF4和另一种还原性气体,写出该反应的化学程式:
(5)常温下,Ksp(CaSO4)=7.1×10-5,Ksp[Ca3(PO4)2]=2.1×10-33。H3PO4的电离常数:pK1=-lgK1=2.12,pK2=7.21,pK3=12.67,从离子积和浓度积关系角度分析Ca3(PO4)2和H2SO4反应生成CaSO4和H3PO4的主要原因是
(6)相对于湿法,热法的主要缺点有能耗高等,优点有
您最近一年使用:0次
名校
9 . 工业上用草酸“沉钴”,再过滤草酸钴得到的母液A经分析主要含有下列成分:
为了有效除去母液A中残留的大量草酸,一般用氯气氧化处理草酸,装置如下:

回答下列问题:
(1)母液A中c(Co2+)为____ mol·L-1。 ,
(2)分液漏斗中装入盐酸,写出制取氯气的离子方程式____________ 。反应后期使用调温电炉加热,当锥形瓶中____ (填现象)时停止加热。
(3)三颈烧瓶反应温度为50℃,水浴锅的温度应控制为____ (填序号)。
(4)氯气氧化草酸的化学方程式为________ 。
(5)搅拌器能加快草酸的去除速率,若搅拌速率过快则草酸去除率反而降低,主要原因是__________ 。
(6)若用草酸铵代替草酸“沉钴”,其优点是____ ,其主要缺点为________ 。
| H2C2O4 | Co2+ | Cl- | |
| 质量浓度 | 20.0g/L | 1.18g/L | 2.13g/L |

回答下列问题:
(1)母液A中c(Co2+)为
(2)分液漏斗中装入盐酸,写出制取氯气的离子方程式
(3)三颈烧瓶反应温度为50℃,水浴锅的温度应控制为
A.50℃ B.5l-52℃ C.45 - 55℃ D.60℃
(4)氯气氧化草酸的化学方程式为
(5)搅拌器能加快草酸的去除速率,若搅拌速率过快则草酸去除率反而降低,主要原因是
(6)若用草酸铵代替草酸“沉钴”,其优点是
您最近一年使用:0次
2020-04-12更新
|
874次组卷
|
2卷引用:江西省南昌市2020届高三第一次模拟测试(全国I卷)理综化学试题
2012·上海嘉定·二模
解题方法
10 . 硝酸是常见的三大强酸之一,在化学研究和化工生产中有着广泛应用,常用于制备硝酸盐、染料、肥料、医药中间体、烈性炸药等。硝酸盐多用于焰火、试剂、图象处理行业。
(1)某金属M的硝酸盐受热时按下式分解:2MNO3 2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672 mL。由此可以计算出M的相对原子质量为
2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672 mL。由此可以计算出M的相对原子质量为__ 。
(2)将32.64 g 铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体折算成标准状况下的体积为11.2 L。其中NO的体积为__ 。
(3)现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100 mL 0.6 mol HNO3溶液恰好使混合物完全溶解,同时收集到224 mL NO气体(S.T.P.)。则产物中硝酸铜的物质的量为_ 。如原混合物中有0.0l mol Cu,则其中Cu2O与CuO的质量比为__ 。
(4)有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4 mol/L和2 mol/L,取10 mL此混合酸,向其中加入过量的铁粉,HNO3被还原成NO,待反应结束后,可产生标准状况下的气体多少升___ ?
(5)加热某一硝酸铜的结晶水合物和硝酸银的混合物110.2 g,使之完全分解,得到固体残渣48.4 g。将反应后产生的气体通过水充分吸收后,剩余气体1.68 L(S.T.P.)。求原混合物中硝酸铜结晶水合物的化学式___ 。
(1)某金属M的硝酸盐受热时按下式分解:2MNO3
 2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672 mL。由此可以计算出M的相对原子质量为
2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672 mL。由此可以计算出M的相对原子质量为(2)将32.64 g 铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体折算成标准状况下的体积为11.2 L。其中NO的体积为
(3)现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100 mL 0.6 mol HNO3溶液恰好使混合物完全溶解,同时收集到224 mL NO气体(S.T.P.)。则产物中硝酸铜的物质的量为
(4)有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4 mol/L和2 mol/L,取10 mL此混合酸,向其中加入过量的铁粉,HNO3被还原成NO,待反应结束后,可产生标准状况下的气体多少升
(5)加热某一硝酸铜的结晶水合物和硝酸银的混合物110.2 g,使之完全分解,得到固体残渣48.4 g。将反应后产生的气体通过水充分吸收后,剩余气体1.68 L(S.T.P.)。求原混合物中硝酸铜结晶水合物的化学式
您最近一年使用:0次



