解题方法
1 . 钒铬还原渣是钠化提钒过程的固体废弃物,其主要成分为VO2·xH2O、Cr(OH)3及少量的SiO2。一种初步分离钒铬还原渣中钒铬并获得Na2Cr2O7的工艺流程如下:
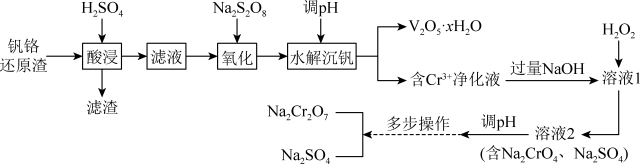
已知:①“酸浸”后VO2·xH2O转化为VO2+;
②Cr(OH)3的Ksp近似为1×10-30;
③有关物质的溶解度(g/100gH2O)如下表所示:
回答下列问题:
(1)“滤渣”的主要成分是___________ ,“氧化”生成VO ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
(2)若“含Cr3+净化液”中c(Cr3+)=0.1mol/L,则“水解沉钒”调pH的范围是2.5~___________ 。
(3)“溶液1”中含CrO ,加入H2O2后发生反应的离子方程式为
,加入H2O2后发生反应的离子方程式为___________ ,该反应中氧化剂与还原剂的物质的量之比为___________ 。
(4)“多步操作”包括蒸发浓缩、___________ 、冷却结晶、过滤、洗涤等步骤。
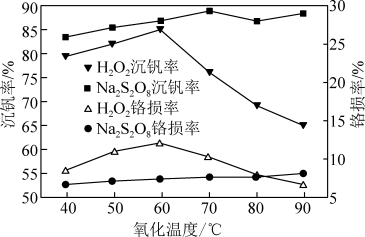
(5)研究温度对Na2S2O8与H2O2的氧化—水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在90℃左右,降低温度能耗增加。由图可知,分别采用H2O2、Na2S2O8进行“氧化”时,应选择的适宜温度是___________ 、___________ ,与Na2S2O8相比,采用H2O2氧化的主要不足之处有___________ (写出两点)。

已知:①“酸浸”后VO2·xH2O转化为VO2+;
②Cr(OH)3的Ksp近似为1×10-30;
③有关物质的溶解度(g/100gH2O)如下表所示:
| 温度/℃ | 20 | 40 | 60 | 80 | 100 |
| Na2Cr2O7 | 183.6 | 215.1 | 269.2 | 376.4 | 415.0 |
| Na2SO4 | 19.5 | 48.8 | 45.3 | 43.7 | 42.5 |
(1)“滤渣”的主要成分是
 ,发生反应的离子方程式为
,发生反应的离子方程式为(2)若“含Cr3+净化液”中c(Cr3+)=0.1mol/L,则“水解沉钒”调pH的范围是2.5~
(3)“溶液1”中含CrO
 ,加入H2O2后发生反应的离子方程式为
,加入H2O2后发生反应的离子方程式为(4)“多步操作”包括蒸发浓缩、
(5)研究温度对Na2S2O8与H2O2的氧化—水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在90℃左右,降低温度能耗增加。由图可知,分别采用H2O2、Na2S2O8进行“氧化”时,应选择的适宜温度是

您最近一年使用:0次
2021-11-03更新
|
1037次组卷
|
5卷引用:四川省绵阳市2021-2022学年高三上学期第一次考试理综化学试题
四川省绵阳市2021-2022学年高三上学期第一次考试理综化学试题湖北省黄冈市2021-2022学年高三上学期11月联考化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】01(已下线)一轮巩固卷6-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)河南省济源英才学校2023-2024学年高三上学期11月月考 化学试卷
解题方法
2 . 四氧化三锰是一种重要的化工产品,主要用于电子工业,一种以软锰矿(主要成分为MnO2,杂质金属元素为Fe、Mg、Al等)、硫铁矿(主要成分为FeS2,杂质主要为SiO2等)为原料制备Mn3O4的工艺流程如图。
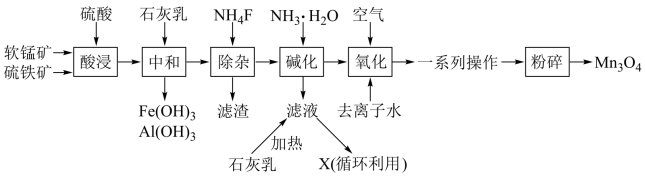
回答下列问题:
(1)流程中多次用到了过滤操作,该操作所用的玻璃仪器有普通漏斗、烧杯、___ 。
(2)为了提高“酸浸”时的浸取速率,可采取的措施有___ (任写一种);“酸浸”时生成Fe2(SO4)3和MnSO4的化学方程式为___ 。
(3)常温时部分金属离子在溶液中完全沉淀时的pH如表所示:
则“中和”时调节溶液pH的最小值为___ (填整数),“除杂”时,滤渣的主要成分为___ (填化学式)。
(4)循环利用的物质X为___ (填化学式),生成该物质的离子方程式为___ ;证明Mn(OH)2已洗涤干净的操作为___ 。
(5)“一系列操作”包括___ 。

回答下列问题:
(1)流程中多次用到了过滤操作,该操作所用的玻璃仪器有普通漏斗、烧杯、
(2)为了提高“酸浸”时的浸取速率,可采取的措施有
(3)常温时部分金属离子在溶液中完全沉淀时的pH如表所示:
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH | 9.7 | 3.2 | 4.7 | 10.4 | 12.4 |
则“中和”时调节溶液pH的最小值为
(4)循环利用的物质X为
(5)“一系列操作”包括
您最近一年使用:0次
名校
3 . 氯化亚铜(CuCl)可用作有机合成催化剂、杀菌剂、媒染剂、脱色剂等,用途广泛,回答下列问题:
已知:①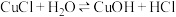
②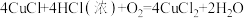
I.实验室采用 还原
还原 的方法制备CuCl,主要流程如图1所示:
的方法制备CuCl,主要流程如图1所示:

(1)上述方法制备CuCl涉及的离子方程式为: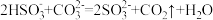 、
、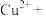

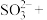 _______=
_______=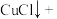

 (配平该离子方程式)
(配平该离子方程式)___________ 。
(2)实验室反应装置中的加热方式采用油浴,不使用热水浴,原因是___________ 。
(3)将CuCl沉淀先用___________ (填字母)洗涤3~5次,再用乙醇边洗涤边进行减压过滤,用乙醇作洗涤剂的目的是___________ 。
a. b.稀
b.稀 c.浓盐酸
c.浓盐酸
II.铈量法测定氯化亚铜(CuCl)的含量
称取0.2500g CuCl试样,置于预先放有50粒玻璃球和10mL 0.5mol/L 溶液(过量)的250mL锥形瓶中,不断摇动,待试样溶解充分反应后,加50mL水、2滴邻菲罗琳指示剂,立即用0.01mol/L
溶液(过量)的250mL锥形瓶中,不断摇动,待试样溶解充分反应后,加50mL水、2滴邻菲罗琳指示剂,立即用0.01mol/L  标准溶液滴定,颜色由红变绿时即为终点,消耗VmL,
标准溶液滴定,颜色由红变绿时即为终点,消耗VmL,
(4)CuCl被 溶液氧化的离子方程式为
溶液氧化的离子方程式为___________ 。
(5)滴定操作中盛放 标准溶液使用的仪器是
标准溶液使用的仪器是___________ 。
(6)滴定过程中发生氧化还原反应: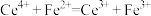 ,计算样品中CuCl质量分数的表达式为
,计算样品中CuCl质量分数的表达式为___________ (用含V的式子表示),
(7)判断下列情况对CuCl含量测定结果的影响(填“偏高”“偏低”或“无影响“)。
①若滴定开始时仰视滴定管刻度读数,则测定结果___________
②若滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则定结果___________
已知:①
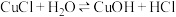
②
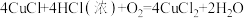
I.实验室采用
 还原
还原 的方法制备CuCl,主要流程如图1所示:
的方法制备CuCl,主要流程如图1所示:
(1)上述方法制备CuCl涉及的离子方程式为:
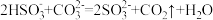 、
、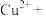

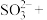 _______=
_______=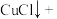

 (配平该离子方程式)
(配平该离子方程式)(2)实验室反应装置中的加热方式采用油浴,不使用热水浴,原因是
(3)将CuCl沉淀先用
a.
 b.稀
b.稀 c.浓盐酸
c.浓盐酸II.铈量法测定氯化亚铜(CuCl)的含量
称取0.2500g CuCl试样,置于预先放有50粒玻璃球和10mL 0.5mol/L
 溶液(过量)的250mL锥形瓶中,不断摇动,待试样溶解充分反应后,加50mL水、2滴邻菲罗琳指示剂,立即用0.01mol/L
溶液(过量)的250mL锥形瓶中,不断摇动,待试样溶解充分反应后,加50mL水、2滴邻菲罗琳指示剂,立即用0.01mol/L  标准溶液滴定,颜色由红变绿时即为终点,消耗VmL,
标准溶液滴定,颜色由红变绿时即为终点,消耗VmL,(4)CuCl被
 溶液氧化的离子方程式为
溶液氧化的离子方程式为(5)滴定操作中盛放
 标准溶液使用的仪器是
标准溶液使用的仪器是(6)滴定过程中发生氧化还原反应:
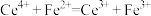 ,计算样品中CuCl质量分数的表达式为
,计算样品中CuCl质量分数的表达式为(7)判断下列情况对CuCl含量测定结果的影响(填“偏高”“偏低”或“无影响“)。
①若滴定开始时仰视滴定管刻度读数,则测定结果
②若滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则定结果
您最近一年使用:0次
2021-10-26更新
|
146次组卷
|
2卷引用:江西省抚州市临川区第十中学2022届高三月考化学试卷
名校
解题方法
4 . 亚氯酸钠( )是一种高效氧化剂和漂白剂。种制备亚氯酸钠粗产品的工艺流程如下:
)是一种高效氧化剂和漂白剂。种制备亚氯酸钠粗产品的工艺流程如下:
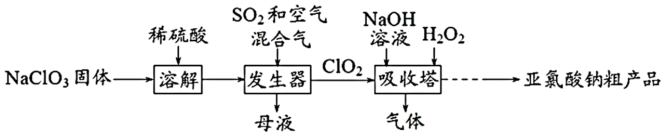
已知:纯 易分解爆炸;
易分解爆炸; 在碱性溶液中稳定存在,在酸性溶液中分解为
在碱性溶液中稳定存在,在酸性溶液中分解为 和
和 。
。
下列说法正确的是
 )是一种高效氧化剂和漂白剂。种制备亚氯酸钠粗产品的工艺流程如下:
)是一种高效氧化剂和漂白剂。种制备亚氯酸钠粗产品的工艺流程如下:
已知:纯
 易分解爆炸;
易分解爆炸; 在碱性溶液中稳定存在,在酸性溶液中分解为
在碱性溶液中稳定存在,在酸性溶液中分解为 和
和 。
。下列说法正确的是
A.发生器中鼓入空气的作用是将 氧化 氧化 |
B.从母液中回收的主要物质是 和 和 |
C.吸收塔内反应的离子方程式为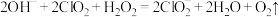 |
D.理论上,每生产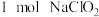 至少需要通入 至少需要通入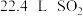 (标准状况) (标准状况) |
您最近一年使用:0次
2021-10-13更新
|
1234次组卷
|
2卷引用:山东省潍坊市安丘市等三县2022届高三10月过程性测试化学试题
5 . CO2综合利用有利于实现碳中和目标,对于构建低碳社会具有重要意义。
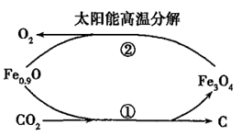
(1)在太阳能的作用下,缺铁氧化物[如Fe0.9O]能分解CO2,其过程如图所示。过程①的化学方程式是___________ 。在过程②中每产生1molO2,转移电子___________ mol。
(2)CO2与H2一起直接制备甲醇,其中的主要过程包括以下反应:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=—49.0kJ·mol−1
CH3OH(g)+H2O(g) ΔH=—49.0kJ·mol−1
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.1kJ·mol−1
CO(g)+H2O(g) ΔH=+41.1kJ·mol−1
研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性,使用该催化剂,按n(CO2):n(H2)=1:3(总量为amol)投料于恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示:(忽略温度对催化剂的影响)
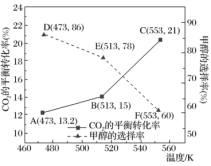
①根据图中数据,温度选择___________ K,达到平衡时,反应体系内甲醇的产量最高。
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,请分析其原因___________ 。
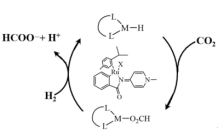
(3)利用CO2在新型钌配合物催化剂下加氢合成甲酸,反应机理如图所示,图中含Ru配合物的某段结构用M表示。中间体为___________ ,研究表明,极性溶剂有助于促进CO2插入M-H键,使用极性溶剂后极大地提高了整个反应的合成效率,原因是___________
(1)在太阳能的作用下,缺铁氧化物[如Fe0.9O]能分解CO2,其过程如图所示。过程①的化学方程式是

(2)CO2与H2一起直接制备甲醇,其中的主要过程包括以下反应:
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=—49.0kJ·mol−1
CH3OH(g)+H2O(g) ΔH=—49.0kJ·mol−1②CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.1kJ·mol−1
CO(g)+H2O(g) ΔH=+41.1kJ·mol−1研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性,使用该催化剂,按n(CO2):n(H2)=1:3(总量为amol)投料于恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示:(忽略温度对催化剂的影响)

①根据图中数据,温度选择
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,请分析其原因
(3)利用CO2在新型钌配合物催化剂下加氢合成甲酸,反应机理如图所示,图中含Ru配合物的某段结构用M表示。中间体为

您最近一年使用:0次
2021-10-10更新
|
349次组卷
|
2卷引用:江苏省苏州八校联盟2021-2022学年高三上学期第一次适应性检化学试题
解题方法
6 . 钒是一种重要的战略金属元素,被誉为“现代工业的维生素”。制备 的工艺流程图如下:
的工艺流程图如下:
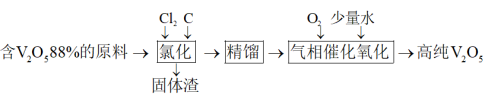
(1)“氯化”过程中反应温度控制在200℃左右,生成三氯氧钒( )和CO2,其化学方程式为
)和CO2,其化学方程式为___________ 。如果不加入碳,也能生成三氯氧钒( ),此时反应温度须控制在600℃以上,碳的作用不但可以促使反应趋于完全,而且还能
),此时反应温度须控制在600℃以上,碳的作用不但可以促使反应趋于完全,而且还能___________ 。
(2)在氯化过程中,不同杂质形成相应的氯化物进入粗三氯氧钒( )液体中,通过精馏的方式纯化(利用不同组分间挥发度不同,即同一温度下饱和蒸气压的不同来达到分离的目的)。主要杂质的饱和蒸气压曲线如下图:
)液体中,通过精馏的方式纯化(利用不同组分间挥发度不同,即同一温度下饱和蒸气压的不同来达到分离的目的)。主要杂质的饱和蒸气压曲线如下图:
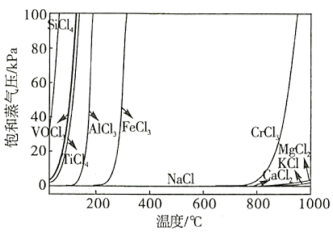
①从图中可以得出结论:挥发度( )
)___________ (填“大于”“小于”或“等于”挥发度( )
)
②经精馏后,三氯氧钒( )中主要含有的杂质为
)中主要含有的杂质为___________ 。
(3)气相催化氧化反应机理如下图所示:

①水解反应、氧化反应方程式分别为___________ 、___________ ;
②制备V2O5的工艺流程中循环使用的物质为___________ 。
(4)不同的工业设计,表现不同的特征。
①有研究人员在“氯化”过程中,控制适当的条件同时增加___________ 的用量,把V2O5转化成二氯氧钒( ),其优点是精馏后可以直接水解得到V2O5,原因是
),其优点是精馏后可以直接水解得到V2O5,原因是___________ ;
②利用含V2O588%的原料,采用湿法治金依次除去相关杂质,也可以得到V2O5,这种设计的缺点是___________ (写出一条)。
 的工艺流程图如下:
的工艺流程图如下:
(1)“氯化”过程中反应温度控制在200℃左右,生成三氯氧钒(
 )和CO2,其化学方程式为
)和CO2,其化学方程式为 ),此时反应温度须控制在600℃以上,碳的作用不但可以促使反应趋于完全,而且还能
),此时反应温度须控制在600℃以上,碳的作用不但可以促使反应趋于完全,而且还能(2)在氯化过程中,不同杂质形成相应的氯化物进入粗三氯氧钒(
 )液体中,通过精馏的方式纯化(利用不同组分间挥发度不同,即同一温度下饱和蒸气压的不同来达到分离的目的)。主要杂质的饱和蒸气压曲线如下图:
)液体中,通过精馏的方式纯化(利用不同组分间挥发度不同,即同一温度下饱和蒸气压的不同来达到分离的目的)。主要杂质的饱和蒸气压曲线如下图:
①从图中可以得出结论:挥发度(
 )
) )
)②经精馏后,三氯氧钒(
 )中主要含有的杂质为
)中主要含有的杂质为(3)气相催化氧化反应机理如下图所示:

①水解反应、氧化反应方程式分别为
②制备V2O5的工艺流程中循环使用的物质为
(4)不同的工业设计,表现不同的特征。
①有研究人员在“氯化”过程中,控制适当的条件同时增加
 ),其优点是精馏后可以直接水解得到V2O5,原因是
),其优点是精馏后可以直接水解得到V2O5,原因是②利用含V2O588%的原料,采用湿法治金依次除去相关杂质,也可以得到V2O5,这种设计的缺点是
您最近一年使用:0次
解题方法
7 . 从电镀污泥[含Cr(OH)3, Ni(OH)2、Cu(OH)2、FeO及Fe(OH)3]中回收铬并制备中铬黄(PbCrO4)的工艺流程如下:
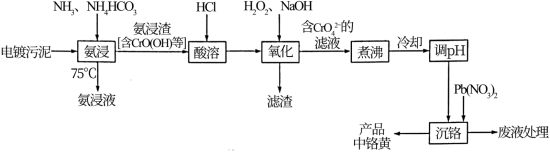
已知:I.25℃时,PbCrO4的Ksp为2.8×10-13 ,Pb(OH)2的Ksp为1.2×10-15,PbCr2O7在水溶液中不稳定,会转化为PbCrO4和H2CrO4
II.在碱性条件下,三价铬可被H2O2氧化为六价铬;在酸性条件下,六价铬可被H2O2还原为三价铬。
III.2CO +2H+
+2H+ Cr2O
Cr2O + H2O( pH <5时主要以Cr2O
+ H2O( pH <5时主要以Cr2O 存在pH≥7时主要以CrO
存在pH≥7时主要以CrO 存在)。
存在)。
回答下列问题:
(1)”氨浸”时,铬镍及铜分别以[Cr( NH3)6]3+、[Ni( NH3)6]2+及[Cu(NH3)4]2+形式被浸出,加与不加催化剂时铬的浸出率与时间的关系如下图所示:
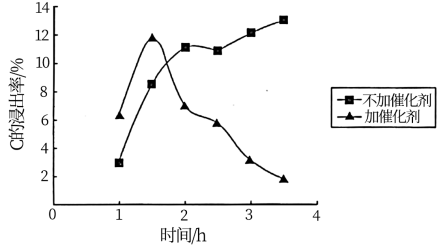
①“氨浸”的适宜温度约为75℃,超过80℃时会使镍、铜的浸出率明显下降。其原因是___________ ;其中Cu(OH)2被浸取的化学方程式为___________ 。
②“氨浸”时加入催化剂的目的是___________ 。
(2)“氧化”时生成CrO 的离子方程式为
的离子方程式为___________ 。滤渣的成分是___________ (填化学式)。
(3)“煮沸”的目的是___________ 。
(4)“沉铬”时是采用弱酸性还是碱性条件?___________ ,说明原因:___________ 。

已知:I.25℃时,PbCrO4的Ksp为2.8×10-13 ,Pb(OH)2的Ksp为1.2×10-15,PbCr2O7在水溶液中不稳定,会转化为PbCrO4和H2CrO4
II.在碱性条件下,三价铬可被H2O2氧化为六价铬;在酸性条件下,六价铬可被H2O2还原为三价铬。
III.2CO
 +2H+
+2H+ Cr2O
Cr2O + H2O( pH <5时主要以Cr2O
+ H2O( pH <5时主要以Cr2O 存在pH≥7时主要以CrO
存在pH≥7时主要以CrO 存在)。
存在)。回答下列问题:
(1)”氨浸”时,铬镍及铜分别以[Cr( NH3)6]3+、[Ni( NH3)6]2+及[Cu(NH3)4]2+形式被浸出,加与不加催化剂时铬的浸出率与时间的关系如下图所示:

①“氨浸”的适宜温度约为75℃,超过80℃时会使镍、铜的浸出率明显下降。其原因是
②“氨浸”时加入催化剂的目的是
(2)“氧化”时生成CrO
 的离子方程式为
的离子方程式为(3)“煮沸”的目的是
(4)“沉铬”时是采用弱酸性还是碱性条件?
您最近一年使用:0次
2021-09-26更新
|
513次组卷
|
2卷引用:河南省大联考“顶尖计划”2021-2022学年高三上学期第一次联考理综化学试题
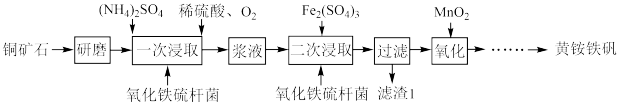
8 . 某科研小组以铜矿石(含 、
、 和少量
和少量 )为原料,采用微生物堆浸技术制备黄铵铁矾
)为原料,采用微生物堆浸技术制备黄铵铁矾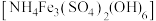 的实验流程如下:
的实验流程如下:
已知:
①氧化铁硫杆菌可将S单质转化为 。
。
② 完全沉淀时
完全沉淀时 为3.7,
为3.7, 、
、 开始沉淀时的
开始沉淀时的 分别为5.4、8.3。
分别为5.4、8.3。
回答下列问题:
(1)“研磨”的目的是_______ 。
(2)“一次浸取”时需在低温下进行,温度过高浸出率会下降,写出两种可能的原因:_______ 。
(3)“二次浸取”时加入 和氧化铁硫杆菌的目的是把
和氧化铁硫杆菌的目的是把 全部转化为可溶性的铜盐.检验加入的
全部转化为可溶性的铜盐.检验加入的 中的
中的 是否完全被还原的实验操作是
是否完全被还原的实验操作是_______ ;滤渣1的化学式为_______ 。
(4)“氧化”时发生反应的离子方程式为_______ 。
(5)黄铵铁矾的制备:
①将“氧化”后浆液过滤,边搅拌边向滤液中滴加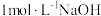 溶液,调节溶液
溶液,调节溶液 至
至_______ (填数值范围),生成沉淀的化学式为_______ 。
②过滤、用蒸馏水洗涤滤渣2~3次。向最后一次洗涤液中滴加_______ (填试剂),无沉淀产生。
③向滤渣中加入等体积的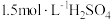 溶液和
溶液和_______  溶液,搅拌使其恰好完全反应.经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得黄铵铁矾。
溶液,搅拌使其恰好完全反应.经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得黄铵铁矾。
 、
、 和少量
和少量 )为原料,采用微生物堆浸技术制备黄铵铁矾
)为原料,采用微生物堆浸技术制备黄铵铁矾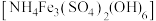 的实验流程如下:
的实验流程如下:
已知:
①氧化铁硫杆菌可将S单质转化为
 。
。②
 完全沉淀时
完全沉淀时 为3.7,
为3.7, 、
、 开始沉淀时的
开始沉淀时的 分别为5.4、8.3。
分别为5.4、8.3。回答下列问题:
(1)“研磨”的目的是
(2)“一次浸取”时需在低温下进行,温度过高浸出率会下降,写出两种可能的原因:
(3)“二次浸取”时加入
 和氧化铁硫杆菌的目的是把
和氧化铁硫杆菌的目的是把 全部转化为可溶性的铜盐.检验加入的
全部转化为可溶性的铜盐.检验加入的 中的
中的 是否完全被还原的实验操作是
是否完全被还原的实验操作是(4)“氧化”时发生反应的离子方程式为
(5)黄铵铁矾的制备:
①将“氧化”后浆液过滤,边搅拌边向滤液中滴加
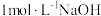 溶液,调节溶液
溶液,调节溶液 至
至②过滤、用蒸馏水洗涤滤渣2~3次。向最后一次洗涤液中滴加
③向滤渣中加入等体积的
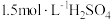 溶液和
溶液和 溶液,搅拌使其恰好完全反应.经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得黄铵铁矾。
溶液,搅拌使其恰好完全反应.经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得黄铵铁矾。
您最近一年使用:0次
9 . 从钒铬锰矿渣(主要成分为 、
、 、
、 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下: ](在空气中易被氧化.回答下列问题:
](在空气中易被氧化.回答下列问题:
(1)Cr元素位于元素周期表第_______ 周期_______ 族。
(2)用 溶液制备
溶液制备 胶体的化学方程式为
胶体的化学方程式为_______ 。
(3)常温下,各种形态五价钒粒子总浓度的对数[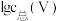 ]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中
]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中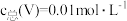 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为_______ (填化学式)。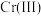 、
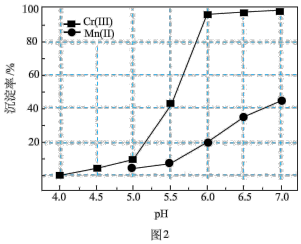
、 的沉淀率与pH关系如图2。“沉铬”过程最佳pH为
的沉淀率与pH关系如图2。“沉铬”过程最佳pH为_______ ;在该条件下滤液B中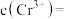
_______  【
【 近似为
近似为 ,
, 的
的 近似为
近似为 】。
】。 的离子方程式为
的离子方程式为_______ 。
(6)“提纯”过程中 的作用为
的作用为_______ 。
 、
、 、
、 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下: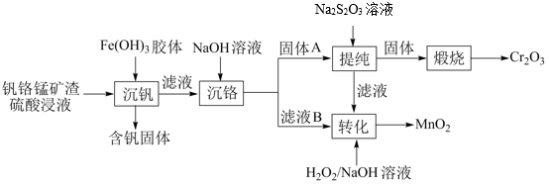
 ](在空气中易被氧化.回答下列问题:
](在空气中易被氧化.回答下列问题:(1)Cr元素位于元素周期表第
(2)用
 溶液制备
溶液制备 胶体的化学方程式为
胶体的化学方程式为(3)常温下,各种形态五价钒粒子总浓度的对数[
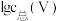 ]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中
]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中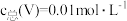 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为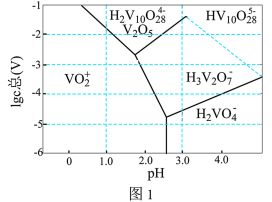
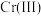 、
、 的沉淀率与pH关系如图2。“沉铬”过程最佳pH为
的沉淀率与pH关系如图2。“沉铬”过程最佳pH为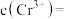
 【
【 近似为
近似为 ,
, 的
的 近似为
近似为 】。
】。
 的离子方程式为
的离子方程式为(6)“提纯”过程中
 的作用为
的作用为
您最近一年使用:0次
2021-09-13更新
|
11014次组卷
|
16卷引用:2021年新高考辽宁化学高考真题
2021年新高考辽宁化学高考真题辽宁省实验中学2021-2022学年高二上学期11月期中阶段测化学试题2021年辽宁高考化学试题变式题11-19(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)微专题17 热点金属及其化合物制备流程(V、Cr、Mn、Co、Ni)-备战2023年高考化学一轮复习考点微专题湖北省枣阳市第一中学2022-2023学年高三上学期8月化学月考试题第二部分 热点专项突破——解题能力稳提升专项2 物质提纯类的工艺流程(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)05 无机化工流程题(5) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)黑龙江省牡丹江市第二高级中学2023-2024学年高三下学期考前热身卷化学(三)试题
名校
解题方法
10 . 某萃铜余液主要含有 、
、 、
、 、
、 ,
, 等离子,从萃铜余液中回收金属和制备
等离子,从萃铜余液中回收金属和制备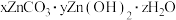 的工艺流程如图甲所示。
的工艺流程如图甲所示。

回答下列问题:
(1)过硫酸钠( )中
)中 的化合价为
的化合价为 ,
,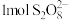 中过氧键的数目为
中过氧键的数目为___________ 。向 的萃铜余液中加入
的萃铜余液中加入 。进行“氧化除锰”,其反应的离子方程式为
。进行“氧化除锰”,其反应的离子方程式为___________ 。“氧化除锰”过程中,
___________ (填“能”或“不能”)用绿色氧化剂 来代替。
来代替。
(2)向“氧化除锰”后的余液中加入试剂 调节
调节 使铁元素完全沉淀,试剂
使铁元素完全沉淀,试剂 的化学式为
的化学式为___________ 。
(3)“沉锌”时,应保持溶液 在6.8~7.0之间,
在6.8~7.0之间, 不能过低的原因是
不能过低的原因是___________ 。
(4)“过滤”时,经常采用抽滤的方式加快过滤的速度。实验室用如图乙所示的装置,经过一系列操作完成抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):开抽气泵→a→b→d→___________ →___________ →___________ →___________ →c→关抽气泵。
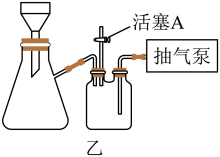
a.转移固液混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
(5)高温煅烧碱式碳酸锌[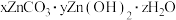 ]得到
]得到 ,取碱式碳酸锌
,取碱式碳酸锌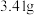 ,在高温下煅烧至恒重,得到固体
,在高温下煅烧至恒重,得到固体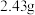 和标准状况下
和标准状况下 ,则该碱式碳酸锌的化学式为
,则该碱式碳酸锌的化学式为___________ 。
 、
、 、
、 、
、 ,
, 等离子,从萃铜余液中回收金属和制备
等离子,从萃铜余液中回收金属和制备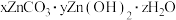 的工艺流程如图甲所示。
的工艺流程如图甲所示。
回答下列问题:
(1)过硫酸钠(
 )中
)中 的化合价为
的化合价为 ,
,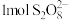 中过氧键的数目为
中过氧键的数目为 的萃铜余液中加入
的萃铜余液中加入 。进行“氧化除锰”,其反应的离子方程式为
。进行“氧化除锰”,其反应的离子方程式为
 来代替。
来代替。(2)向“氧化除锰”后的余液中加入试剂
 调节
调节 使铁元素完全沉淀,试剂
使铁元素完全沉淀,试剂 的化学式为
的化学式为(3)“沉锌”时,应保持溶液
 在6.8~7.0之间,
在6.8~7.0之间, 不能过低的原因是
不能过低的原因是(4)“过滤”时,经常采用抽滤的方式加快过滤的速度。实验室用如图乙所示的装置,经过一系列操作完成抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):开抽气泵→a→b→d→

a.转移固液混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
(5)高温煅烧碱式碳酸锌[
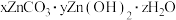 ]得到
]得到 ,取碱式碳酸锌
,取碱式碳酸锌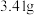 ,在高温下煅烧至恒重,得到固体
,在高温下煅烧至恒重,得到固体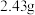 和标准状况下
和标准状况下 ,则该碱式碳酸锌的化学式为
,则该碱式碳酸锌的化学式为
您最近一年使用:0次
2021-09-09更新
|
1572次组卷
|
9卷引用:全国2022届高三上学期第一次学业质量联合检测化学试题
全国2022届高三上学期第一次学业质量联合检测化学试题广东省珠海市第二中学2022届高三十月月考化学试题山东省潍坊市第一中学2022届高三10月月考化学试题陕西省西安市长安区第一中学2022届高三第一次模拟考试化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】07(已下线)第19周 晚练题-备战2022年高考化学周测与晚练(新高考专用)(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题(已下线)2019年高考浙江卷化学试题变式题(实验题)



