名校
1 . 铬及其化合物在催化、金属防腐等方面具有重要应用。催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。
(1)完成化学方程式:_____ 。
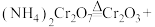 _____+_____。
_____+_____。
(2)Cr2O3催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为_____ (列式表示)。_____ (用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为_____ 。
(1)完成化学方程式:
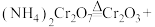 _____+_____。
_____+_____。(2)Cr2O3催化丙烷脱氢过程中,部分反应历程如图,
 过程的焓变为
过程的焓变为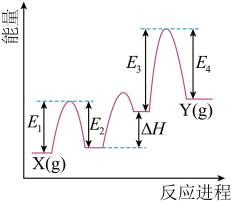
您最近一年使用:0次
2 .  下,某反应体系只存在如下8种物质:
下,某反应体系只存在如下8种物质: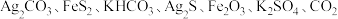 和
和 ,其中,甲既是氧化剂,又是还原剂,乙是还原产物,丙和丁是氧化产物,甲、乙、丙、丁四种物质的物质的量
,其中,甲既是氧化剂,又是还原剂,乙是还原产物,丙和丁是氧化产物,甲、乙、丙、丁四种物质的物质的量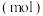 与时间关系如图所示。设
与时间关系如图所示。设 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是
 下,某反应体系只存在如下8种物质:
下,某反应体系只存在如下8种物质: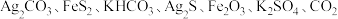 和
和 ,其中,甲既是氧化剂,又是还原剂,乙是还原产物,丙和丁是氧化产物,甲、乙、丙、丁四种物质的物质的量
,其中,甲既是氧化剂,又是还原剂,乙是还原产物,丙和丁是氧化产物,甲、乙、丙、丁四种物质的物质的量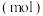 与时间关系如图所示。设
与时间关系如图所示。设 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是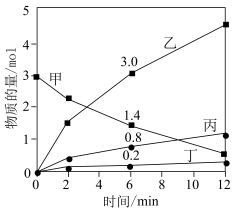
A.甲代表 ,丁为碱性氧化物 ,丁为碱性氧化物 |
B.还原产物、氧化产物的物质的量之比 |
C. 甲完全反应转移电子数为 甲完全反应转移电子数为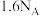 |
D.在该反应中,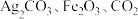 的化学计量数之比为 的化学计量数之比为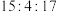 |
您最近一年使用:0次
3 . 已知转化Ⅰ: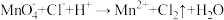 ;转化Ⅱ:
;转化Ⅱ: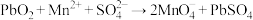 。下列说法错误的是
。下列说法错误的是
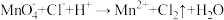 ;转化Ⅱ:
;转化Ⅱ: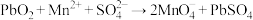 。下列说法错误的是
。下列说法错误的是A.氧化性:PbO2> >Cl2 >Cl2 |
B.转化Ⅰ、Ⅱ消耗或生成等物质的量的 ,转移电子数相同 ,转移电子数相同 |
C. 做氧化剂时,酸性越强,氧化性越强 做氧化剂时,酸性越强,氧化性越强 |
D.PbO2与FeSO4溶液反应: |
您最近一年使用:0次
2024-04-10更新
|
220次组卷
|
2卷引用:山东省青岛市2023-2024学年高一上学期期末统考化学试卷
解题方法
4 . Ⅰ.铁及其化合物在生产生活中有极其重要的用途。 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 ,以利于人体吸收。为了验证这一猜想,设计了如下实验:
,以利于人体吸收。为了验证这一猜想,设计了如下实验:
(1)由上述实验能否得出“维生素C可将 转化为
转化为 ”的结论?请说明理由:
”的结论?请说明理由:______ 。
Ⅱ.高铁酸钾( )是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和
)是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和 胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
(2)熔融法:在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠: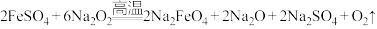 ,再加入适量饱和KOH溶液反应得到
,再加入适量饱和KOH溶液反应得到 。上述反应在熔融状态下进行,而不在水溶液中进行的原因是
。上述反应在熔融状态下进行,而不在水溶液中进行的原因是______ 。
(3)高铁酸钾可通过次氯酸钾氧化 溶液来制备。次氯酸钾的制备装置如图所示。
溶液来制备。次氯酸钾的制备装置如图所示。
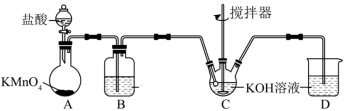
回答下列问题:
①装置A中 与盐酸反应生成
与盐酸反应生成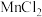 和
和 ,其化学方程式为
,其化学方程式为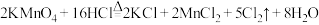 。
。
a.请用双线桥法标出电子转移方向与数目_______ 。
b.上述反应中的HCl体现了什么性质?_______ 。
②将制备的 通过装置B可除去杂质HCl,B中的溶液为
通过装置B可除去杂质HCl,B中的溶液为_____ 。
③ 和KOH溶液在较高温度下反应生成
和KOH溶液在较高温度下反应生成 。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是
。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是______ 。
④若实验制得的次氯酸钾溶液中 (N代表微粒个数),则
(N代表微粒个数),则
_______ 。
⑤装置D的作用是_______ 。
⑥次氯酸盐氧化法是在碱性条件下,KClO饱和溶液可将 转化为
转化为 ,写出反应的离子方程式:
,写出反应的离子方程式:________ 。
 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 ,以利于人体吸收。为了验证这一猜想,设计了如下实验:
,以利于人体吸收。为了验证这一猜想,设计了如下实验:| 实验方案 | 实验现象 |
取适量 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 | 紫色褪去 |
(1)由上述实验能否得出“维生素C可将
 转化为
转化为 ”的结论?请说明理由:
”的结论?请说明理由:Ⅱ.高铁酸钾(
 )是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和
)是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和 胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。(2)熔融法:在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠:
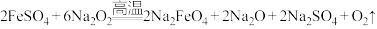 ,再加入适量饱和KOH溶液反应得到
,再加入适量饱和KOH溶液反应得到 。上述反应在熔融状态下进行,而不在水溶液中进行的原因是
。上述反应在熔融状态下进行,而不在水溶液中进行的原因是(3)高铁酸钾可通过次氯酸钾氧化
 溶液来制备。次氯酸钾的制备装置如图所示。
溶液来制备。次氯酸钾的制备装置如图所示。
回答下列问题:
①装置A中
 与盐酸反应生成
与盐酸反应生成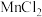 和
和 ,其化学方程式为
,其化学方程式为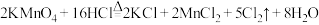 。
。a.请用双线桥法标出电子转移方向与数目
b.上述反应中的HCl体现了什么性质?
②将制备的
 通过装置B可除去杂质HCl,B中的溶液为
通过装置B可除去杂质HCl,B中的溶液为③
 和KOH溶液在较高温度下反应生成
和KOH溶液在较高温度下反应生成 。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是
。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是④若实验制得的次氯酸钾溶液中
 (N代表微粒个数),则
(N代表微粒个数),则
⑤装置D的作用是
⑥次氯酸盐氧化法是在碱性条件下,KClO饱和溶液可将
 转化为
转化为 ,写出反应的离子方程式:
,写出反应的离子方程式:
您最近一年使用:0次
解题方法
5 .  在现代工业生产中应用广泛,查阅资料得:无水
在现代工业生产中应用广泛,查阅资料得:无水 在空气中易潮解,加热易升华。
在空气中易潮解,加热易升华。
(1)用丁达尔效应鉴别 胶体和
胶体和 溶液的操作是
溶液的操作是____________ (写出具体实验操作、结论)。
(2)电子工业中用 溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出
溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:__________________ 。该反应的还原剂是______ 。
(3)硫化氢( )是一种有毒的气体,可用
)是一种有毒的气体,可用 溶液吸收,生成单质硫(S)沉淀。
溶液吸收,生成单质硫(S)沉淀。 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为____________ 。该反应中氧化产物与还原产物的物质的量之比为______ 。
(4)某小组同学设计了制备无水) 的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
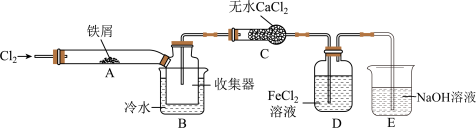
步骤Ⅰ.检验装置的气密性;
步骤Ⅱ.通入干燥的 ,赶尽装置中的空气;
,赶尽装置中的空气;
步骤Ⅲ.用酒精灯在铁屑下方加热至反应完成;
步骤Ⅳ.体系冷却后,停止通入 ,并用干燥的
,并用干燥的 赶尽
赶尽 ,将收集器密封。
,将收集器密封。
①装置A中发生反应的化学方程式为__________________ 。
②装置B中冷水浴的作用为____________ 。
 在现代工业生产中应用广泛,查阅资料得:无水
在现代工业生产中应用广泛,查阅资料得:无水 在空气中易潮解,加热易升华。
在空气中易潮解,加热易升华。(1)用丁达尔效应鉴别
 胶体和
胶体和 溶液的操作是
溶液的操作是(2)电子工业中用
 溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出
溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:(3)硫化氢(
 )是一种有毒的气体,可用
)是一种有毒的气体,可用 溶液吸收,生成单质硫(S)沉淀。
溶液吸收,生成单质硫(S)沉淀。 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为(4)某小组同学设计了制备无水)
 的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
步骤Ⅰ.检验装置的气密性;
步骤Ⅱ.通入干燥的
 ,赶尽装置中的空气;
,赶尽装置中的空气;步骤Ⅲ.用酒精灯在铁屑下方加热至反应完成;
步骤Ⅳ.体系冷却后,停止通入
 ,并用干燥的
,并用干燥的 赶尽
赶尽 ,将收集器密封。
,将收集器密封。①装置A中发生反应的化学方程式为
②装置B中冷水浴的作用为
您最近一年使用:0次
6 . 如图是木炭与氧化铜反应的实验装置图,下列说法错误 的是
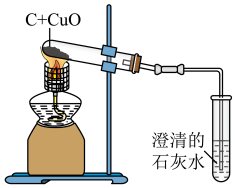

| A.进行实验前,应先检查装置的气密性 |
| B.实验过程中,可观察到试管里的黑色固体变为红色 |
| C.实验结束后,应先停止加热,再将导气管从澄清石灰水中撤出 |
D.加热时,试管中发生反应的化学方程式为C+2CuO 2Cu+CO2↑ 2Cu+CO2↑ |
您最近一年使用:0次
7 . 将赤铜矿(主要成分Cu2O)和辉铜矿(主要成分Cu2S)混合焙烧可得到铜,反应的方程式为2Cu2O+Cu2S 6Cu+X↑,则X的化学式是
6Cu+X↑,则X的化学式是
 6Cu+X↑,则X的化学式是
6Cu+X↑,则X的化学式是| A.O2 | B.SO2 | C.S | D.SO3 |
您最近一年使用:0次
名校
解题方法
8 . 守恒是重要的科学原理,我们在学习化学的过程中接触过很多守恒:质量守恒、原子守恒、电子守恒、电荷守恒等。请回答以下问题:
(1)某溶液中只有 、
、 、
、 和
和 四种离子,已知
四种离子,已知 、
、 、
、 的物质的量浓度分别2mol/L、1mol/L、1mol/L,则
的物质的量浓度分别2mol/L、1mol/L、1mol/L,则 的物质的量浓度为
的物质的量浓度为___________ mol/L。
(2)同温同压下,某集气瓶充满 时为116g,充满
时为116g,充满 时为122g,充满气体A时为114g,则A的相对分子质量为
时为122g,充满气体A时为114g,则A的相对分子质量为___________ 。
(3)在浓盐酸中 与
与 反应的离子方程式为:
反应的离子方程式为: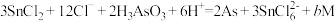 ,则b的数值为
,则b的数值为___________ 。
(4)在100mL 溶液中通入2.24L氯气(标准状况);溶液中有1/2的
溶液中通入2.24L氯气(标准状况);溶液中有1/2的 被氧化成单质
被氧化成单质 ,则原
,则原 溶液中
溶液中 的物质的量浓度为
的物质的量浓度为___________ mol/L。
(5)已知:1mol 与一定浓度的
与一定浓度的 反应,生成
反应,生成 、
、 、NO和
、NO和 ,表现氧化性的硝酸的物质的量是
,表现氧化性的硝酸的物质的量是___________ mol。
(1)某溶液中只有
 、
、 、
、 和
和 四种离子,已知
四种离子,已知 、
、 、
、 的物质的量浓度分别2mol/L、1mol/L、1mol/L,则
的物质的量浓度分别2mol/L、1mol/L、1mol/L,则 的物质的量浓度为
的物质的量浓度为(2)同温同压下,某集气瓶充满
 时为116g,充满
时为116g,充满 时为122g,充满气体A时为114g,则A的相对分子质量为
时为122g,充满气体A时为114g,则A的相对分子质量为(3)在浓盐酸中
 与
与 反应的离子方程式为:
反应的离子方程式为: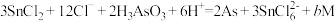 ,则b的数值为
,则b的数值为(4)在100mL
 溶液中通入2.24L氯气(标准状况);溶液中有1/2的
溶液中通入2.24L氯气(标准状况);溶液中有1/2的 被氧化成单质
被氧化成单质 ,则原
,则原 溶液中
溶液中 的物质的量浓度为
的物质的量浓度为(5)已知:1mol
 与一定浓度的
与一定浓度的 反应,生成
反应,生成 、
、 、NO和
、NO和 ,表现氧化性的硝酸的物质的量是
,表现氧化性的硝酸的物质的量是
您最近一年使用:0次
名校
9 . 氧化还原反应在生活、生产与科学实验中有重要作用。
回答下列问题:
(1)亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。
①误食 会导致入体血红蛋白中的
会导致入体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 发生反应
发生反应_____ (填“氧化”或“还原”,下同),服用维生素 可将
可将 转化为
转化为 从而解毒,这说明维生素
从而解毒,这说明维生素 具有
具有________ 性。
②实验室可利用反应 制备少量
制备少量 ,若反应中有
,若反应中有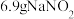 固体生成,则转移电子的物质的量为
固体生成,则转移电子的物质的量为________  。
。
(2) 、
、 是常用的氧化剂。
是常用的氧化剂。
①已知: 、
、 、
、 、
、 和一些未知物组成一个氧化还原反应,其中
和一些未知物组成一个氧化还原反应,其中 是氧化产物,则还原性:
是氧化产物,则还原性:
_________  (填“
(填“ ”或“
”或“ ”)。
”)。
②请结合①中反应,写出一个能证明氧化性 的离子方程式:
的离子方程式:___________________ 。
(3)高铁酸钾( )是一种高效多功能的新型非氯绿色消毒剂。
)是一种高效多功能的新型非氯绿色消毒剂。
①工业上可通过次氯酸盐氧化法制备 :
: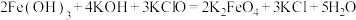 。请写出该反应的离子方程式并用双线桥法标出电子转移的方向与数目:
。请写出该反应的离子方程式并用双线桥法标出电子转移的方向与数目:___________________ 。
② 净水原理如图所示:
净水原理如图所示:

若过程 中转移
中转移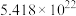 个电子,需
个电子,需____________ 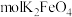 。
。
③向 溶液中加入适量的饱和
溶液中加入适量的饱和 溶液,有
溶液,有 析出,写出该反应的离子方程式:
析出,写出该反应的离子方程式:____________ 。
回答下列问题:
(1)亚硝酸钠(
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。①误食
 会导致入体血红蛋白中的
会导致入体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 发生反应
发生反应 可将
可将 转化为
转化为 从而解毒,这说明维生素
从而解毒,这说明维生素 具有
具有②实验室可利用反应
 制备少量
制备少量 ,若反应中有
,若反应中有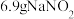 固体生成,则转移电子的物质的量为
固体生成,则转移电子的物质的量为 。
。(2)
 、
、 是常用的氧化剂。
是常用的氧化剂。①已知:
 、
、 、
、 、
、 和一些未知物组成一个氧化还原反应,其中
和一些未知物组成一个氧化还原反应,其中 是氧化产物,则还原性:
是氧化产物,则还原性:
 (填“
(填“ ”或“
”或“ ”)。
”)。②请结合①中反应,写出一个能证明氧化性
 的离子方程式:
的离子方程式:(3)高铁酸钾(
 )是一种高效多功能的新型非氯绿色消毒剂。
)是一种高效多功能的新型非氯绿色消毒剂。①工业上可通过次氯酸盐氧化法制备
 :
: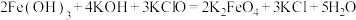 。请写出该反应的离子方程式并用双线桥法标出电子转移的方向与数目:
。请写出该反应的离子方程式并用双线桥法标出电子转移的方向与数目:②
 净水原理如图所示:
净水原理如图所示:
若过程
 中转移
中转移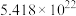 个电子,需
个电子,需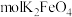 。
。③向
 溶液中加入适量的饱和
溶液中加入适量的饱和 溶液,有
溶液,有 析出,写出该反应的离子方程式:
析出,写出该反应的离子方程式:
您最近一年使用:0次
10 . 实验室中可用MnO2或KMnO4固体制备氯气,反应的化学方程式如下:
①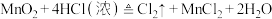
②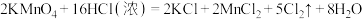
回答下列问题:
(1)对比反应①和②的反应原理,下列作为反应②的发生装置的是_______ (填字母序号)。

(2)反应①和②中,浓盐酸均体现出_______ 性和_______ 性。
(3)用双线桥法,标出下列反应中的电子转移情况_______ 。
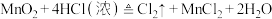
(4)若反应②在水溶液中进行,将反应②改写成离子方程式_______ 。
(5)化学实验中经常提到“酸性高锰酸钾溶液”,这里的“酸性”是因为配制高锰酸钾溶液时加入了_______ (填“硫酸”或“盐酸”)的缘故。
(6)1868年狄肯和洪特发明了用氯化铜作催化剂,在加热到450℃时,用空气中的氧气来氧化氯化氢气体制取氯气的方法——地康法。根据信息,写出该反应的化学方程式_______ 。
①
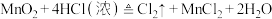
②
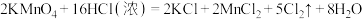
回答下列问题:
(1)对比反应①和②的反应原理,下列作为反应②的发生装置的是

(2)反应①和②中,浓盐酸均体现出
(3)用双线桥法,标出下列反应中的电子转移情况
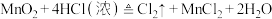
(4)若反应②在水溶液中进行,将反应②改写成离子方程式
(5)化学实验中经常提到“酸性高锰酸钾溶液”,这里的“酸性”是因为配制高锰酸钾溶液时加入了
(6)1868年狄肯和洪特发明了用氯化铜作催化剂,在加热到450℃时,用空气中的氧气来氧化氯化氢气体制取氯气的方法——地康法。根据信息,写出该反应的化学方程式
您最近一年使用:0次



