解题方法
1 . 生活中处处有化学。下列说法中未涉及氧化还原反应的是
A.葡萄酒中用 作食品添加剂 作食品添加剂 |
B.灼烧 固体焰色反应呈绿色 固体焰色反应呈绿色 |
C.我国科学家成功将 转化为淀粉 转化为淀粉 |
| D.适量补充维生素C有利于提高补铁效果 |
您最近一年使用:0次
解题方法
2 . 过氧化钠可用于医药、印染、漂白等。某学习兴趣小组探究Na2O2与NO2、NO的反应,设计如图所示实验。

(1)盛放浓硝酸的仪器M名称为_________ ,A中发生反应的离子方程式为________ 。
(2)Na2O2与NO2反应,根据化合价升降原则有下列两种观点。
观点一:Na2O2氧化NO2,生成NaNO3;
观点二:NO2氧化Na2O2,生成O2。
为验证以上观点的正确性进行如下实验:
①关闭K2和弹簧夹,打开K1和A中仪器M的活塞,再将带火星的木条放在a处,观察到_______ 。甲同学认为观点二正确。
②乙同学认为该装置不能确认观点二正确,应在A、G之间增加一个装置,该装置的作用为______ 。改进后重复甲同学的实验操作,观察到红棕色气体迅速消失,带火星的木条没有复燃。判断观点一正确。
(3)丙同学根据NO易与O2反应,预测NO也易与Na2O2反应。
①丙同学关闭K1,打开K2,用上图的装置进行实验,为防止NO与空气中氧气反应,反应前的操作是___________ 。
②装置B的作用为___________ 。
③反应一段时间后,取D装置中产物少许,加入稀硫酸,产生无色气体遇到空气变为红棕色。完成反应的化学方程式:___________ 。
6___________ 4___________
4___________
④根据D装置中产物的判断结果,说明Na2O2与NO反应中Na2O2的作用是___________ 。(填标号)
A.氧化剂 B.还原剂 C.即是氧化剂也是还原剂

(1)盛放浓硝酸的仪器M名称为
(2)Na2O2与NO2反应,根据化合价升降原则有下列两种观点。
观点一:Na2O2氧化NO2,生成NaNO3;
观点二:NO2氧化Na2O2,生成O2。
为验证以上观点的正确性进行如下实验:
①关闭K2和弹簧夹,打开K1和A中仪器M的活塞,再将带火星的木条放在a处,观察到
②乙同学认为该装置不能确认观点二正确,应在A、G之间增加一个装置,该装置的作用为
(3)丙同学根据NO易与O2反应,预测NO也易与Na2O2反应。
①丙同学关闭K1,打开K2,用上图的装置进行实验,为防止NO与空气中氧气反应,反应前的操作是
②装置B的作用为
③反应一段时间后,取D装置中产物少许,加入稀硫酸,产生无色气体遇到空气变为红棕色。完成反应的化学方程式:
6___________
 4___________
4___________
④根据D装置中产物的判断结果,说明Na2O2与NO反应中Na2O2的作用是
A.氧化剂 B.还原剂 C.即是氧化剂也是还原剂
您最近一年使用:0次
解题方法
3 . 化学与生活、科技、环境密切相关。下列说法错误 的是
| A.热的纯碱溶液可去除油污 |
| B.“暖宝宝”主要是将化学能转化为热能 |
| C.食品包装袋中的生石灰可防止食物被氧化 |
D.福岛核废水中的放射性元素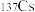 、 、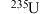 对人体有害 对人体有害 |
您最近一年使用:0次
解题方法
4 . 氧化还原反应在工农业生产、日常生活中具有广泛的用途。
(1)氯碱工业的反应原理为 ,该反应中的氧化剂是
,该反应中的氧化剂是___________ 。
(2)为了防止食品变质而添加的抗氧化剂应具有___________ 性。(填“氧化”或“还原”)
(3)电子工业中常用 溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板,其反应的离子方程式为
溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板,其反应的离子方程式为___________ 。
(4) 可用于制备铬矾、铬颜料等,也是制造火柴头的原料之一。已知反应:
可用于制备铬矾、铬颜料等,也是制造火柴头的原料之一。已知反应: ,由此可知
,由此可知 的氧化性
的氧化性___________ (填“>”或“<”) 。该反应中氧化剂与还原剂的物质的量之比为
。该反应中氧化剂与还原剂的物质的量之比为___________ 。
(1)氯碱工业的反应原理为
 ,该反应中的氧化剂是
,该反应中的氧化剂是(2)为了防止食品变质而添加的抗氧化剂应具有
(3)电子工业中常用
 溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板,其反应的离子方程式为
溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板,其反应的离子方程式为(4)
 可用于制备铬矾、铬颜料等,也是制造火柴头的原料之一。已知反应:
可用于制备铬矾、铬颜料等,也是制造火柴头的原料之一。已知反应: ,由此可知
,由此可知 的氧化性
的氧化性 。该反应中氧化剂与还原剂的物质的量之比为
。该反应中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
解题方法
5 . 某工厂的工业废水中含有大量的 、较多的
、较多的 和
和 。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,回答下列问题:
。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,回答下列问题:
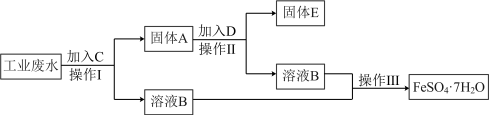
(1)加入试剂D为___________ 。
(2)加入试剂C,溶液中发生的离子方程式有___________ 。
(3)操作Ⅲ包括蒸发浓缩、___________ 、过滤、洗涤、干燥。
(4)工业上常用绿矾( )做处理剂,处理酸性废水中含有的重铬酸根离子(
)做处理剂,处理酸性废水中含有的重铬酸根离子( ),使
),使 全部转化为
全部转化为 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(5)实验室由 固体配制
固体配制 溶液。
溶液。
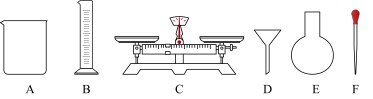
①如下图所示的仪器中配制溶液不需使用的是___________ (填字母),还缺少的玻璃仪器是___________ (填写仪器名称)。
②若实验遇下列情况,导致所配溶液的物质的量浓度偏低的是___________ (填字母)。
A.定容时仰视刻度线 B. 固体失去部分结晶水
固体失去部分结晶水
C.移液前,容量瓶内有蒸馏水 D.未冷却至室温就转移定容
 、较多的
、较多的 和
和 。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,回答下列问题:
。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,回答下列问题:
(1)加入试剂D为
(2)加入试剂C,溶液中发生的离子方程式有
(3)操作Ⅲ包括蒸发浓缩、
(4)工业上常用绿矾(
 )做处理剂,处理酸性废水中含有的重铬酸根离子(
)做处理剂,处理酸性废水中含有的重铬酸根离子( ),使
),使 全部转化为
全部转化为 ,反应的离子方程式为
,反应的离子方程式为(5)实验室由
 固体配制
固体配制 溶液。
溶液。①如下图所示的仪器中配制溶液不需使用的是

②若实验遇下列情况,导致所配溶液的物质的量浓度偏低的是
A.定容时仰视刻度线 B.
 固体失去部分结晶水
固体失去部分结晶水C.移液前,容量瓶内有蒸馏水 D.未冷却至室温就转移定容
您最近一年使用:0次
6 . 联氨(N2H4)又称“肼”,具高吸湿性、沸点386.5K、毒性强、还原性强等特性,燃烧释放出大量的热,常用于做火箭的燃料以及分析试剂中的还原剂。
I.联氨的制备
(1)联氨可用次氯酸钠溶液氧化过量的氨气制得,写出此反应得离子方程式___________ ;此反应中,被氧化的元素是_____ 。每生成1mol肼,转移的电子数为________ 。
Ⅱ .联氨的结构
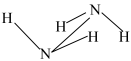
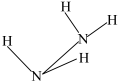
(2)联氨具强极性,推测下列结构最接近联氨分子真实结构的是________ 。
Ⅲ .联氨的性质
(3)①一定条件下, 联氨与二氯化钴(CoCl2)溶液能形成配位化合物Co(N2H4)6Cl2,关于此配位化合物的下列说法中不正确的是_____ 。
A.中心离子是Co2+ B.配位数是8
C.配位原子是N原子 D.向此配合物的溶液中滴入硝酸银,会产生白色沉淀
②联氨具高吸湿性,原因是_____ 。
③联氨水溶液与氨水类性质相似,将联氨溶于一定浓度的稀硫酸中,除形成N2H6SO4外,还可以生成的盐是_____ (填写化学式)。实验发现0.1mol·L-1N2H6SO4溶液显酸性,原因是_____ (用离子方程式表示),溶液中各种含氮微粒存在关系c(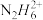 )+c(N2H6OH+)
)+c(N2H6OH+)____ 0.1-c(N2H4·2H2O)(选填“>”,“<”或“=”)。
(4)1mol液态联氨在空气中完全燃烧生成氮气和水蒸气放出621.74KJ的热量,此反应的热化学方程式是_______ 。肼有剧毒,但目前仍被普遍用作火箭的燃料,原因是________ 。
(5)联氨在一定条件下被亚硝酸氧化为叠氮酸(HN3),室温下亚硝酸、叠氮酸的电离平衡常数如表所示:
室温下,则同浓度的HNO2和HN3,其pH值:HNO2____ HN3(选填“>”、“<”或“=”),  反应性能类似卤素离子,则难溶物AgN3的Ksp表达式为
反应性能类似卤素离子,则难溶物AgN3的Ksp表达式为_________ 。
(6)某研究小组研究联氨和双氧水反应,查阅相关键能数据
并已知1molN2H4(l)→N2H4(g)与2molH2O2(l)→H2O2(g)共吸热23.76kJ,据此估算化学反应N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)的焓变ΔH=_______ kJ·mol-1,反应的熵变ΔS _____ 0(选填“>”、“<”)。研究小组利用此反应设计出如下电池,负极电极反应式:N2H4+4OH-−4e-=N2+4H2O。则正极电极反应式:________ 。
I.联氨的制备
(1)联氨可用次氯酸钠溶液氧化过量的氨气制得,写出此反应得离子方程式
Ⅱ .联氨的结构
(2)联氨具强极性,推测下列结构最接近联氨分子真实结构的是
|
|
| A. 反式结构 | B. 顺式结构 |
Ⅲ .联氨的性质
(3)①一定条件下, 联氨与二氯化钴(CoCl2)溶液能形成配位化合物Co(N2H4)6Cl2,关于此配位化合物的下列说法中不正确的是
A.中心离子是Co2+ B.配位数是8
C.配位原子是N原子 D.向此配合物的溶液中滴入硝酸银,会产生白色沉淀
②联氨具高吸湿性,原因是
③联氨水溶液与氨水类性质相似,将联氨溶于一定浓度的稀硫酸中,除形成N2H6SO4外,还可以生成的盐是
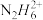 )+c(N2H6OH+)
)+c(N2H6OH+)(4)1mol液态联氨在空气中完全燃烧生成氮气和水蒸气放出621.74KJ的热量,此反应的热化学方程式是
(5)联氨在一定条件下被亚硝酸氧化为叠氮酸(HN3),室温下亚硝酸、叠氮酸的电离平衡常数如表所示:
| 酸名 | 亚硝酸(HNO2) | 叠氮酸(HN3) |
| 电离平衡常数 | 5.1 x 10-4 | 1.8 x 10-5 |
 反应性能类似卤素离子,则难溶物AgN3的Ksp表达式为
反应性能类似卤素离子,则难溶物AgN3的Ksp表达式为(6)某研究小组研究联氨和双氧水反应,查阅相关键能数据
| 化学键 | N-H | O-H | O-O | N-N | N≡N |
| 键能(kJ·mol-1) | 391 | 467 | 138 | 159 | 945 |
您最近一年使用:0次
7 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。 的一种制备方法如下图所示:
的一种制备方法如下图所示:

已知:① 难溶于水;
难溶于水;
②硝酸能与除金和铂以外的绝大多数金属反应;
③还原性: 。
。
回答下列问题:
(1)I元素位于元素周期表第___________ 周期第___________ 族。
(2)加入Fe粉进行转化反应的化学方程式为___________ 。
(3)“转化”步骤中生成的沉淀与硝酸反应,生成___________ 后可循环使用;“富集”步骤之前,海水要除去 的目的是
的目的是___________ 。
(4)通入的 完全反应,若反应物用量比0<
完全反应,若反应物用量比0<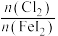 ≤1时,氧化产物为
≤1时,氧化产物为___________ ;当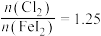 时,反应的离子方程式为
时,反应的离子方程式为___________ 。
 的一种制备方法如下图所示:
的一种制备方法如下图所示:
已知:①
 难溶于水;
难溶于水;②硝酸能与除金和铂以外的绝大多数金属反应;
③还原性:
 。
。回答下列问题:
(1)I元素位于元素周期表第
(2)加入Fe粉进行转化反应的化学方程式为
(3)“转化”步骤中生成的沉淀与硝酸反应,生成
 的目的是
的目的是(4)通入的
 完全反应,若反应物用量比0<
完全反应,若反应物用量比0<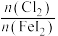 ≤1时,氧化产物为
≤1时,氧化产物为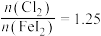 时,反应的离子方程式为
时,反应的离子方程式为
您最近一年使用:0次
解题方法
8 . 一种铁基脱硫剂脱除硫化氢(H2S)的方法包括吸收和再生两个阶段,其工艺流程原理如图所示。下列有关说法错误的是
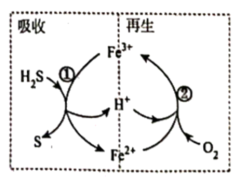

A.反应①中 是氧化产物,反应②中 是氧化产物,反应②中 既不是氧化剂,又不是还原剂 既不是氧化剂,又不是还原剂 |
B.再生反应②的离子方程式为: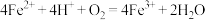 |
C.氧化性: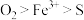 |
D.若要保持脱硫液中 的物质的量不变,则吸收的 的物质的量不变,则吸收的 与通入的 与通入的 在相同状况下的体积比为 在相同状况下的体积比为 |
您最近一年使用:0次
名校
解题方法
9 . 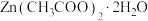 常用作测定钠、蛋白的试剂、色谱分析试剂等,易溶于水。实验室以含锌废液(主要成分为
常用作测定钠、蛋白的试剂、色谱分析试剂等,易溶于水。实验室以含锌废液(主要成分为 ,含少量的
,含少量的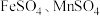 )为原料制备
)为原料制备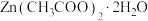 的实验流程如图所示:
的实验流程如图所示:
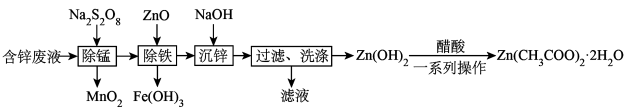
请回答下列问题:
(1)已知 中存在一个过氧键
中存在一个过氧键 ,则过二硫酸钠
,则过二硫酸钠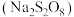 中
中 元素的化合价为
元素的化合价为_____________ ;“除锰”阶段被氧化的元素有_____________ (填元素名称)。
(2)加入 能“除铁”的原因:
能“除铁”的原因: 消耗
消耗 使溶液
使溶液 调整至
调整至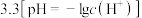 左右时,能使溶液中的
左右时,能使溶液中的 完全转化为
完全转化为 沉淀,则该阶段发生总反应的离子方程式为
沉淀,则该阶段发生总反应的离子方程式为_________ 。
(3)“沉锌”过程中通常加入 。
。
① 在水溶液中的电离方程式为
在水溶液中的电离方程式为_____________________ 。
②向饱和食盐水中加入与 等物质的量的
等物质的量的 ,固体时发生反应的化学方程式为
,固体时发生反应的化学方程式为_____________________________________________________________________________ 。
(4)
_____________ (填“属于”或“不属于”)盐,其与醋酸反应生成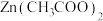 的离子方程式为
的离子方程式为_____________________________________________________ 。
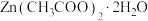 常用作测定钠、蛋白的试剂、色谱分析试剂等,易溶于水。实验室以含锌废液(主要成分为
常用作测定钠、蛋白的试剂、色谱分析试剂等,易溶于水。实验室以含锌废液(主要成分为 ,含少量的
,含少量的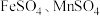 )为原料制备
)为原料制备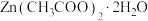 的实验流程如图所示:
的实验流程如图所示:
请回答下列问题:
(1)已知
 中存在一个过氧键
中存在一个过氧键 ,则过二硫酸钠
,则过二硫酸钠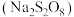 中
中 元素的化合价为
元素的化合价为(2)加入
 能“除铁”的原因:
能“除铁”的原因: 消耗
消耗 使溶液
使溶液 调整至
调整至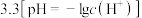 左右时,能使溶液中的
左右时,能使溶液中的 完全转化为
完全转化为 沉淀,则该阶段发生总反应的离子方程式为
沉淀,则该阶段发生总反应的离子方程式为(3)“沉锌”过程中通常加入
 。
。①
 在水溶液中的电离方程式为
在水溶液中的电离方程式为②向饱和食盐水中加入与
 等物质的量的
等物质的量的 ,固体时发生反应的化学方程式为
,固体时发生反应的化学方程式为(4)

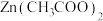 的离子方程式为
的离子方程式为
您最近一年使用:0次
2024-02-17更新
|
287次组卷
|
2卷引用:安徽省合肥市第六中学2023-2024学年高一上学期期末检测化学试题
解题方法
10 . 四氢铝钠( )是强还原剂和供氢剂,高铁酸钠(
)是强还原剂和供氢剂,高铁酸钠( )是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为
)是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为 、
、 和
和 含少量
含少量 )为原料制备四氢铝钠和高铁酸钠的流程如下(已知
)为原料制备四氢铝钠和高铁酸钠的流程如下(已知 是难溶于水的酸性氧化物):
是难溶于水的酸性氧化物):

回答下列问题:
(1) 中氢的化合价为
中氢的化合价为_______ 。
(2)浸渣的主要成分是_______ (填化学式);“转化”中 的具体作用是
的具体作用是_______ 。
(3)由 制备
制备 的离子方程式为
的离子方程式为_______ ;“分离”中铝元素转化成_______ (填离子符号)。
(4)“沉铝”后所得滤液经蒸干、灼烧得到固体是_______ 。
(5)“合成”中乙醚作溶剂,发生反应的化学方程式为_______ 。
(6)“有效氢”指单位质量(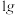 )含氢还原剂的还原能力相当于多少克氢气的还原能力。
)含氢还原剂的还原能力相当于多少克氢气的还原能力。 、
、 的“有效氢”如图所示,则乙代表
的“有效氢”如图所示,则乙代表_______ (填化学式)。

 )是强还原剂和供氢剂,高铁酸钠(
)是强还原剂和供氢剂,高铁酸钠( )是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为
)是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为 、
、 和
和 含少量
含少量 )为原料制备四氢铝钠和高铁酸钠的流程如下(已知
)为原料制备四氢铝钠和高铁酸钠的流程如下(已知 是难溶于水的酸性氧化物):
是难溶于水的酸性氧化物):
回答下列问题:
(1)
 中氢的化合价为
中氢的化合价为(2)浸渣的主要成分是
 的具体作用是
的具体作用是(3)由
 制备
制备 的离子方程式为
的离子方程式为(4)“沉铝”后所得滤液经蒸干、灼烧得到固体是
(5)“合成”中乙醚作溶剂,发生反应的化学方程式为
(6)“有效氢”指单位质量(
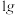 )含氢还原剂的还原能力相当于多少克氢气的还原能力。
)含氢还原剂的还原能力相当于多少克氢气的还原能力。 、
、 的“有效氢”如图所示,则乙代表
的“有效氢”如图所示,则乙代表
您最近一年使用:0次