1 . 化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)在实验室中用浓盐酸与MnO2制取Cl2
①写出反应的离子方程式:_____ 。
②下列收集Cl2的正确装置是_____ 。
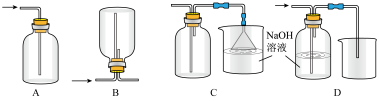
③将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是_____ 。
④若产生标准状况下4.48LCl2,转移的电子数是_____ ,被氧化的HCl的物质的量是:_____ 。
(2)请设计实验证明Fe2+具有还原性:_____ 。
限选试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片。
(3)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为_____ 。(计算结果保留两位小数)
(1)在实验室中用浓盐酸与MnO2制取Cl2
①写出反应的离子方程式:
②下列收集Cl2的正确装置是

③将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是
④若产生标准状况下4.48LCl2,转移的电子数是
(2)请设计实验证明Fe2+具有还原性:
限选试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片。
(3)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为
您最近一年使用:0次
名校
解题方法
2 . Ⅰ.铬的化合物色彩众多,如 (紫色)、
(紫色)、 (灰蓝色)、
(灰蓝色)、 (绿色)等。
(绿色)等。
(1)铬可形成 、
、 等盐类物质,向
等盐类物质,向 溶液中滴加NaOH溶液至过量,可观察到的主要现象是
溶液中滴加NaOH溶液至过量,可观察到的主要现象是___________ 。
Ⅱ.铬元素的+6价化合物毒性较大,不能随意排放。某化工厂以铬渣(含有 及少量
及少量 、
、 )为原料提取硫酸钠,同时制备金属铬的工艺流程如下:
)为原料提取硫酸钠,同时制备金属铬的工艺流程如下:

已知:金属离子生成氢氧化物沉淀的pH如下表所示:
(2)滤渣A的主要成分为___________ 。
(3)根据如图信息,可知操作B包含蒸发结晶和___________ 。

(4)酸化后的 可被
可被 还原,在
还原,在 中,Cr元素的价态为
中,Cr元素的价态为___________ ,该反应中若有0.5mol  被还原为
被还原为 ,则消耗
,则消耗 的物质的量为
的物质的量为___________ mol。
(5)调pH沉铬步骤中,应调节pH的范围是___________ (填字母)。
A.1.5~3.6 B.3.6~6 C.6~8 D.8~9 E.13~14
(6)通过两步反应可以实现 转化为Cr,第一步反应为
转化为Cr,第一步反应为 ;第二步反应利用了铝热反应原理,则该步反应的化学方程式为
;第二步反应利用了铝热反应原理,则该步反应的化学方程式为___________ 。
(7)利用如图装置,可探究铬和铁的活泼性强弱。能证明铁比铬活泼的实验现象是___________

 (紫色)、
(紫色)、 (灰蓝色)、
(灰蓝色)、 (绿色)等。
(绿色)等。(1)铬可形成
 、
、 等盐类物质,向
等盐类物质,向 溶液中滴加NaOH溶液至过量,可观察到的主要现象是
溶液中滴加NaOH溶液至过量,可观察到的主要现象是Ⅱ.铬元素的+6价化合物毒性较大,不能随意排放。某化工厂以铬渣(含有
 及少量
及少量 、
、 )为原料提取硫酸钠,同时制备金属铬的工艺流程如下:
)为原料提取硫酸钠,同时制备金属铬的工艺流程如下:
已知:金属离子生成氢氧化物沉淀的pH如下表所示:
| 氢氧化物 |  |  |
| 开始沉淀的pH | 1.5 | 6 |
| 沉淀完全的pH | 3.6 | 8 |
(3)根据如图信息,可知操作B包含蒸发结晶和

(4)酸化后的
 可被
可被 还原,在
还原,在 中,Cr元素的价态为
中,Cr元素的价态为 被还原为
被还原为 ,则消耗
,则消耗 的物质的量为
的物质的量为(5)调pH沉铬步骤中,应调节pH的范围是
A.1.5~3.6 B.3.6~6 C.6~8 D.8~9 E.13~14
(6)通过两步反应可以实现
 转化为Cr,第一步反应为
转化为Cr,第一步反应为 ;第二步反应利用了铝热反应原理,则该步反应的化学方程式为
;第二步反应利用了铝热反应原理,则该步反应的化学方程式为(7)利用如图装置,可探究铬和铁的活泼性强弱。能证明铁比铬活泼的实验现象是

您最近一年使用:0次
名校
3 . 如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题。
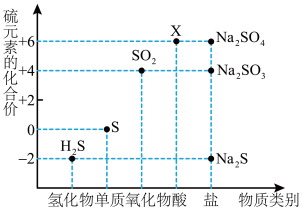
(1)X 的浓溶液与碳在一定条件下可以发生反应,体现了 X 的_______ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有_______ (填化学式)。
(3)将 H2S 与 SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为_______ 。
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目______ 。
Na2S+_______Na2SO3+_______H2SO4=_______Na2SO4+_______S↓+_______H2O
(5)下列关于硫及其化合物的叙述正确的是
(6)设 NA为阿伏加德罗常数的值。下列说法正确的是
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
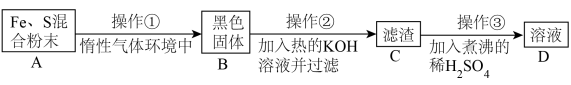
请回答以下问题:
(7)操作②的作用是_______ ,也可改用_______ 。
(8)混合粉末 A 中硫粉过量的原因是_______ 。
(9)下列溶液中通入SO2一定不会产生沉淀的是
(10)区别浓H2SO4和稀H2SO4,既简单又可靠的方法是

(1)X 的浓溶液与碳在一定条件下可以发生反应,体现了 X 的
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有
(3)将 H2S 与 SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目
Na2S+_______Na2SO3+_______H2SO4=_______Na2SO4+_______S↓+_______H2O
(5)下列关于硫及其化合物的叙述正确的是
| A.试管内壁残留的硫可用酒精洗涤 | B.SO2的水溶液长期放置,酸性会增强 |
| C.SO2有毒,不可以做食品添加剂 | D.浓硫酸在空气中敞口放置,质量会减小 |
| A.1mol 铁单质与足量的硫单质充分反应,转移电子的数目为3NA |
| B.常温下,22.4LSO2与足量的O2反应,生成的SO3分子数为NA |
| C.常温下,将5.6g铁片投入足量的浓硫酸中,铁失去的电子数为0.3NA |
| D.1 molNa2O2与足量H2O反应,转移的电子数为NA |
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:

请回答以下问题:
(7)操作②的作用是
(8)混合粉末 A 中硫粉过量的原因是
(9)下列溶液中通入SO2一定不会产生沉淀的是
| A.Ba(OH)2 | B.澄清石灰水 | C.Na2S | D.BaCl2 |
| A.各取少许溶液分别放入铜片 | B.分别与石蕊试液作用 |
| C.用玻璃棒各蘸少许液涂在纸上 | D.观察溶液的颜色 |
您最近一年使用:0次
4 . 现有下列物质:① 溶液;②铁;③稀硫酸;④二氧化碳;⑤
溶液;②铁;③稀硫酸;④二氧化碳;⑤ 固体;⑥熔融
固体;⑥熔融 ;⑦
;⑦ 胶体;⑧蔗糖溶液。
胶体;⑧蔗糖溶液。
(1)将上述物质的序号填写在表格的空白处:
(2)某学习小组为证实 溶液和
溶液和 溶液的反应是离子反应,设计了如下实验。
溶液的反应是离子反应,设计了如下实验。
[实验原理]溶液的导电性由溶液中离子的浓度及离子电荷数决定。通过观察实验现象,判断溶液中离子浓度的变化,从而证明反应是离子反应。
[实验装置]如图所示:
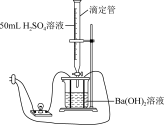
[实验过程与记录]
(3)写出下列情况发生反应的离子方程式:向 溶液中逐滴加入
溶液中逐滴加入 溶液至溶液显中性
溶液至溶液显中性___________ ,继续滴加 溶液
溶液___________ 。
(4) 可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠(Na2FeO4)。可以通过以下两种方法制备:
可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠(Na2FeO4)。可以通过以下两种方法制备:
①请将湿法制备高铁酸钠的离子方程式配平:______
___________ ___________
___________ ___________
___________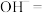 ___________
___________ ___________
___________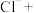 ___________
___________ 。
。
②干法制备高铁酸钠的化学方程式: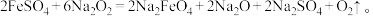 该反应中的氧化产物是
该反应中的氧化产物是___________ (填化学式)。生成 ,转移电子数目为
,转移电子数目为___________ 。
 溶液;②铁;③稀硫酸;④二氧化碳;⑤
溶液;②铁;③稀硫酸;④二氧化碳;⑤ 固体;⑥熔融
固体;⑥熔融 ;⑦
;⑦ 胶体;⑧蔗糖溶液。
胶体;⑧蔗糖溶液。(1)将上述物质的序号填写在表格的空白处:
| 分类标准 | 能导电的纯净物 | 电解质 |
| 属于该类的物质 |
 溶液和
溶液和 溶液的反应是离子反应,设计了如下实验。
溶液的反应是离子反应,设计了如下实验。[实验原理]溶液的导电性由溶液中离子的浓度及离子电荷数决定。通过观察实验现象,判断溶液中离子浓度的变化,从而证明反应是离子反应。
[实验装置]如图所示:

[实验过程与记录]
| 实验步骤 | 实验现象 | 实验结论 |
连接好装置,向烧杯中加入 的 的 溶液,逐滴滴加 溶液,逐滴滴加 的 的 溶液直至过量,边滴边振荡 溶液直至过量,边滴边振荡 | ① | ② 溶液和 溶液和 溶液的反应是离子反应 溶液的反应是离子反应 |
 溶液中逐滴加入
溶液中逐滴加入 溶液至溶液显中性
溶液至溶液显中性 溶液
溶液(4)
 可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠(Na2FeO4)。可以通过以下两种方法制备:
可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠(Na2FeO4)。可以通过以下两种方法制备:①请将湿法制备高铁酸钠的离子方程式配平:
___________
 ___________
___________ ___________
___________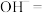 ___________
___________ ___________
___________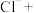 ___________
___________ 。
。②干法制备高铁酸钠的化学方程式:
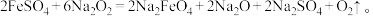 该反应中的氧化产物是
该反应中的氧化产物是 ,转移电子数目为
,转移电子数目为
您最近一年使用:0次
名校
解题方法
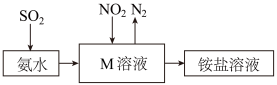
5 . Ⅰ.科研人员研究发现,雾霾的形成与氮及其化合物有关,其关系如下图:

回答下列问题:
(1)写出反应②的化学方程式:_______ 。
(2)氨除与硝酸反应外,还能发生许多反应。如硝酸工业生产中,在催化剂作用下氨能与氧气反应,其化学方程式是_______ ;氨水中含10个电子的微粒有_______ 种。
(3)某化肥厂用 制备
制备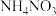 。已知:由
。已知:由 制
制 的产率是90%、
的产率是90%、 制
制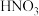 的产率是80%,则制
的产率是80%,则制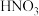 所用去的
所用去的 的质量占总耗
的质量占总耗 质量(不考虑其它损耗)的百分比含量为
质量(不考虑其它损耗)的百分比含量为_______ (计算结果精确到小数点后一位)。
(4)硝酸铜的浓、稀溶液都呈蓝色,而实验中铜与浓硝酸反应的溶液呈绿色,其原因是生成的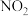 溶解在硝酸铜溶液中所致,同学们设计下列实验方案证明其原因,这些方案中可行的是_______(填字母)。
溶解在硝酸铜溶液中所致,同学们设计下列实验方案证明其原因,这些方案中可行的是_______(填字母)。
(5)如图所示,相同条件下,两个容积相同的试管分别装满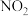 (不考虑反应
(不考虑反应 )和
)和 气体,分别倒置于水槽中,然后通过导管缓慢通入氧气,直到两个试管内充满液体。假设试管内的溶质不向水槽中扩散,则两个试管内溶液物质的量浓度之比为
气体,分别倒置于水槽中,然后通过导管缓慢通入氧气,直到两个试管内充满液体。假设试管内的溶质不向水槽中扩散,则两个试管内溶液物质的量浓度之比为_______

Ⅱ.有机物种类繁多,碳原子间可以以单键、双键或三键相结合,也可以形成碳链或碳环等碳骨架。4个碳原子间均以单键结合的方式有4种。
(6)请根据Ⅰ的写法,在下面补充另外3种结合方式:
Ⅰ. Ⅱ.
Ⅱ._______ Ⅲ._______ Ⅳ._______

回答下列问题:
(1)写出反应②的化学方程式:
(2)氨除与硝酸反应外,还能发生许多反应。如硝酸工业生产中,在催化剂作用下氨能与氧气反应,其化学方程式是
(3)某化肥厂用
 制备
制备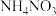 。已知:由
。已知:由 制
制 的产率是90%、
的产率是90%、 制
制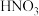 的产率是80%,则制
的产率是80%,则制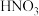 所用去的
所用去的 的质量占总耗
的质量占总耗 质量(不考虑其它损耗)的百分比含量为
质量(不考虑其它损耗)的百分比含量为(4)硝酸铜的浓、稀溶液都呈蓝色,而实验中铜与浓硝酸反应的溶液呈绿色,其原因是生成的
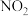 溶解在硝酸铜溶液中所致,同学们设计下列实验方案证明其原因,这些方案中可行的是_______(填字母)。
溶解在硝酸铜溶液中所致,同学们设计下列实验方案证明其原因,这些方案中可行的是_______(填字母)。| A.用水稀释该绿色溶液,观察颜色变化 | B.用冰块降温该绿色溶液,观察颜色变化 |
| C.向该绿色溶液中通入空气,观察颜色变化 | D.向硝酸铜溶液中通入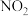 气体,观察颜色变化 气体,观察颜色变化 |
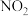 (不考虑反应
(不考虑反应 )和
)和 气体,分别倒置于水槽中,然后通过导管缓慢通入氧气,直到两个试管内充满液体。假设试管内的溶质不向水槽中扩散,则两个试管内溶液物质的量浓度之比为
气体,分别倒置于水槽中,然后通过导管缓慢通入氧气,直到两个试管内充满液体。假设试管内的溶质不向水槽中扩散,则两个试管内溶液物质的量浓度之比为
Ⅱ.有机物种类繁多,碳原子间可以以单键、双键或三键相结合,也可以形成碳链或碳环等碳骨架。4个碳原子间均以单键结合的方式有4种。
(6)请根据Ⅰ的写法,在下面补充另外3种结合方式:
Ⅰ.
 Ⅱ.
Ⅱ.
您最近一年使用:0次
6 . 突如其来的新冠肺炎使人们认识到日常杀菌消毒的重要性。氯气、“84”消毒液、漂白粉都是生活中常用的含氯消毒剂,回答下列问题:
(1)工业生产漂白粉的化学方程式为___________ 。
(2)取一滴“84”消毒液滴在pH试纸上,可观察到先变蓝后褪色的现象,证明“84”消毒液具有___________ 性和___________ 性。
(3)日常生活中“84”消毒液若与洁厕灵(含盐酸)混用,发生反应:NaClO+2HCl=NaCl+Cl2↑+H2O,该反应的氧化剂为_________ ,若反应中转移1.5mol电子,则生成的氯气在标准状况下体积为_________ L。
(4)“84”消毒液需要避光密封保存,否则容易变质而失效,用化学方程式解释其原因:①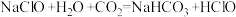 ;②
;②___________ 。
(1)工业生产漂白粉的化学方程式为
(2)取一滴“84”消毒液滴在pH试纸上,可观察到先变蓝后褪色的现象,证明“84”消毒液具有
(3)日常生活中“84”消毒液若与洁厕灵(含盐酸)混用,发生反应:NaClO+2HCl=NaCl+Cl2↑+H2O,该反应的氧化剂为
(4)“84”消毒液需要避光密封保存,否则容易变质而失效,用化学方程式解释其原因:①
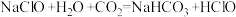 ;②
;②
您最近一年使用:0次
名校
7 . 研究不同价态硫元素之间的转化是合理利用硫元素的基本途径。
I.以下是硫元素形成的部分物质的价类二维图及相互转化的部分信息。

(1)通入氯气可实现Na2S→S的转化,该反应离子方程式______ 。
(2)X的化学式为______ 。空气中的飘尘可以促进过程i,飘尘作用是______ 。
(3)已知Z和Y均属于钠盐,过程iii被氧化的元素为______ 。
II.某实验小组用如图装置(夹持仪器略、气密性好)探究含硫化合物的转化关系。

(4)甲装置中反应的化学方程式是______ ,用单线桥标出电子转移的方向和数目 ______ 。
(5)浓硫酸体现______ 。
(6)若32g金属铜参加反应,转移电子数为______ 个。
(7)从物质类别的角度分析,SO2和CO2具有相似的化学性质,欲验证该性质,可以选用的试剂A及预期的实验现象是:试剂______ 、现象______ 。
(8)当A中为氢硫酸(溶质为H2S)时,观察到②中出现黄色沉淀,说明SO2具有的化学性质是______ 。
(9)当A为碘水时,观察到②中溶液由黄色变为无色,由此推测所得无色溶液中的离子主要是H+和______ 。
(10)由于浓硫酸吸水性,试管甲中未看到预期蓝色,请设计实验证明试管中存在Cu2+______ 。
III.双碱法脱除烟气中SO2的过程如图所示。

(11)过程I的离子方程式是______ ,过程II中氧化剂是______ 。
(12)该过程中可以循环利用的物质是______ 。
I.以下是硫元素形成的部分物质的价类二维图及相互转化的部分信息。

(1)通入氯气可实现Na2S→S的转化,该反应离子方程式
(2)X的化学式为
(3)已知Z和Y均属于钠盐,过程iii被氧化的元素为
II.某实验小组用如图装置(夹持仪器略、气密性好)探究含硫化合物的转化关系。

(4)甲装置中反应的化学方程式是
(5)浓硫酸体现
| A.氧化性 | B.还原性 | C.氧化性和酸性 | D.还原性和酸性 |
| A.0.5NA | B.NA | C.1.5NA | D.2NA |
(8)当A中为氢硫酸(溶质为H2S)时,观察到②中出现黄色沉淀,说明SO2具有的化学性质是
| A.氧化性 | B.还原性 | C.酸性 | D.不稳定性 |
(10)由于浓硫酸吸水性,试管甲中未看到预期蓝色,请设计实验证明试管中存在Cu2+
III.双碱法脱除烟气中SO2的过程如图所示。

(11)过程I的离子方程式是
(12)该过程中可以循环利用的物质是
您最近一年使用:0次
8 . 回答下列问题
(Ⅰ)自然界中硫元素的存在如图1,硫元素的常见化合价与部分物质类别的对应关系如图2,回答下列问题:

(1)图2中的N对应图1中物质的化学式为_______ 。
(2)X与Z反应中氧化剂与还原剂的物质的量之比为_______ 。
(3) 溶液易被氧化,检验
溶液易被氧化,检验 溶液变质的试剂为
溶液变质的试剂为_______ 。
(4)铜和M的浓溶液反应生成Z的化学方程式为_______ ;若要证明该反应产物有 ,需要采取的操作是
,需要采取的操作是_______ 。
(Ⅱ)氮氧化物( )是大气污染物之一,处理
)是大气污染物之一,处理 对于环境保护具有重要的意义。
对于环境保护具有重要的意义。
方案l:
(5)汽车排气管上装有催化转化器,可减少尾气对环境的污染,有害气体CO和NO反应可转化为无害气体排放,写出反应的化学方程式_______ 。
方案2:
在一定条件下 可将
可将 还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
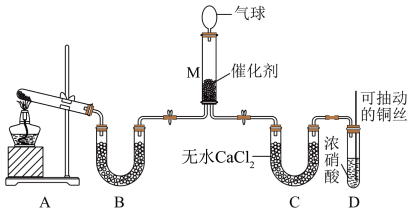
(6)用装置A制备 ,反应的化学方程式为
,反应的化学方程式为_______ ;装置B内的试剂是_______ 。
(7)装置D中发生反应的离子方程式是_______ ;可抽动铜丝的优点是_______ 。
(8)在装置M中 和
和 充分反应,生成两种对环境友好的物质,该反应中
充分反应,生成两种对环境友好的物质,该反应中 和
和 的物质的量之比为
的物质的量之比为_______ 。
方案3:
(9)工业生产中利用氨水吸收少量 和
和 ,原理如图所示。
,原理如图所示。 被吸收过程的离子方程式是
被吸收过程的离子方程式是_______ 。
(Ⅰ)自然界中硫元素的存在如图1,硫元素的常见化合价与部分物质类别的对应关系如图2,回答下列问题:

(1)图2中的N对应图1中物质的化学式为
(2)X与Z反应中氧化剂与还原剂的物质的量之比为
(3)
 溶液易被氧化,检验
溶液易被氧化,检验 溶液变质的试剂为
溶液变质的试剂为(4)铜和M的浓溶液反应生成Z的化学方程式为
 ,需要采取的操作是
,需要采取的操作是(Ⅱ)氮氧化物(
 )是大气污染物之一,处理
)是大气污染物之一,处理 对于环境保护具有重要的意义。
对于环境保护具有重要的意义。方案l:
(5)汽车排气管上装有催化转化器,可减少尾气对环境的污染,有害气体CO和NO反应可转化为无害气体排放,写出反应的化学方程式
方案2:
在一定条件下
 可将
可将 还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
(6)用装置A制备
 ,反应的化学方程式为
,反应的化学方程式为(7)装置D中发生反应的离子方程式是
(8)在装置M中
 和
和 充分反应,生成两种对环境友好的物质,该反应中
充分反应,生成两种对环境友好的物质,该反应中 和
和 的物质的量之比为
的物质的量之比为方案3:
(9)工业生产中利用氨水吸收少量
 和
和 ,原理如图所示。
,原理如图所示。 被吸收过程的离子方程式是
被吸收过程的离子方程式是
您最近一年使用:0次
名校
解题方法
9 . 人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,某化学兴趣小组利用图1装置制备氨气,图2装置探究其相关性质。
(1)图1装置中生成NH3的化学方程式为_______ 。检验圆底烧瓶中已收集满氨气的方法是_______ 。通常用 _______ (填名称)干燥氨气。
Ⅱ.探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
(2)无水硫酸铜的作用是_______ ;有同学认为需要在无水硫酸铜的后面再接一个装有CaCl2固体的球形干燥管,这样做的目的是_______ 。
(3)该实验缺少尾气吸收装置。如图中能用来吸收尾气的装置是_______ (填字母)。_______ ,证明氨气具有_______ (填“氧化性”或“还原性”)。
(5)若向a中通入标准状况下4.48 L的氨气,最终得到铜的质量为_______ g。

(1)图1装置中生成NH3的化学方程式为
Ⅱ.探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
(2)无水硫酸铜的作用是
(3)该实验缺少尾气吸收装置。如图中能用来吸收尾气的装置是

(5)若向a中通入标准状况下4.48 L的氨气,最终得到铜的质量为
您最近一年使用:0次
2023-04-26更新
|
224次组卷
|
3卷引用:新疆乌鲁木齐市第四中学2022-2023学年高一下学期期中阶段诊断测试化学试题
10 . 从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。如图是硫元素价类二维图。请回答下列问题:

(1)已知物质 是一种可溶性正盐,能被酸性
是一种可溶性正盐,能被酸性 溶液氧化为
溶液氧化为 被还原为
被还原为 ,请写出此反应的离子方程式
,请写出此反应的离子方程式___________ 。
(2)实验室提供以下试剂: 的浓溶液、
的浓溶液、 的稀溶液、酸性
的稀溶液、酸性 溶液、
溶液、 溶液、
溶液、 、品红溶液。若要实现
、品红溶液。若要实现 的转化,可选择的试剂是
的转化,可选择的试剂是___________ 、___________ (填化学式);设计实验,证明能实现该转化的操作和现象为___________ 。
(3)某兴趣小组用如图所示装置模拟空气中二氧化硫含量的测定。当注入标准状况下 空气时,酸性
空气时,酸性 溶液恰好褪色,停止实验。该空气中二氧化硫的体积分数为
溶液恰好褪色,停止实验。该空气中二氧化硫的体积分数为___________ (用含 代数式表示,体积分数即物质的量分数)。
代数式表示,体积分数即物质的量分数)。

(4)某化工厂用如图所示工艺流程除去燃煤产生的 。
。
①过程Ⅰ发生的反应为 ,其氧化剂与还原剂的质量之比为
,其氧化剂与还原剂的质量之比为___________ 。
②过程Ⅱ发生反应的化学方程式为___________ 。


(1)已知物质
 是一种可溶性正盐,能被酸性
是一种可溶性正盐,能被酸性 溶液氧化为
溶液氧化为 被还原为
被还原为 ,请写出此反应的离子方程式
,请写出此反应的离子方程式(2)实验室提供以下试剂:
 的浓溶液、
的浓溶液、 的稀溶液、酸性
的稀溶液、酸性 溶液、
溶液、 溶液、
溶液、 、品红溶液。若要实现
、品红溶液。若要实现 的转化,可选择的试剂是
的转化,可选择的试剂是(3)某兴趣小组用如图所示装置模拟空气中二氧化硫含量的测定。当注入标准状况下
 空气时,酸性
空气时,酸性 溶液恰好褪色,停止实验。该空气中二氧化硫的体积分数为
溶液恰好褪色,停止实验。该空气中二氧化硫的体积分数为 代数式表示,体积分数即物质的量分数)。
代数式表示,体积分数即物质的量分数)。
(4)某化工厂用如图所示工艺流程除去燃煤产生的
 。
。①过程Ⅰ发生的反应为
 ,其氧化剂与还原剂的质量之比为
,其氧化剂与还原剂的质量之比为②过程Ⅱ发生反应的化学方程式为

您最近一年使用:0次



