解题方法
1 . 高铁酸钾( )具有强氧化性,是一种环保、高效、多功能的水处理剂,实验室用含少量
)具有强氧化性,是一种环保、高效、多功能的水处理剂,实验室用含少量 杂质的铁屑原料,经过如下流程制备少量
杂质的铁屑原料,经过如下流程制备少量 。
。

(1) 中铁元素的化合价是
中铁元素的化合价是___________ 。
(2)往原料中添加过量 除去的物质为
除去的物质为___________ 。
(3)“预氧化”环节的离子方程式是___________ 。
(4)“制备 ”的反应中,还原剂和氧化剂的物质的量之比为
”的反应中,还原剂和氧化剂的物质的量之比为___________ 。
(5)“熔融法”是最早发现+6价高铁酸盐的方法,该法制备高铁酸盐的原理如下: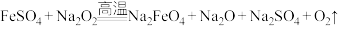 ,若反应中被氧化的
,若反应中被氧化的 与被还原的
与被还原的 之物质的量比为1∶4,请写出该反应配平后的方程式:
之物质的量比为1∶4,请写出该反应配平后的方程式:___________ 。此时,若反应产生11.2L(标准状况) ,则转移的电子为
,则转移的电子为___________ mol。
 )具有强氧化性,是一种环保、高效、多功能的水处理剂,实验室用含少量
)具有强氧化性,是一种环保、高效、多功能的水处理剂,实验室用含少量 杂质的铁屑原料,经过如下流程制备少量
杂质的铁屑原料,经过如下流程制备少量 。
。
(1)
 中铁元素的化合价是
中铁元素的化合价是(2)往原料中添加过量
 除去的物质为
除去的物质为(3)“预氧化”环节的离子方程式是
(4)“制备
 ”的反应中,还原剂和氧化剂的物质的量之比为
”的反应中,还原剂和氧化剂的物质的量之比为(5)“熔融法”是最早发现+6价高铁酸盐的方法,该法制备高铁酸盐的原理如下:
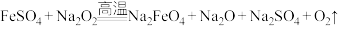 ,若反应中被氧化的
,若反应中被氧化的 与被还原的
与被还原的 之物质的量比为1∶4,请写出该反应配平后的方程式:
之物质的量比为1∶4,请写出该反应配平后的方程式: ,则转移的电子为
,则转移的电子为
您最近一年使用:0次
名校
解题方法
2 . “氨的催化氧化是工业生产硝酸的重要步骤,某化学课外活动小组设计模拟该实验过程,用水吸收制取硝酸,并用硝酸制取 晶体:
晶体:
(1)若用图装置A制取 和
和 的混合气体,分液漏斗内为浓氨水,则圆底烧瓶中加入的固体药品为
的混合气体,分液漏斗内为浓氨水,则圆底烧瓶中加入的固体药品为________ 。

(2)复气在装置B中发生催化氧化,若条件控制不当,B中可能发生副反应, 和
和 在加热和催化剂作用下生成
在加热和催化剂作用下生成 ,该副反应的化学方程式为
,该副反应的化学方程式为______ 。

(3)若产生的氮氧化物尾气(含 、
、 )用氨气为还原剂进行催化还原,主要反应如下:
)用氨气为还原剂进行催化还原,主要反应如下:
①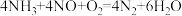 ②
②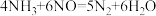
在反应②中当生成 时,转移的电子数为
时,转移的电子数为_____  。随着反应温升高,脱硝效率降低的原因可能是
。随着反应温升高,脱硝效率降低的原因可能是_______ 。
(4)设计以某工业废水(含 、
、 、
、 )为原料,制取
)为原料,制取 晶体的实验方案:
晶体的实验方案:
①向工业废水中加入_______ 充分反应,过滤,洗涤滤渣2~3次;
②_______ ;
③_______ ,过滤,洗涤,干燥。
[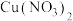 的溶解度曲线如图2所示;实验中须使用的试剂:稀
的溶解度曲线如图2所示;实验中须使用的试剂:稀 、
、 溶液]。
溶液]。

 晶体:
晶体:(1)若用图装置A制取
 和
和 的混合气体,分液漏斗内为浓氨水,则圆底烧瓶中加入的固体药品为
的混合气体,分液漏斗内为浓氨水,则圆底烧瓶中加入的固体药品为
(2)复气在装置B中发生催化氧化,若条件控制不当,B中可能发生副反应,
 和
和 在加热和催化剂作用下生成
在加热和催化剂作用下生成 ,该副反应的化学方程式为
,该副反应的化学方程式为
(3)若产生的氮氧化物尾气(含
 、
、 )用氨气为还原剂进行催化还原,主要反应如下:
)用氨气为还原剂进行催化还原,主要反应如下:①
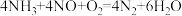 ②
②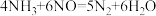
在反应②中当生成
 时,转移的电子数为
时,转移的电子数为 。随着反应温升高,脱硝效率降低的原因可能是
。随着反应温升高,脱硝效率降低的原因可能是(4)设计以某工业废水(含
 、
、 、
、 )为原料,制取
)为原料,制取 晶体的实验方案:
晶体的实验方案:①向工业废水中加入
②
③
[
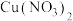 的溶解度曲线如图2所示;实验中须使用的试剂:稀
的溶解度曲线如图2所示;实验中须使用的试剂:稀 、
、 溶液]。
溶液]。
您最近一年使用:0次
名校
解题方法
3 . 利用金属矿渣(含有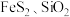 及
及 )制备
)制备 的实验流程如下。已知煅烧过程中
的实验流程如下。已知煅烧过程中 和
和 转化为
转化为 和
和 。
。
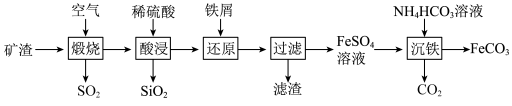
(1)“还原”步骤除发生铁与 的反应外,还发生反应的离子方程式有
的反应外,还发生反应的离子方程式有___________ 。
(2)检验 是否完全被还原的实验操作是
是否完全被还原的实验操作是___________ 。
(3) 溶液浓度的测定:取制得的
溶液浓度的测定:取制得的 溶液
溶液 ,置于锥形瓶中,加入一定量的酸溶液,用
,置于锥形瓶中,加入一定量的酸溶液,用 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 。计算
。计算 溶液的物质的量浓度(写出计算过程)。
溶液的物质的量浓度(写出计算过程)。___________ 。
(4)制备 :写出“沉铁”步骤发生反应的离子方程式:
:写出“沉铁”步骤发生反应的离子方程式:___________ 。
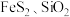 及
及 )制备
)制备 的实验流程如下。已知煅烧过程中
的实验流程如下。已知煅烧过程中 和
和 转化为
转化为 和
和 。
。
(1)“还原”步骤除发生铁与
 的反应外,还发生反应的离子方程式有
的反应外,还发生反应的离子方程式有(2)检验
 是否完全被还原的实验操作是
是否完全被还原的实验操作是(3)
 溶液浓度的测定:取制得的
溶液浓度的测定:取制得的 溶液
溶液 ,置于锥形瓶中,加入一定量的酸溶液,用
,置于锥形瓶中,加入一定量的酸溶液,用 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 。计算
。计算 溶液的物质的量浓度(写出计算过程)。
溶液的物质的量浓度(写出计算过程)。(4)制备
 :写出“沉铁”步骤发生反应的离子方程式:
:写出“沉铁”步骤发生反应的离子方程式:
您最近一年使用:0次
名校
4 . 纳米铁粉常用于废水处理等,以草酸( )与
)与 为原料可制取纳米铁粉。
为原料可制取纳米铁粉。
I.制备 溶液
溶液
利用硫酸烧渣(主要含 、
、 ,还含有
,还含有 和
和 等)来制取
等)来制取 溶液。
溶液。 发生反应的离子方程式是
发生反应的离子方程式是______ 。
(2)“还原”时,铁粉将 、
、 还原为
还原为 和
和 。检验
。检验 是否全部被还原的实验方法是
是否全部被还原的实验方法是_______ 。
(3)将得到的 溶液进行下列操作,测定其物质的量浓度:
溶液进行下列操作,测定其物质的量浓度:
步骤一:取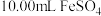 溶液,将其稀释成
溶液,将其稀释成 溶液。
溶液。
步骤二:取 稀释后的溶液,向其中加入
稀释后的溶液,向其中加入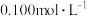 酸性
酸性 溶液。恰好反应时,记下消耗
溶液。恰好反应时,记下消耗 溶液的体积。
溶液的体积。
步骤三:重复上述实验3次,平均消耗 溶液
溶液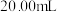 。
。
①“步骤一”中稀释时所用的水需先进行加热煮沸,其目的是______ 。
②试通过计算,求原 溶液的物质的量浓度是多少?(写出计算过程)
溶液的物质的量浓度是多少?(写出计算过程) ____ 。
Ⅱ.制取草酸
(4)用含有适量催化剂的混酸(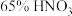 与
与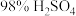 的质量比为
的质量比为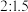 )溶液氧化淀粉水解液制备草酸,其装置如图所示。[已知:硝酸氧化淀粉水解液过程中主要反应:
)溶液氧化淀粉水解液制备草酸,其装置如图所示。[已知:硝酸氧化淀粉水解液过程中主要反应: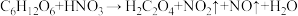 (未配平)]
(未配平)]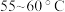 ,适宜的加热方式为
,适宜的加热方式为______ 。
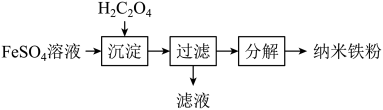
Ⅲ:制备纳米铁粉,其流程如下: 在
在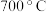 时分解:
时分解: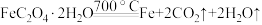 。由于生成
。由于生成 ,该反应成为制备纳米铁粉的重要方法。
,该反应成为制备纳米铁粉的重要方法。 的作用是
的作用是______ 。
(6)用纳米铁粉处理废水中的
①酸性条件下,纳米铁粉与废水中 反应生成
反应生成 与
与 ,其反应的离子方程式是
,其反应的离子方程式是_______ 。
②研究发现,废水中溶解氧会对 的去除产生一定影响。在初始
的去除产生一定影响。在初始 、
、 初始浓度、纳米铁粉与硝酸盐质量比均一定的条件下,有氧与无氧条件下
初始浓度、纳米铁粉与硝酸盐质量比均一定的条件下,有氧与无氧条件下 的去除率随反应时间的变化如图所示。
的去除率随反应时间的变化如图所示。 时,有氧条件下
时,有氧条件下 去除率低于无氧条件下,其可能的原因是
去除率低于无氧条件下,其可能的原因是_______ 。
 )与
)与 为原料可制取纳米铁粉。
为原料可制取纳米铁粉。I.制备
 溶液
溶液利用硫酸烧渣(主要含
 、
、 ,还含有
,还含有 和
和 等)来制取
等)来制取 溶液。
溶液。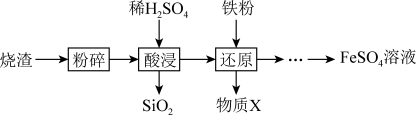
 发生反应的离子方程式是
发生反应的离子方程式是(2)“还原”时,铁粉将
 、
、 还原为
还原为 和
和 。检验
。检验 是否全部被还原的实验方法是
是否全部被还原的实验方法是(3)将得到的
 溶液进行下列操作,测定其物质的量浓度:
溶液进行下列操作,测定其物质的量浓度:步骤一:取
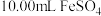 溶液,将其稀释成
溶液,将其稀释成 溶液。
溶液。步骤二:取
 稀释后的溶液,向其中加入
稀释后的溶液,向其中加入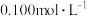 酸性
酸性 溶液。恰好反应时,记下消耗
溶液。恰好反应时,记下消耗 溶液的体积。
溶液的体积。步骤三:重复上述实验3次,平均消耗
 溶液
溶液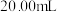 。
。①“步骤一”中稀释时所用的水需先进行加热煮沸,其目的是
②试通过计算,求原
 溶液的物质的量浓度是多少?(写出计算过程)
溶液的物质的量浓度是多少?(写出计算过程) Ⅱ.制取草酸
(4)用含有适量催化剂的混酸(
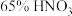 与
与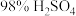 的质量比为
的质量比为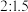 )溶液氧化淀粉水解液制备草酸,其装置如图所示。[已知:硝酸氧化淀粉水解液过程中主要反应:
)溶液氧化淀粉水解液制备草酸,其装置如图所示。[已知:硝酸氧化淀粉水解液过程中主要反应: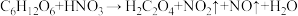 (未配平)]
(未配平)]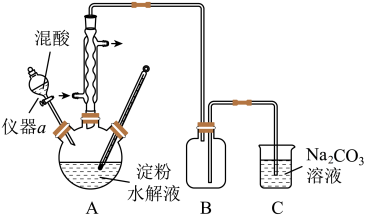
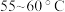 ,适宜的加热方式为
,适宜的加热方式为Ⅲ:制备纳米铁粉,其流程如下:
 在
在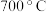 时分解:
时分解: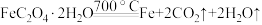 。由于生成
。由于生成 ,该反应成为制备纳米铁粉的重要方法。
,该反应成为制备纳米铁粉的重要方法。 的作用是
的作用是(6)用纳米铁粉处理废水中的

①酸性条件下,纳米铁粉与废水中
 反应生成
反应生成 与
与 ,其反应的离子方程式是
,其反应的离子方程式是②研究发现,废水中溶解氧会对
 的去除产生一定影响。在初始
的去除产生一定影响。在初始 、
、 初始浓度、纳米铁粉与硝酸盐质量比均一定的条件下,有氧与无氧条件下
初始浓度、纳米铁粉与硝酸盐质量比均一定的条件下,有氧与无氧条件下 的去除率随反应时间的变化如图所示。
的去除率随反应时间的变化如图所示。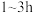 时,有氧条件下
时,有氧条件下 去除率低于无氧条件下,其可能的原因是
去除率低于无氧条件下,其可能的原因是
您最近一年使用:0次
名校
解题方法
5 . 图是氮循环的一部分:
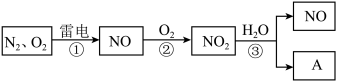
(1)通常状况下,NO2的颜色是_______ 。
(2)反应②的化学方程式是_______ 。
(3)NO2易溶于水,并与水发生化学反应。该反应中,还原剂是_______ 。
(4)化合物A的化学式是_______ 。
(5)治理汽车尾气的一种方法是用催化剂使NO与CO发生反应: 。当生成1molN2时,被氧化的CO为
。当生成1molN2时,被氧化的CO为_______ mol。

(1)通常状况下,NO2的颜色是
(2)反应②的化学方程式是
(3)NO2易溶于水,并与水发生化学反应。该反应中,还原剂是
(4)化合物A的化学式是
(5)治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:
 。当生成1molN2时,被氧化的CO为
。当生成1molN2时,被氧化的CO为
您最近一年使用:0次
名校
解题方法
6 . 硫铁矿(含 )是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系:
)是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系:
(1)硫铁矿中 元素的化合价为
元素的化合价为___________ 。
(2)为了使反应I燃烧得更充分,可以采用的措施是___________ 。
(3)将A通入新制碘水中,发现溶液褪色,发生的离子反应方程式为______________________ 。
(4)下列关于C的说法正确的是___________。
(5)工业上为了防止污染,可以利用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,该过程如图所示: ,转移的电子的物质的量为
,转移的电子的物质的量为___________ 。
②脱硫过程中产生的 在酸性溶液中会形成淡黄色沉淀并产生刺激性气味的气体,写出其离子方程式
在酸性溶液中会形成淡黄色沉淀并产生刺激性气味的气体,写出其离子方程式___________ 。
③从氧化还原角度分析,若要制备 应选择
应选择___________ (填字母)。
A. B.
B. C.
C. D.
D.
 )是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系:
)是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系: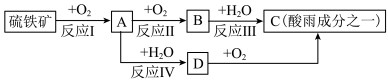
(1)硫铁矿中
 元素的化合价为
元素的化合价为(2)为了使反应I燃烧得更充分,可以采用的措施是
(3)将A通入新制碘水中,发现溶液褪色,发生的离子反应方程式为
(4)下列关于C的说法正确的是___________。
A.酸雨指的是 的雨水 的雨水 |
| B.浓硫酸可以和铁发生反应,不能用钢瓶盛装浓硫酸 |
| C.浓硫酸有强氧化性,稀硫酸没有氧化性 |
| D.稀硫酸长时间放置在空气中浓度会变高,浓硫酸长时间放置在空气中浓度会变低 |
(5)工业上为了防止污染,可以利用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,该过程如图所示:
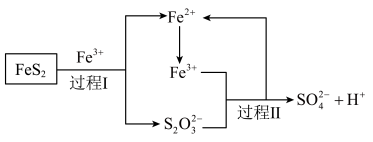
 ,转移的电子的物质的量为
,转移的电子的物质的量为②脱硫过程中产生的
 在酸性溶液中会形成淡黄色沉淀并产生刺激性气味的气体,写出其离子方程式
在酸性溶液中会形成淡黄色沉淀并产生刺激性气味的气体,写出其离子方程式③从氧化还原角度分析,若要制备
 应选择
应选择A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
2024-04-05更新
|
587次组卷
|
4卷引用:重庆市第七中学校2023-2024学年高一下学期第一次月考化学试卷
名校
解题方法
7 . 试回答下列问题:
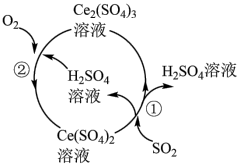
(1)化石燃料燃烧会产生大气污染物SO2、NOx等,科学家实验探究用硫酸铈循环法吸收SO2,其转化原理如图所示,反应①的离子方程式为___________ ,反应②中氧化剂与氧化产物的物质的量之比为___________ ,理论上每吸收标准状况下224mL SO2,一定消耗___________ g氧气。
(2)实验室探究SO2与Fe(NO3)3溶液反应的原理,装置如图,实验中Y装置产生白色沉淀。
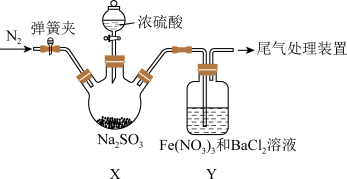
滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间 ,其目的是
,其目的是___________ ,Y中产生的白色沉淀是___________ ,若将 换成氨水,Y中产生白色沉淀
换成氨水,Y中产生白色沉淀___________ ,若将Y改为 溶液,则其化学反应方程式是
溶液,则其化学反应方程式是___________ 。
(1)化石燃料燃烧会产生大气污染物SO2、NOx等,科学家实验探究用硫酸铈循环法吸收SO2,其转化原理如图所示,反应①的离子方程式为

(2)实验室探究SO2与Fe(NO3)3溶液反应的原理,装置如图,实验中Y装置产生白色沉淀。

滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间
 ,其目的是
,其目的是 换成氨水,Y中产生白色沉淀
换成氨水,Y中产生白色沉淀 溶液,则其化学反应方程式是
溶液,则其化学反应方程式是
您最近一年使用:0次
名校
解题方法
8 . 如图是无机物A~F在一定条件下的转化关系(部分产物及反应条件未标出)。已知:A为气体,A~F都含有相同的元素。
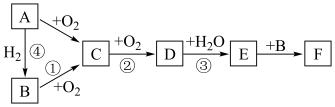
试回答下列问题。
(1)写出反应①的化学方程式:___________ 。
(2)在①②③④中属于氮的固定的是___________ (填序号)。
(3)下列说法正确的是___________。
(4)D易溶于水。常温常压下(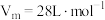 ),将体积为VmL的试管充满D后倒扣在水中。
),将体积为VmL的试管充满D后倒扣在水中。
①最终试管中所得E的物质的量浓度为(不考虑E的扩散)___________  。
。
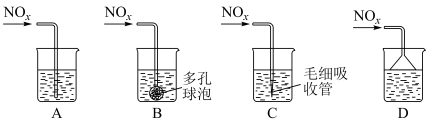
②若C、D按物质的量之比1:1被 溶液吸收,只生成一种盐,则该反应的离子方程式是
溶液吸收,只生成一种盐,则该反应的离子方程式是___________ 。为提高吸收速率与效率,最好选用___________ 装置(填序号)。
(5)工业上可用①②③由B制取E,为了提高原料的利用率并尽量减轻对环境的污染,C必须循环使用。若消耗1mol的B制取E,在该过程中至少消耗的 的物质的量为
的物质的量为___________ 。
(6)C气体与ag O2混合后通入水中,恰好被水完全吸收生成稀硝酸。若用该稀硝酸去溶解铜,假设该溶解过程只产生C气体,理论上能消耗铜的质量为___________ g。

试回答下列问题。
(1)写出反应①的化学方程式:
(2)在①②③④中属于氮的固定的是
(3)下列说法正确的是___________。
| A.通过水可以除去C中含有的少量D |
| B.物质C、D均可以用向上排空气法收集 |
| C.E的浓溶液的存放方法是保存在无色细口玻璃瓶 |
| D.物质 F 中含离子键 |
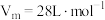 ),将体积为VmL的试管充满D后倒扣在水中。
),将体积为VmL的试管充满D后倒扣在水中。①最终试管中所得E的物质的量浓度为(不考虑E的扩散)
 。
。②若C、D按物质的量之比1:1被
 溶液吸收,只生成一种盐,则该反应的离子方程式是
溶液吸收,只生成一种盐,则该反应的离子方程式是
(5)工业上可用①②③由B制取E,为了提高原料的利用率并尽量减轻对环境的污染,C必须循环使用。若消耗1mol的B制取E,在该过程中至少消耗的
 的物质的量为
的物质的量为(6)C气体与ag O2混合后通入水中,恰好被水完全吸收生成稀硝酸。若用该稀硝酸去溶解铜,假设该溶解过程只产生C气体,理论上能消耗铜的质量为
您最近一年使用:0次
9 . 二氧化氯(ClO2)与Cl2的氧化性相似,广泛应用于自来水消毒和果蔬保鲜。某兴趣小组通过图1装置(夹持装置略)研究ClO2的制备、吸收、释放和应用。
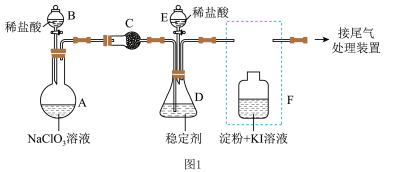
已知:①Cl2不溶于稳定剂;
②ClO2与Cl2均能使淀粉-KI溶液变蓝;
③在酸性条件下,NaClO2可发生反应生成NaCl并释放出ClO2。
(1)仪器B的名称是_______ ,安装F中导管时,应选用图2中的_______ 。
(2)打开B的活塞,A中发生反应生成ClO2和Cl2。写出A中反应的离子方程式,并用双线桥法表示电子转移的方向和数目:_______ 。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变。装置C的作用是_______ 。
(4)关闭B的活塞,打开E的活塞,D中发生反应。此时D中反应的氧化剂和还原剂的物质的量之比为_____ ,装置F的作用是______ 。
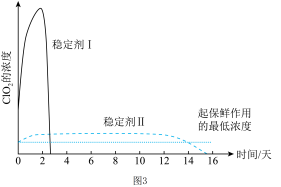
(5)已知吸收ClO2气体的稳定剂I和稳定剂II,加酸后释放ClO2的浓度随时间的变化如图3所示。若将其用于水果保鲜,效果较好的稳定剂是_______ 。

已知:①Cl2不溶于稳定剂;
②ClO2与Cl2均能使淀粉-KI溶液变蓝;
③在酸性条件下,NaClO2可发生反应生成NaCl并释放出ClO2。
(1)仪器B的名称是

(2)打开B的活塞,A中发生反应生成ClO2和Cl2。写出A中反应的离子方程式,并用双线桥法表示电子转移的方向和数目:
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变。装置C的作用是
(4)关闭B的活塞,打开E的活塞,D中发生反应。此时D中反应的氧化剂和还原剂的物质的量之比为
(5)已知吸收ClO2气体的稳定剂I和稳定剂II,加酸后释放ClO2的浓度随时间的变化如图3所示。若将其用于水果保鲜,效果较好的稳定剂是

您最近一年使用:0次
10 . 氮肥为粮食增产做出了重大贡献。目前,CO(NH2)2(尿素)是使用最多的氮肥之一。尿素进入土壤后,在脲酶作用下生成 和
和 。尿素的某些性质如下表所示。
。尿素的某些性质如下表所示。
1.尿素易溶于水,可能的原因是:尿素_______。
2.根据上表信息,使用尿素的注意事项是:_______ 。(写2点)
3. 与CH4互为等电子体,等电子体的化学键类型和空间结构相同。运用价层电子对互斥理论预测
与CH4互为等电子体,等电子体的化学键类型和空间结构相同。运用价层电子对互斥理论预测 的空间结构及其中心原子杂化轨道类型_______。
的空间结构及其中心原子杂化轨道类型_______。
4.简述检验溶液中存在 的实验操作。
的实验操作。_______ 。
过量使用尿素会造成水体中氨氮( 和NH3·H2O中的氮元素)浓度过量。下图所示是氨氮物质的量分数随pH变化的关系。
和NH3·H2O中的氮元素)浓度过量。下图所示是氨氮物质的量分数随pH变化的关系。
可利用生成沉淀去除水体中的氨氮。向酸性废水中加入适量Fe2(SO4)3溶液,氨氮转化为NH4Fe3(SO4)2(OH)6沉淀。

5.写出上述反应的离子方程式。_______ 。
6.氨氮去除率随溶液pH的变化如下图所示,分析氨氮去除率随pH增大,先升高后降低的原因。_______ 。

氧化可更彻底去除水体中的氨氮。向水体中加入NaClO溶液,氨氮被氧化为N2而除去。n(ClO–)/n(氨氮)对氨氮去除率和总氮去除率的影响如下图所示。

7.n(ClO–)/n(氨氮)较大时,氨氮去除率较高,但总氮去除率有所下降。n(ClO–)/n(氨氮)较大时,留在水体中的含氮微粒可能是_______。(不定项)
8.某废水中氨氮浓度为2800mg·L-1,先用Fe2(SO4)3溶液将氨氮转化为沉淀,氨氮去除率为81%。过滤后再向滤液中加入NaClO溶液,氨氮浓度下降为20mg·L-1,则处理每升废水需要NaClO物质的量_______ (写出计算过程)。
注:①氮元素只被氧化为N2;②废水1L,去除氨氮后溶液体积为2L。
 和
和 。尿素的某些性质如下表所示。
。尿素的某些性质如下表所示。| 熔点 | 沸点 | 溶解度(20℃) | 光稳定性 |
| 132.7℃ | 196.6℃ | 105g/100g水 | 见光易分解 |
1.尿素易溶于水,可能的原因是:尿素_______。
| A.是极性分子 | B.属于无机物 |
| C.能与水分子形成氢键 | D.分子间能形成氢键 |
3.
 与CH4互为等电子体,等电子体的化学键类型和空间结构相同。运用价层电子对互斥理论预测
与CH4互为等电子体,等电子体的化学键类型和空间结构相同。运用价层电子对互斥理论预测 的空间结构及其中心原子杂化轨道类型_______。
的空间结构及其中心原子杂化轨道类型_______。| A.平面三角形sp2杂化 | B.正四面体形sp3杂化 |
| C.三角锥形sp3杂化 | D.直线形sp杂化 |
 的实验操作。
的实验操作。过量使用尿素会造成水体中氨氮(
 和NH3·H2O中的氮元素)浓度过量。下图所示是氨氮物质的量分数随pH变化的关系。
和NH3·H2O中的氮元素)浓度过量。下图所示是氨氮物质的量分数随pH变化的关系。可利用生成沉淀去除水体中的氨氮。向酸性废水中加入适量Fe2(SO4)3溶液,氨氮转化为NH4Fe3(SO4)2(OH)6沉淀。

5.写出上述反应的离子方程式。
6.氨氮去除率随溶液pH的变化如下图所示,分析氨氮去除率随pH增大,先升高后降低的原因。

氧化可更彻底去除水体中的氨氮。向水体中加入NaClO溶液,氨氮被氧化为N2而除去。n(ClO–)/n(氨氮)对氨氮去除率和总氮去除率的影响如下图所示。

7.n(ClO–)/n(氨氮)较大时,氨氮去除率较高,但总氮去除率有所下降。n(ClO–)/n(氨氮)较大时,留在水体中的含氮微粒可能是_______。(不定项)
A. | B. | C.NO2 | D. |
注:①氮元素只被氧化为N2;②废水1L,去除氨氮后溶液体积为2L。
您最近一年使用:0次



