名校
1 . 化工产品中,含氯物质众多,其用途广泛。回答下列问题:
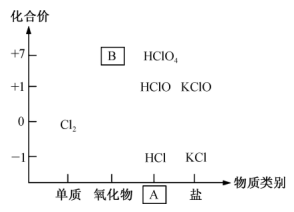
(1)如图为氯及其化合物的“价一类”二维图。缺失的类别A为______ 、物质B为______ (填化学式)。
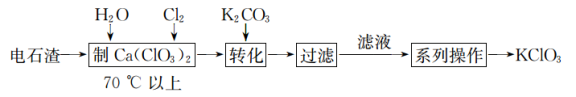
(2)电石渣[主要成分为 ]是氯碱工业中的废料,某同学在实验室以电石渣为原料制取
]是氯碱工业中的废料,某同学在实验室以电石渣为原料制取 的工艺流程如图所示:
的工艺流程如图所示:
已知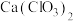 易溶于水。
易溶于水。
①工业生产电石的反应为 ,该反应中还原剂为
,该反应中还原剂为______ 。
②流程中“制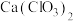 ”的化学方程式为
”的化学方程式为______ ;“转化”发生反应的离子方程式为______ 。
③上述流程中所用 是用
是用 与浓盐酸反应制得。该反应的离子方程式是
与浓盐酸反应制得。该反应的离子方程式是______ ,其中盐酸体现的性质为______ 性和______ 性。下列发生装置可用于上述方法制备 的是
的是______ (填字母)。

(1)如图为氯及其化合物的“价一类”二维图。缺失的类别A为

(2)电石渣[主要成分为
 ]是氯碱工业中的废料,某同学在实验室以电石渣为原料制取
]是氯碱工业中的废料,某同学在实验室以电石渣为原料制取 的工艺流程如图所示:
的工艺流程如图所示:
已知
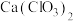 易溶于水。
易溶于水。①工业生产电石的反应为
 ,该反应中还原剂为
,该反应中还原剂为②流程中“制
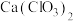 ”的化学方程式为
”的化学方程式为③上述流程中所用
 是用
是用 与浓盐酸反应制得。该反应的离子方程式是
与浓盐酸反应制得。该反应的离子方程式是 的是
的是
您最近一年使用:0次
2021-01-05更新
|
405次组卷
|
2卷引用:黑龙江省大庆市肇州县第二中学2021-2022学年高一下学期第一次月考化学试题
名校
解题方法
2 . 磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)写出磷酸主要的电离方程式:__________________________________________ 。
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。
__ 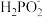 +
+___ Ag++__ ________ =__  +
+__ Ag+__ ________
(3)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44 ℃,沸点280 ℃),主要生产流程如下:

①除砷过程在75 ℃时进行,其合理的原因是________ (填字母)。
a.使白磷熔化,提高反应活性
b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解
d.适当提高温度,增大反应速率
②生产过程在高纯氮气保护下进行,其目的是____________________________________ 。
③硝酸氧化除砷时被还原为NO,写出砷转化为砷酸的化学方程式:_______________ 。
氧化相同质量的砷,当转化为亚砷酸的量越多时,消耗硝酸的量越________ (填“多”或“少”)。
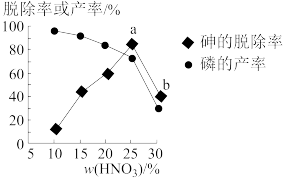
④某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图所示,砷的脱除率从a点到b点降低的原因是___________________________ 。
(1)写出磷酸主要的电离方程式:
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。
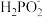 +
+ +
+(3)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44 ℃,沸点280 ℃),主要生产流程如下:

①除砷过程在75 ℃时进行,其合理的原因是
a.使白磷熔化,提高反应活性
b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解
d.适当提高温度,增大反应速率
②生产过程在高纯氮气保护下进行,其目的是
③硝酸氧化除砷时被还原为NO,写出砷转化为砷酸的化学方程式:
氧化相同质量的砷,当转化为亚砷酸的量越多时,消耗硝酸的量越
④某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图所示,砷的脱除率从a点到b点降低的原因是

您最近一年使用:0次
2020-10-19更新
|
216次组卷
|
4卷引用:黑龙江省大庆市铁人中学2021届高三上学期期中考试化学试题
黑龙江省大庆市铁人中学2021届高三上学期期中考试化学试题黑龙江省嫩江市高级中学2021届高三上学期期中考试化学试题(已下线)专题35 磷、砷及其化合物-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)新疆和田地区民丰县2022-2023学年高三上学期11月期中考试化学试题
3 . 钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿制备NH4VO3。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“酸浸氧化”需要加热,其原因是___________ 。
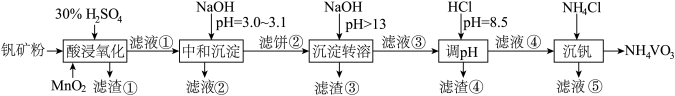
(2)“酸浸氧化”中,VO+和VO2+被氧化成 ,同时还有
,同时还有___________ 离子被氧化。写出VO+转化为 反应的离子方程式
反应的离子方程式___________ 。
(3)“中和沉淀”中,钒水解并沉淀为 ,随滤液②可除去金属离子K+、Mg2+、Na+、
,随滤液②可除去金属离子K+、Mg2+、Na+、___________ ,以及部分的___________ 。
(4)“沉淀转溶”中,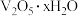 转化为钒酸盐溶解。滤渣③的主要成分是
转化为钒酸盐溶解。滤渣③的主要成分是___________ 。
(5)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是___________ 。
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是___________ 。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
| 开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 | 10.1 |
(1)“酸浸氧化”需要加热,其原因是
(2)“酸浸氧化”中,VO+和VO2+被氧化成
 ,同时还有
,同时还有 反应的离子方程式
反应的离子方程式(3)“中和沉淀”中,钒水解并沉淀为
 ,随滤液②可除去金属离子K+、Mg2+、Na+、
,随滤液②可除去金属离子K+、Mg2+、Na+、(4)“沉淀转溶”中,
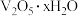 转化为钒酸盐溶解。滤渣③的主要成分是
转化为钒酸盐溶解。滤渣③的主要成分是(5)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是
您最近一年使用:0次
2020-07-08更新
|
23710次组卷
|
33卷引用:黑龙江省大庆铁人中学2022-2023学年高三上学期开学考试化学试题
黑龙江省大庆铁人中学2022-2023学年高三上学期开学考试化学试题2020年全国统一考试化学试题(新课标Ⅰ)(已下线)专题15 工艺流程题-2020年高考真题和模拟题化学分项汇编(已下线)第三单元 金属及其化合物测试题-2021年高考化学一轮复习名师精讲练河南省三门峡市第一高级中学2021届高三8月开学考试化学试题福建省福州市第一中学2021届高三上学期开学质检化学试题湖北省名校联盟2021届高三下学期开学考试(新高考)化学试题(已下线)专题14 无机化工流程不丢分-2021年高考化学必做热点专题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)重点8 工艺流程综合题-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)重点4 无机化工流程分析-2021年高考化学专练【热点·重点·难点】(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)(已下线)押山东卷第16题 化工流程综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)专题讲座(六)化工流程的解题策略(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)新疆生产建设兵团第九师龙珍高级中学2021-2022学年高三上学期第一次月考化学试题(已下线)2021年高考全国乙卷化学试题变式题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)2020年全国卷Ⅰ理综化学高考真题变式题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)微专题17 热点金属及其化合物制备流程(V、Cr、Mn、Co、Ni)-备战2023年高考化学一轮复习考点微专题(已下线)微专题28 有关工艺流程和实验探究方程式的书写-备战2023年高考化学一轮复习考点微专题山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题四川省雅安中学2022-2023学年高二下学期3月月考化学试题(已下线)04 无机化工流程题(4) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)微专题 无机化工流程题的解题策略四川省成都市简阳实验学校2023-2024学年高三下学期开学考试理科综合试题-高中化学
4 . 元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是______ 。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.单质的熔点降低
d.氧化物对应的水化物碱性减弱,酸性增强
原子最外层电子数与次外层电子数相同的元素名称为_____ ,氧化性最弱的简单阳离子是____ 。
(2)已知:
工业制镁时,电解MgCl2而不电解MgO的原因是_____ ;制铝时,电解Al2O3而不电解AlCl3的原因是_____ 。
(3)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)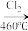 SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯)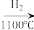 Si(纯)
Si(纯)
写出SiCl4的电子式:_____ ;
(4)下列气体不能用浓硫酸干燥,可用P2O5干燥的是_____ 。
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:____ 。
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.单质的熔点降低
d.氧化物对应的水化物碱性减弱,酸性增强
原子最外层电子数与次外层电子数相同的元素名称为
(2)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是
(3)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)
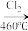 SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯)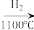 Si(纯)
Si(纯)写出SiCl4的电子式:
(4)下列气体不能用浓硫酸干燥,可用P2O5干燥的是
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:
您最近一年使用:0次
名校
5 . 钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。
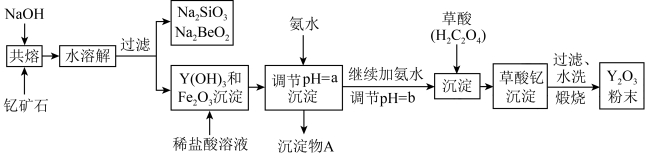
已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)写出Na2SiO3的一种用途________________________ 。
(2)若改用氧化物的形式表示Y2FeBe2Si2O10组成,则化学式为__________ 。
(3)根据元素周期表的知识判断,常温下,氯化锶溶液pH____ 7(填“大于”、“等于”或“小于”);写出氯化锶的电子式:______________________ 。
(4)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和_______ 两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式___________________________ 。
(5)为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________ 范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________ ;检验Fe3+是否沉淀完全的操作方法是:___________________________________ 。
(6)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式___________________________________ 。

已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.1 | 3.1 |
| Y3+ | 6.0 | 8.2 |
(1)写出Na2SiO3的一种用途
(2)若改用氧化物的形式表示Y2FeBe2Si2O10组成,则化学式为
(3)根据元素周期表的知识判断,常温下,氯化锶溶液pH
(4)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式
(5)为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在
(6)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式
您最近一年使用:0次
名校
6 . 铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:
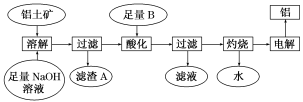
已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为2Na2SiO3+2NaAlO2+2H2O===Na2Al2Si2O8↓+4NaOH。
请回答下列问题:
(1)铝土矿中Al2O3与氢氧化钠溶液反应的离子方程式为
________________________________________________________________________ 。
(2)在工艺流程中“酸化”时,加入的最佳物质B是______ ,理由是________________________________________________________________________ ,
写出酸化过程发生反应的化学方程式________________________________________________________________________ 。
(3)工业上用Al2O3与C、Cl2在高温条件下反应制取AlCl3,理论上每消耗6.0 g碳单质,转移1 mol电子,则反应的化学方程式为______________________________ 。
(4)某同学推测铝与氧化铁发生铝热反应得到的熔融物中还含有Fe2O3,设计了如下方案来验证:取一块该熔融物投入少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3。
则物质甲是________ (填化学式),请判断该同学设计的实验方案的合理性________ (填“合理”或“不合理”)。原因是_____________________________ (若合理,则不用填写)。

已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为2Na2SiO3+2NaAlO2+2H2O===Na2Al2Si2O8↓+4NaOH。
请回答下列问题:
(1)铝土矿中Al2O3与氢氧化钠溶液反应的离子方程式为
(2)在工艺流程中“酸化”时,加入的最佳物质B是
写出酸化过程发生反应的化学方程式
(3)工业上用Al2O3与C、Cl2在高温条件下反应制取AlCl3,理论上每消耗6.0 g碳单质,转移1 mol电子,则反应的化学方程式为
(4)某同学推测铝与氧化铁发生铝热反应得到的熔融物中还含有Fe2O3,设计了如下方案来验证:取一块该熔融物投入少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3。
则物质甲是
您最近一年使用:0次
2017-05-24更新
|
999次组卷
|
8卷引用:黑龙江省大庆实验中学2016-2017学年高一6月月考化学试题
黑龙江省大庆实验中学2016-2017学年高一6月月考化学试题河北省邢台市第一中学2016-2017学年高二下学期第三次月考化学试题内蒙古巴彦淖尔市第一中学2018届高三上学期期中考试理科综合化学试题【全国百强校】广西陆川县中学2017-2018学年高一下学期6月考化学试题(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第2讲 镁、铝及其重要化合物【押题专练】江苏省启东中学2020-2021学年高一上学期第二次月考化学试题宁夏银川市景博中学2022-2023学年高二上学期期中考试化学试题(已下线)考点11 镁、铝及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
7 . 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)氯元素同族的下一周期元素的原子结构示意图为_______ ,碘是______ (填颜色)固体物质。(2)牙齿的损坏实际上是牙釉质羟基磷灰石[Ca5(PO4)3OH]溶解的结果,糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。使用含氟牙膏会保护牙齿,因为氟离子会跟羟基磷灰石[Ca5(PO4)3OH]发生反应生成氟磷灰石,氟磷灰石比羟基磷灰石更能抵抗酸的侵蚀氟,用离子方程式表示这一过程_________________________________________ 。此外氟离子还能抑制口腔细菌产生酸,含氟牙膏已经普遍使用。
(3)碘被称为“智力元素”,碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与碘化钾生成单质碘。写出该反应的离子方程式_________________ 。
(4)①电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
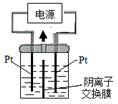
已知:3I2+6OH—==IO3—+5I—+3H2O
下列说法正确的是( )
A.右侧发生的电极方程式:2H2O+2e—==H2↑+2OH—
B.电解结束时,右侧溶液中含有IO3—
C.电解槽内发生反应的总化学方程式KI+3H2O==KIO3+3H2↑(条件通电)
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式会改变
②电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:

步骤⑤的操作名称____________________
(5)已知:I2+2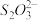 =
=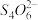 +2I-。溶度积常数Ksp(CuCl)=1.7×10-7 Ksp( CuI)=1.3×10-12用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I―发生反应的氧化性杂质)的纯度,过程如下:取a g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用c mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液b mL。
+2I-。溶度积常数Ksp(CuCl)=1.7×10-7 Ksp( CuI)=1.3×10-12用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I―发生反应的氧化性杂质)的纯度,过程如下:取a g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用c mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液b mL。
①可选用___________ 作滴定指示剂,滴定终点的现象是_________________ 。
②CuCl2溶液与KI反应的离子方程式为______________________________ 。
③该试样中CuCl2•2H2O的质量百分数为___________________________ 。
(1)氯元素同族的下一周期元素的原子结构示意图为
(3)碘被称为“智力元素”,碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与碘化钾生成单质碘。写出该反应的离子方程式
(4)①电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。

已知:3I2+6OH—==IO3—+5I—+3H2O
下列说法正确的是
A.右侧发生的电极方程式:2H2O+2e—==H2↑+2OH—
B.电解结束时,右侧溶液中含有IO3—
C.电解槽内发生反应的总化学方程式KI+3H2O==KIO3+3H2↑(条件通电)
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式会改变
②电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:

步骤⑤的操作名称
(5)已知:I2+2
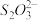 =
=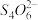 +2I-。溶度积常数Ksp(CuCl)=1.7×10-7 Ksp( CuI)=1.3×10-12用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I―发生反应的氧化性杂质)的纯度,过程如下:取a g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用c mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液b mL。
+2I-。溶度积常数Ksp(CuCl)=1.7×10-7 Ksp( CuI)=1.3×10-12用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I―发生反应的氧化性杂质)的纯度,过程如下:取a g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用c mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液b mL。①可选用
②CuCl2溶液与KI反应的离子方程式为
③该试样中CuCl2•2H2O的质量百分数为
您最近一年使用:0次
名校
解题方法
8 . A、B、C、D、E、W为六种前四周期元素,它们的原子序数依次增大. A 与 D 同主族,可形成 DA 型离子化合物,B与C同周期且相邻,C与E同主族,E2-与 Ar 原子具有相同的电子层结构,W 的合金用量最大、用途最广.请回答下列问题:
(1)D 在元素周期表中的位置___________ .
(2)A 分别与 C、E 形成最简单化合物中沸点较高的是________ (填化学式),原因是____________ .
(3)A、C、D三种元素形成的物质中含有的化学键类型______ ,灼热的碳能与 B 的最高价氧化物对应水化物的浓溶液反应,化学反应方程式为_____________ .
(4)向盛有A2C2 溶液的试管中加入几滴酸化的WEC4 溶液,溶液变成棕黄色,发生反应的离子方程式为____________ ;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是_______ ;生成沉淀的原因是____________ (用平衡移动原理解释).
(1)D 在元素周期表中的位置
(2)A 分别与 C、E 形成最简单化合物中沸点较高的是
(3)A、C、D三种元素形成的物质中含有的化学键类型
(4)向盛有A2C2 溶液的试管中加入几滴酸化的WEC4 溶液,溶液变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
2017-02-17更新
|
459次组卷
|
6卷引用:2017届黑龙江省大庆市高三上学期第一次模拟考试化学试卷
9 . 铬是用途广泛的金属,但在生产过程中易产生有害的含铬工业废水。
I. 还原沉淀法处理含Cr2O72-和CrO42-,工业废水的一种常用方法,其工艺流程如下:
CrO42- Cr2O72-
Cr2O72-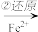 Cr3+
Cr3+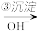 Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
(1)若平衡体系的pH=0,该溶液显__________ 色。
(2)第②步反应的离子方程式是_______________________ 。
已知:常温下Ksp[Cr(OH)3] =6.0×10-31, Ksp[Fe(OH)3]=4.0×10-38
向第②步反应后的溶液中加入一定量烧碱,若溶液中c(Fe3+)=4.0×10-14 mol/L,溶液的pH值为____________ ,此时溶液中c(Cr3+)=_____________ mol/L。
II.探究 CrO3的强氧化性和热稳定性
(3)CrO3具有强氧化性,遇到有机物(如酒精)时,剧烈反应以至着火.若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3.完成该反应的化学方程式:
_____ CrO3 +___ C2H5OH+___ H2SO4=_____ Cr2(SO4)3+____ CH3COOH+ _______
(4))CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。B点时剩余固体的成分是___________ (填化学式 )。

I. 还原沉淀法处理含Cr2O72-和CrO42-,工业废水的一种常用方法,其工艺流程如下:
CrO42-
 Cr2O72-
Cr2O72-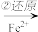 Cr3+
Cr3+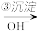 Cr(OH)3↓
Cr(OH)3↓其中第①步存在平衡:2CrO42-+2H+
 Cr2O72-+H2O
Cr2O72-+H2O(1)若平衡体系的pH=0,该溶液显
(2)第②步反应的离子方程式是
已知:常温下Ksp[Cr(OH)3] =6.0×10-31, Ksp[Fe(OH)3]=4.0×10-38
向第②步反应后的溶液中加入一定量烧碱,若溶液中c(Fe3+)=4.0×10-14 mol/L,溶液的pH值为
II.探究 CrO3的强氧化性和热稳定性
(3)CrO3具有强氧化性,遇到有机物(如酒精)时,剧烈反应以至着火.若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3.完成该反应的化学方程式:
(4))CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。B点时剩余固体的成分是

您最近一年使用:0次



