解题方法
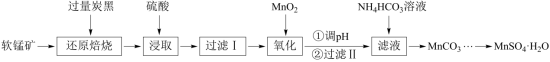
1 . 以软锰矿(主要成分是MnO2,还含有Fe2O3、SiO2、CuO、CaO等少量杂质)为主要原料制备硫酸锰晶体的工艺流程如图所示,回答下列问题: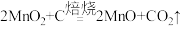 ;
;
② 在酸性条件下比较稳定,pH高于5.5时易被
在酸性条件下比较稳定,pH高于5.5时易被 氧化;
氧化;
③ ,
, ;离子浓度
;离子浓度 时,可认为完全沉淀。
时,可认为完全沉淀。
④ 溶于1份冷水、0.6份沸水,不溶于乙醇;
溶于1份冷水、0.6份沸水,不溶于乙醇;
(1)基态Mn原子的价电子排布式为___________ ,“过滤Ⅰ”得到的滤渣主要成分除了C、Cu、SiC,还有___________ (填化学式)。
(2)“氧化”时发生反应的离子方程式为___________ 。
(3)“调pH”时溶液中 的浓度约为
的浓度约为 ,常温下,调节pH的合理范围是
,常温下,调节pH的合理范围是___________ 。
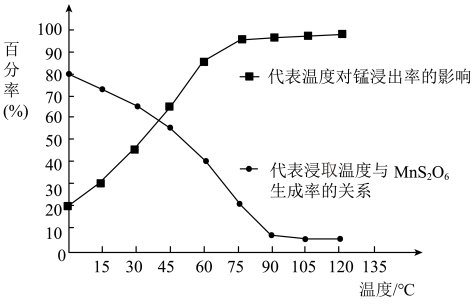
(4)“浸取”时,反应中往往有副产物MnS2O6生成,温度对浸取反应的影响如图所示,为减少MnS2O6的生成,“浸取”的适宜温度是___________ ;向过滤Ⅱ所得的“滤液”中加入NH4HCO3溶液时温度不宜太高的原因是___________ 。___________ 。
(6)获得MnSO4·H2O后常用乙醇洗涤,主要目的是___________ 。
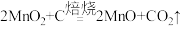 ;
;②
 在酸性条件下比较稳定,pH高于5.5时易被
在酸性条件下比较稳定,pH高于5.5时易被 氧化;
氧化;③
 ,
, ;离子浓度
;离子浓度 时,可认为完全沉淀。
时,可认为完全沉淀。④
 溶于1份冷水、0.6份沸水,不溶于乙醇;
溶于1份冷水、0.6份沸水,不溶于乙醇;(1)基态Mn原子的价电子排布式为
(2)“氧化”时发生反应的离子方程式为
(3)“调pH”时溶液中
 的浓度约为
的浓度约为 ,常温下,调节pH的合理范围是
,常温下,调节pH的合理范围是(4)“浸取”时,反应中往往有副产物MnS2O6生成,温度对浸取反应的影响如图所示,为减少MnS2O6的生成,“浸取”的适宜温度是
(6)获得MnSO4·H2O后常用乙醇洗涤,主要目的是
您最近一年使用:0次
名校
解题方法
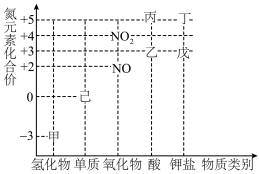
2 . 物质类别与元素化合价是研究物质性质的两个视角,下列是氮元素及其化合物的“价类二维图”。根据要求回答下列问题:___________ ,丁与硫黄、木炭混合即为黑火药,黑火药的爆炸反应为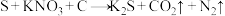 (未配平)。该反应中氧化剂与还原剂的物质的量之比为
(未配平)。该反应中氧化剂与还原剂的物质的量之比为___________ 。
(2)在含有1.0mol丙的稀溶液中慢慢加入28g的铁粉,反应分为两个阶段。第一阶段的离子反应方程式为___________ ,第二阶段离子反应: 。
。
(3)甲和 在一定条件下发生反应,产物之一为己,该反应的化学方程式为
在一定条件下发生反应,产物之一为己,该反应的化学方程式为___________ 。
(4)戊在酸性条件下,与 按物质的量之比
按物质的量之比 恰好完全反应,生成能使淀粉变蓝的物质,写出该过程发生的离子反应方程式:
恰好完全反应,生成能使淀粉变蓝的物质,写出该过程发生的离子反应方程式:___________ 。
(5)某化学兴趣小组拟利用下列装置,在实验室中制取并收集干燥的甲气体。__________ →b(按从左到右的气流方向)。
②利用装置Ⅰ制取甲气体,可以选用浓氨水和生石灰,反应的化学方程式为___________ 。
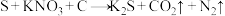 (未配平)。该反应中氧化剂与还原剂的物质的量之比为
(未配平)。该反应中氧化剂与还原剂的物质的量之比为(2)在含有1.0mol丙的稀溶液中慢慢加入28g的铁粉,反应分为两个阶段。第一阶段的离子反应方程式为
 。
。(3)甲和
 在一定条件下发生反应,产物之一为己,该反应的化学方程式为
在一定条件下发生反应,产物之一为己,该反应的化学方程式为(4)戊在酸性条件下,与
 按物质的量之比
按物质的量之比 恰好完全反应,生成能使淀粉变蓝的物质,写出该过程发生的离子反应方程式:
恰好完全反应,生成能使淀粉变蓝的物质,写出该过程发生的离子反应方程式:(5)某化学兴趣小组拟利用下列装置,在实验室中制取并收集干燥的甲气体。

②利用装置Ⅰ制取甲气体,可以选用浓氨水和生石灰,反应的化学方程式为
您最近一年使用:0次
3 . Ⅰ.汽车让人们的生活越来越便捷。请回答以下问题:
(1)汽车尾气主要含有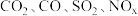 等物质,是造成城市空气污染的主要因素之一;
等物质,是造成城市空气污染的主要因素之一;  和
和 反应生成
反应生成 的能量变化如下图所示,则该反应的热化学方程式为
的能量变化如下图所示,则该反应的热化学方程式为_______________ 。 可作氧化剂,用于氧化火箭推进器中的强还原剂肼
可作氧化剂,用于氧化火箭推进器中的强还原剂肼 ,释放大量的能量,其热化学方程式为:
,释放大量的能量,其热化学方程式为:
①若进行上述反应,放出热量为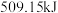 ,则转移电子数目为
,则转移电子数目为_______________  。
。
②已知: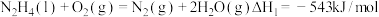

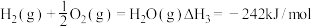
若用氟气代替二氧化氮作氧化剂,则反应释放能量更多,请写出液态肼和氟气反应的热化学方程式:_______________ 。
(3)汽车受到猛烈碰撞时,安全气囊内的 固体迅速分解,产生氮气和金属钠,该过程中的能量变化如图所示,下列说法错误的是___________。
固体迅速分解,产生氮气和金属钠,该过程中的能量变化如图所示,下列说法错误的是___________。
Ⅱ.污染性气体的处理:
(4)以 溶液作为吸收剂,控制溶液的
溶液作为吸收剂,控制溶液的 ,将二氧化硫和一氧化氮转化为
,将二氧化硫和一氧化氮转化为 和
和 去除。
去除。
①在酸性 溶液中,
溶液中, 氧化
氧化 的离子方程式为
的离子方程式为_______________ 。
② 的去除率高于
的去除率高于 的可能原因是
的可能原因是_______________ 。(任写一条)
(5)将 的混合气体共
的混合气体共 (已换算为标准状况,下同)通入水中,气体体积减小
(已换算为标准状况,下同)通入水中,气体体积减小 ,若将该混合气体与一定量
,若将该混合气体与一定量 混合通入水中,所有气体能被完全吸收得到硝酸溶液,下列说法错误的是
混合通入水中,所有气体能被完全吸收得到硝酸溶液,下列说法错误的是_______________ (填序号)。
①混合气体中 的体积分数为
的体积分数为
②所得硝酸溶液物质的量浓度为
③用足量 溶液可将该混合气体完全吸收
溶液可将该混合气体完全吸收
④消耗的 在标准状况下的体积为
在标准状况下的体积为
(1)汽车尾气主要含有
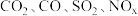 等物质,是造成城市空气污染的主要因素之一;
等物质,是造成城市空气污染的主要因素之一;  和
和 反应生成
反应生成 的能量变化如下图所示,则该反应的热化学方程式为
的能量变化如下图所示,则该反应的热化学方程式为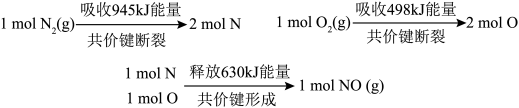
 可作氧化剂,用于氧化火箭推进器中的强还原剂肼
可作氧化剂,用于氧化火箭推进器中的强还原剂肼 ,释放大量的能量,其热化学方程式为:
,释放大量的能量,其热化学方程式为:
①若进行上述反应,放出热量为
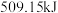 ,则转移电子数目为
,则转移电子数目为 。
。②已知:
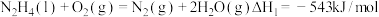

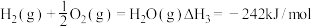
若用氟气代替二氧化氮作氧化剂,则反应释放能量更多,请写出液态肼和氟气反应的热化学方程式:
(3)汽车受到猛烈碰撞时,安全气囊内的
 固体迅速分解,产生氮气和金属钠,该过程中的能量变化如图所示,下列说法错误的是___________。
固体迅速分解,产生氮气和金属钠,该过程中的能量变化如图所示,下列说法错误的是___________。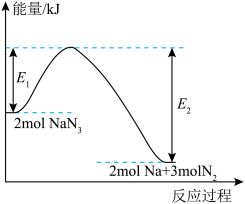
A. 属于离子化合物 属于离子化合物 |
B. 的分解反应属于吸热反应 的分解反应属于吸热反应 |
C. 表示 表示 固体具有的能量 固体具有的能量 |
D. 作为安全气囊的气体发生剂,具有产气快、产气量大等优点 作为安全气囊的气体发生剂,具有产气快、产气量大等优点 |
Ⅱ.污染性气体的处理:
(4)以
 溶液作为吸收剂,控制溶液的
溶液作为吸收剂,控制溶液的 ,将二氧化硫和一氧化氮转化为
,将二氧化硫和一氧化氮转化为 和
和 去除。
去除。①在酸性
 溶液中,
溶液中, 氧化
氧化 的离子方程式为
的离子方程式为②
 的去除率高于
的去除率高于 的可能原因是
的可能原因是(5)将
 的混合气体共
的混合气体共 (已换算为标准状况,下同)通入水中,气体体积减小
(已换算为标准状况,下同)通入水中,气体体积减小 ,若将该混合气体与一定量
,若将该混合气体与一定量 混合通入水中,所有气体能被完全吸收得到硝酸溶液,下列说法错误的是
混合通入水中,所有气体能被完全吸收得到硝酸溶液,下列说法错误的是①混合气体中
 的体积分数为
的体积分数为
②所得硝酸溶液物质的量浓度为

③用足量
 溶液可将该混合气体完全吸收
溶液可将该混合气体完全吸收④消耗的
 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
4 . 硅是带来人类文明的重要元素之一,硅与二氧化硅广泛应用于通讯行业。_______________ 。
(2)工业上可以通过如图所示的流程制取纯硅:
①反应Ⅱ的化学方程式为_______________ 。
②整个过程中必须严格控制无氧。在有氧环境下,除了有不安全因素外还可能使产品中混有杂质______ (填化学式,下同);整个过程中可以循环利用的物质是_____ 和_____ 。
(3)如图是用海边的石英砂(含氯化钠、氧化铝等杂质)制备二氧化硅粗产品的工艺流程。_______________ 。
②不能将以上流程中的盐酸改为NaOH溶液,请说明理由______ (用化学方程式表示)。
③二氧化硅可用于工业制玻璃,建筑装饰中常在玻璃上雕刻图案或花纹,用于刻蚀玻璃的化学试剂是______ (填化学式)。
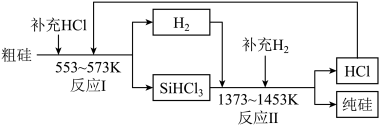
(2)工业上可以通过如图所示的流程制取纯硅:
①反应Ⅱ的化学方程式为
②整个过程中必须严格控制无氧。在有氧环境下,除了有不安全因素外还可能使产品中混有杂质
(3)如图是用海边的石英砂(含氯化钠、氧化铝等杂质)制备二氧化硅粗产品的工艺流程。

②不能将以上流程中的盐酸改为NaOH溶液,请说明理由
③二氧化硅可用于工业制玻璃,建筑装饰中常在玻璃上雕刻图案或花纹,用于刻蚀玻璃的化学试剂是
您最近一年使用:0次
解题方法
5 . 亚氯酸钠 和
和 都是重要的化工原料,常用作高效、广谱、安全的杀菌消毒剂。
都是重要的化工原料,常用作高效、广谱、安全的杀菌消毒剂。
(1)用 和硫酸酸化的草酸
和硫酸酸化的草酸 反应可制得
反应可制得 ,写出该反应的离子方程式
,写出该反应的离子方程式___________ 。
(2)用二氧化氯 可制备用途广泛的亚氯酸钠
可制备用途广泛的亚氯酸钠 ,实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。
,实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。 沸点为
沸点为 ,可溶于水,有毒,浓度较高时易发生爆炸。
,可溶于水,有毒,浓度较高时易发生爆炸。
② 饱和溶液高于
饱和溶液高于 时析出
时析出 ,高于
,高于 时
时 分解为
分解为 和
和 。
。
①实验过程中需持续通入一定量的 ,说明原因
,说明原因___________ ;反应结束后需再通入一定量的 ,说明原因
,说明原因___________ 。
②写出装置 中的化学反应方程式
中的化学反应方程式___________ 。
③通入 中的
中的 与
与 中物质恰好完全反应,若从反应后的溶液中得到
中物质恰好完全反应,若从反应后的溶液中得到 固体,写出实验操作的方法
固体,写出实验操作的方法___________ 。
(3)某水样用 处理后,有少量
处理后,有少量 残留在水中,可用碘量法检测。
残留在水中,可用碘量法检测。
①取 水样,加入过量的
水样,加入过量的 ,用硫酸酸化,再加入淀粉溶液,溶液变为蓝色。写出
,用硫酸酸化,再加入淀粉溶液,溶液变为蓝色。写出 与
与 反应的离子方程式
反应的离子方程式___________ 。
②已知: ,向所得溶液中加入适量
,向所得溶液中加入适量 溶液,将溶液调节为弱酸性,再用
溶液,将溶液调节为弱酸性,再用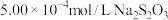 标准溶液进行滴定,恰好反应时消耗
标准溶液进行滴定,恰好反应时消耗 溶液
溶液 。计算水样中
。计算水样中 的浓度
的浓度___________ (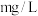 ,不要求计算过程)。
,不要求计算过程)。
 和
和 都是重要的化工原料,常用作高效、广谱、安全的杀菌消毒剂。
都是重要的化工原料,常用作高效、广谱、安全的杀菌消毒剂。(1)用
 和硫酸酸化的草酸
和硫酸酸化的草酸 反应可制得
反应可制得 ,写出该反应的离子方程式
,写出该反应的离子方程式(2)用二氧化氯
 可制备用途广泛的亚氯酸钠
可制备用途广泛的亚氯酸钠 ,实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。
,实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。
 沸点为
沸点为 ,可溶于水,有毒,浓度较高时易发生爆炸。
,可溶于水,有毒,浓度较高时易发生爆炸。②
 饱和溶液高于
饱和溶液高于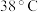 时析出
时析出 ,高于
,高于 时
时 分解为
分解为 和
和 。
。①实验过程中需持续通入一定量的
 ,说明原因
,说明原因 ,说明原因
,说明原因②写出装置
 中的化学反应方程式
中的化学反应方程式③通入
 中的
中的 与
与 中物质恰好完全反应,若从反应后的溶液中得到
中物质恰好完全反应,若从反应后的溶液中得到 固体,写出实验操作的方法
固体,写出实验操作的方法(3)某水样用
 处理后,有少量
处理后,有少量 残留在水中,可用碘量法检测。
残留在水中,可用碘量法检测。①取
 水样,加入过量的
水样,加入过量的 ,用硫酸酸化,再加入淀粉溶液,溶液变为蓝色。写出
,用硫酸酸化,再加入淀粉溶液,溶液变为蓝色。写出 与
与 反应的离子方程式
反应的离子方程式②已知:
 ,向所得溶液中加入适量
,向所得溶液中加入适量 溶液,将溶液调节为弱酸性,再用
溶液,将溶液调节为弱酸性,再用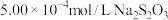 标准溶液进行滴定,恰好反应时消耗
标准溶液进行滴定,恰好反应时消耗 溶液
溶液 。计算水样中
。计算水样中 的浓度
的浓度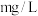 ,不要求计算过程)。
,不要求计算过程)。
您最近一年使用:0次
名校
6 .  、NO和
、NO和 等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)与氮氧化物有关的全球或区域性大气环境问题有___________ (填字母序号)。
a.酸雨 b.沙尘暴 c.光化学烟雾 d.白色污染
(2) 的处理。
的处理。 是硝酸生产中氨催化氧化的副产物,用特种催化剂能使
是硝酸生产中氨催化氧化的副产物,用特种催化剂能使 分解。
分解。 与
与 在加热和催化剂作用下生成
在加热和催化剂作用下生成 的化学方程式为
的化学方程式为___________ 。
(3)NO的氧化吸收。用 溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性溶液中,
溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性溶液中, 氧化NO生成
氧化NO生成 和
和 ,其离子方程式为
,其离子方程式为___________ 。
(4)NO和 的处理。工业上用石灰乳吸收已除去
的处理。工业上用石灰乳吸收已除去 的硝酸尾气(含NO、
的硝酸尾气(含NO、 ),既能净化尾气,又能获得应用广泛的
),既能净化尾气,又能获得应用广泛的 ,其部分工艺流程如下:
,其部分工艺流程如下: 被
被 吸收,反应的化学方程式为
吸收,反应的化学方程式为___________ 。上述工艺中采用气—液逆流接触吸收(尾气从吸收塔底进入,石灰乳从塔顶喷淋),其目的是___________ 。
②生产中溶液需保持弱碱性,在酸性溶液中 会发生分解,产物之一是NO,其反应的离子方程式为
会发生分解,产物之一是NO,其反应的离子方程式为___________ 。
③过滤后的滤液经___________ 、___________ 、过滤、洗涤、干燥,得到无水 。
。
 、NO和
、NO和 等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。(1)与氮氧化物有关的全球或区域性大气环境问题有
a.酸雨 b.沙尘暴 c.光化学烟雾 d.白色污染
(2)
 的处理。
的处理。 是硝酸生产中氨催化氧化的副产物,用特种催化剂能使
是硝酸生产中氨催化氧化的副产物,用特种催化剂能使 分解。
分解。 与
与 在加热和催化剂作用下生成
在加热和催化剂作用下生成 的化学方程式为
的化学方程式为(3)NO的氧化吸收。用
 溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性溶液中,
溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性溶液中, 氧化NO生成
氧化NO生成 和
和 ,其离子方程式为
,其离子方程式为(4)NO和
 的处理。工业上用石灰乳吸收已除去
的处理。工业上用石灰乳吸收已除去 的硝酸尾气(含NO、
的硝酸尾气(含NO、 ),既能净化尾气,又能获得应用广泛的
),既能净化尾气,又能获得应用广泛的 ,其部分工艺流程如下:
,其部分工艺流程如下: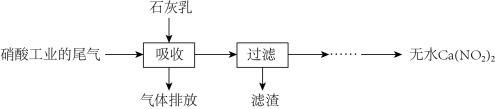
 被
被 吸收,反应的化学方程式为
吸收,反应的化学方程式为②生产中溶液需保持弱碱性,在酸性溶液中
 会发生分解,产物之一是NO,其反应的离子方程式为
会发生分解,产物之一是NO,其反应的离子方程式为③过滤后的滤液经
 。
。
您最近一年使用:0次
名校
解题方法
7 . 氮及其化合物是重要的化工原料,研究其性质、用途和转化具有重要意义。回答下列问题:___________ (填“离子”或“共价”)化合物;常温下,
___________ (填颜色)气体。
(2)物质 (肼)可作为火箭发动机的燃料,已知在
(肼)可作为火箭发动机的燃料,已知在 时1g液态肼燃烧生成氮气和液态水,释放
时1g液态肼燃烧生成氮气和液态水,释放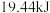 的热量,写出其热化学方程式
的热量,写出其热化学方程式___________ 。
(3)农业上常用物质R作氮肥,实验室检验物质R中阳离子的方法为___________ (写出操作过程和现象)。
(4)硫可与Q的浓溶液反应,硫转化为___________ (化学式)。
(5)氮的氧化物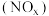 是常见的大气污染物之一,
是常见的大气污染物之一, 催化还原氮氧化物
催化还原氮氧化物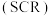 技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质
技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质 与
与 的物质的量之比为
的物质的量之比为 时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,该反应的化学方程式为
时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,该反应的化学方程式为___________ 。


(2)物质
 (肼)可作为火箭发动机的燃料,已知在
(肼)可作为火箭发动机的燃料,已知在 时1g液态肼燃烧生成氮气和液态水,释放
时1g液态肼燃烧生成氮气和液态水,释放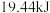 的热量,写出其热化学方程式
的热量,写出其热化学方程式(3)农业上常用物质R作氮肥,实验室检验物质R中阳离子的方法为
(4)硫可与Q的浓溶液反应,硫转化为
(5)氮的氧化物
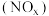 是常见的大气污染物之一,
是常见的大气污染物之一, 催化还原氮氧化物
催化还原氮氧化物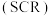 技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质
技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质 与
与 的物质的量之比为
的物质的量之比为 时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,该反应的化学方程式为
时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
8 . 含硫化合物的处理和利用是科学研究的重要课题之一:
 .用石灰石、氨水等脱硫。以硫酸工业的二氧化硫尾气、氨水、石灰石、碳酸氢铵和氯化钾等为原料,可以制备有重要应用价值的硫酸钾、亚硫酸铵等物质,制备流程如图1:
.用石灰石、氨水等脱硫。以硫酸工业的二氧化硫尾气、氨水、石灰石、碳酸氢铵和氯化钾等为原料,可以制备有重要应用价值的硫酸钾、亚硫酸铵等物质,制备流程如图1: 是脱去
是脱去 的一种常用方法,其反应的化学方程式为
的一种常用方法,其反应的化学方程式为___________ 。研究发现: 和温度对石灰石浆液的脱硫效率产生一定影响,当烟气通入速度一定时,石灰石浆液的脱硫率与浆液
和温度对石灰石浆液的脱硫效率产生一定影响,当烟气通入速度一定时,石灰石浆液的脱硫率与浆液 的关系如图2所示。下列有关说法正确的是
的关系如图2所示。下列有关说法正确的是___________ 。
b.石灰石浆液 ,烟气脱硫效果降低的原因是石灰石的溶解度增大
,烟气脱硫效果降低的原因是石灰石的溶解度增大
c.反应时需鼓入足量的空气以保证 被充分氧化生成
被充分氧化生成
d.将脱硫后的气体通入 溶液,可粗略判断烟气脱硫效率
溶液,可粗略判断烟气脱硫效率
(2)生产中,向反应 中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是
中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是___________ 。
(3) 可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种铵态氮肥。用
可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种铵态氮肥。用 溶液吸收NO,当生成氮气的体积为
溶液吸收NO,当生成氮气的体积为 (标准状况)时,该反应转移电子的物质的量为
(标准状况)时,该反应转移电子的物质的量为___________ 。
 .
. 还原法也是处理含较多的硫酸厂废气方法之一。
还原法也是处理含较多的硫酸厂废气方法之一。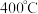 时,
时, 和废气按一定比例混合,以一定流速通过装有
和废气按一定比例混合,以一定流速通过装有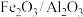 负载型催化剂(其中
负载型催化剂(其中 为催化剂,
为催化剂, 为载体)的反应器。
为载体)的反应器。
(4)该方法不仅可有效脱除 ,同时还获得单质
,同时还获得单质 ,反应的化学方程式为:
,反应的化学方程式为:___________ 。
(5)另一种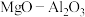 可以用作甲醇脱水的催化剂。
可以用作甲醇脱水的催化剂。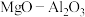 晶胞结构图所示(B中镁原子未画出)。用“●”标记出B中的镁原子
晶胞结构图所示(B中镁原子未画出)。用“●”标记出B中的镁原子___________ 。 .一种催化氧化除去燃煤产生的废气中的
.一种催化氧化除去燃煤产生的废气中的 的过程图所示。
的过程图所示。 是一部分
是一部分 发生催化氧化反应,若参加反应
发生催化氧化反应,若参加反应 和
和 的体积比为4:3,则反应的化学方程式为
的体积比为4:3,则反应的化学方程式为___________ 。
(7)过程 利用电化学装置发生电解,通过氧化还原反应吸收另一部分
利用电化学装置发生电解,通过氧化还原反应吸收另一部分 ,使得
,使得 再生,若此过程中除去
再生,若此过程中除去 体积分数为
体积分数为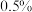 的废气
的废气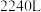 (标准状况),可使
(标准状况),可使___________ gCu再生。
 .用石灰石、氨水等脱硫。以硫酸工业的二氧化硫尾气、氨水、石灰石、碳酸氢铵和氯化钾等为原料,可以制备有重要应用价值的硫酸钾、亚硫酸铵等物质,制备流程如图1:
.用石灰石、氨水等脱硫。以硫酸工业的二氧化硫尾气、氨水、石灰石、碳酸氢铵和氯化钾等为原料,可以制备有重要应用价值的硫酸钾、亚硫酸铵等物质,制备流程如图1: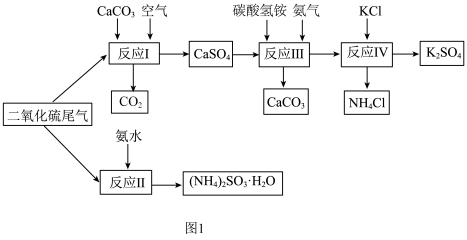
 是脱去
是脱去 的一种常用方法,其反应的化学方程式为
的一种常用方法,其反应的化学方程式为 和温度对石灰石浆液的脱硫效率产生一定影响,当烟气通入速度一定时,石灰石浆液的脱硫率与浆液
和温度对石灰石浆液的脱硫效率产生一定影响,当烟气通入速度一定时,石灰石浆液的脱硫率与浆液 的关系如图2所示。下列有关说法正确的是
的关系如图2所示。下列有关说法正确的是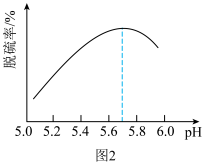
b.石灰石浆液
 ,烟气脱硫效果降低的原因是石灰石的溶解度增大
,烟气脱硫效果降低的原因是石灰石的溶解度增大c.反应时需鼓入足量的空气以保证
 被充分氧化生成
被充分氧化生成
d.将脱硫后的气体通入
 溶液,可粗略判断烟气脱硫效率
溶液,可粗略判断烟气脱硫效率(2)生产中,向反应
 中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是
中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是(3)
 可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种铵态氮肥。用
可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种铵态氮肥。用 溶液吸收NO,当生成氮气的体积为
溶液吸收NO,当生成氮气的体积为 (标准状况)时,该反应转移电子的物质的量为
(标准状况)时,该反应转移电子的物质的量为 .
. 还原法也是处理含较多的硫酸厂废气方法之一。
还原法也是处理含较多的硫酸厂废气方法之一。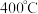 时,
时, 和废气按一定比例混合,以一定流速通过装有
和废气按一定比例混合,以一定流速通过装有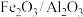 负载型催化剂(其中
负载型催化剂(其中 为催化剂,
为催化剂, 为载体)的反应器。
为载体)的反应器。(4)该方法不仅可有效脱除
 ,同时还获得单质
,同时还获得单质 ,反应的化学方程式为:
,反应的化学方程式为:(5)另一种
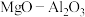 可以用作甲醇脱水的催化剂。
可以用作甲醇脱水的催化剂。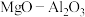 晶胞结构图所示(B中镁原子未画出)。用“●”标记出B中的镁原子
晶胞结构图所示(B中镁原子未画出)。用“●”标记出B中的镁原子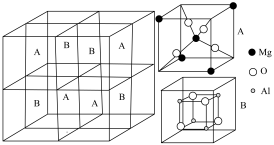
 .一种催化氧化除去燃煤产生的废气中的
.一种催化氧化除去燃煤产生的废气中的 的过程图所示。
的过程图所示。
 是一部分
是一部分 发生催化氧化反应,若参加反应
发生催化氧化反应,若参加反应 和
和 的体积比为4:3,则反应的化学方程式为
的体积比为4:3,则反应的化学方程式为(7)过程
 利用电化学装置发生电解,通过氧化还原反应吸收另一部分
利用电化学装置发生电解,通过氧化还原反应吸收另一部分 ,使得
,使得 再生,若此过程中除去
再生,若此过程中除去 体积分数为
体积分数为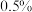 的废气
的废气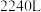 (标准状况),可使
(标准状况),可使
您最近一年使用:0次
解题方法
9 . 我国在新能源汽车领域世界领先,新能源汽车动力电池的制备和回收利用技术至关重要。回答下列问题:
I.磷酸铁锂电池放电时电池反应为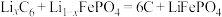 。
。
(1)磷酸铁锂电池正极的电极反应式为_____ 。
(2)将 、磷酸铁与足量炭黑混合高温灼烧可制备
、磷酸铁与足量炭黑混合高温灼烧可制备 ,同时生成一种有毒的气体。写出该反应的化学方程式:
,同时生成一种有毒的气体。写出该反应的化学方程式:_____ 。
Ⅱ.回收含的废旧电池制备 的流程如图所示(已知
的流程如图所示(已知 加热时可溶于盐酸):
加热时可溶于盐酸):_____ ,若要提高 的浸出速率和浸出率,可采取的措施是
的浸出速率和浸出率,可采取的措施是_____ (任写两点)。
(4)写出 与
与 在盐酸中发生反应的离子方程式:
在盐酸中发生反应的离子方程式:_____ 。
(5)欲证明 已沉淀完全,应采用的实验操作是
已沉淀完全,应采用的实验操作是_____ 。
(6)“操作a”所需玻璃仪器有_____ 。
I.磷酸铁锂电池放电时电池反应为
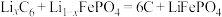 。
。(1)磷酸铁锂电池正极的电极反应式为
(2)将
 、磷酸铁与足量炭黑混合高温灼烧可制备
、磷酸铁与足量炭黑混合高温灼烧可制备 ,同时生成一种有毒的气体。写出该反应的化学方程式:
,同时生成一种有毒的气体。写出该反应的化学方程式:Ⅱ.回收含的废旧电池制备
 的流程如图所示(已知
的流程如图所示(已知 加热时可溶于盐酸):
加热时可溶于盐酸):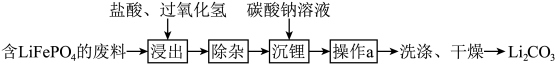
 的浸出速率和浸出率,可采取的措施是
的浸出速率和浸出率,可采取的措施是(4)写出
 与
与 在盐酸中发生反应的离子方程式:
在盐酸中发生反应的离子方程式:(5)欲证明
 已沉淀完全,应采用的实验操作是
已沉淀完全,应采用的实验操作是(6)“操作a”所需玻璃仪器有
您最近一年使用:0次
解题方法
10 . 由煤矸石(主要成分为SiO2及铁铝的氧化物,还含有少量CaO)制备铁红的工艺流程如图。___________ (任写两条)。
(2)滤渣的主要成分是___________ 。
(3)“氧化”过程中发生反应的离子方程式为___________ 。
(4)“沉铁”过程中加入过量NaOH溶液,发生反应的离子方程式为Fe3++3OH-=Fe(OH)3↓和___________ 。
(5)关于“煅烧脱水”制得的铁红,下列说法正确的是___________。
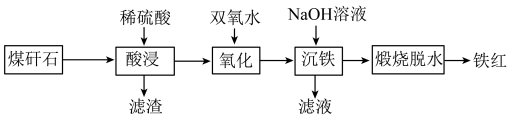
(2)滤渣的主要成分是
(3)“氧化”过程中发生反应的离子方程式为
(4)“沉铁”过程中加入过量NaOH溶液,发生反应的离子方程式为Fe3++3OH-=Fe(OH)3↓和
(5)关于“煅烧脱水”制得的铁红,下列说法正确的是___________。
A.铁红的化学式为 | B.铁红是具有磁性的晶体 |
| C.铁红属于碱性氧化物 | D.铁红常用作油漆、涂料的红色颜料 |
您最近一年使用:0次



