解题方法
1 . 研究氮的循环和转化对生产、生活有重要的价值。
I.(1)实验室制备氨气的收集方法为___________ 。
Ⅱ.氨是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如下图所示。
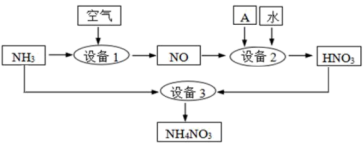
(2)设备1中发生反应的化学方程式为___________ ,设备2中通入的物质A是___________ 。
Ⅲ.氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以 和
和 的形式存在。某工厂处理氨氮废水的流程如下:
的形式存在。某工厂处理氨氮废水的流程如下:
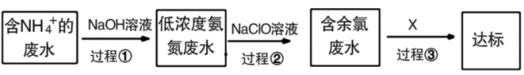
(3)过程①的目的是将 转化为
转化为 ,并通过鼓入大量空气将氨气吹出,写出
,并通过鼓入大量空气将氨气吹出,写出 转化为
转化为 的离子方程式
的离子方程式___________ 。
(4)过程②加入NaClO溶液可将氨氮转化为无毒物质,反应后含氮元素、氯元素的物质的化学式分别为___________ 、___________ 。
(5)含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到去除余氯的目的(填序号)___________ 。
a.KOH b. c.
c. d.NaCl
d.NaCl
I.(1)实验室制备氨气的收集方法为
Ⅱ.氨是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如下图所示。

(2)设备1中发生反应的化学方程式为
Ⅲ.氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以
 和
和 的形式存在。某工厂处理氨氮废水的流程如下:
的形式存在。某工厂处理氨氮废水的流程如下:
(3)过程①的目的是将
 转化为
转化为 ,并通过鼓入大量空气将氨气吹出,写出
,并通过鼓入大量空气将氨气吹出,写出 转化为
转化为 的离子方程式
的离子方程式(4)过程②加入NaClO溶液可将氨氮转化为无毒物质,反应后含氮元素、氯元素的物质的化学式分别为
(5)含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到去除余氯的目的(填序号)
a.KOH b.
 c.
c. d.NaCl
d.NaCl
您最近一年使用:0次
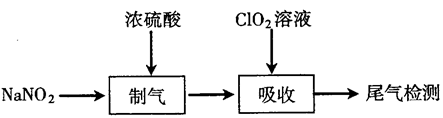
2 . 为探索稳定性 溶液对氮氧化物(
溶液对氮氧化物( )的处理效果,实验过程如下:
)的处理效果,实验过程如下:
已知: 具有强氧化性,且氧化性随着溶液的酸性增强而增强。
具有强氧化性,且氧化性随着溶液的酸性增强而增强。 和NaOH反应的化学方程式为:
和NaOH反应的化学方程式为: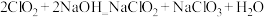 。
。 对氮氧化物具有强吸收效果。
对氮氧化物具有强吸收效果。
(1)“制气”阶段生成 、NO和
、NO和 。“制气”反应的化学方程式为
。“制气”反应的化学方程式为___________ 。
(2) 可以将NO氧化为
可以将NO氧化为 ,并进一步将
,并进一步将 氧化为
氧化为 ,
, 则被还原为
则被还原为 。吸收时,
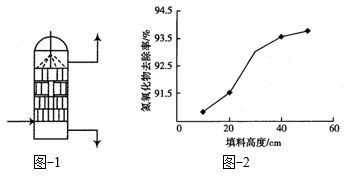
。吸收时, 溶液从吸收器顶部喷淋,氮氧化物从吸收器底部通入(如图-1所示)。
溶液从吸收器顶部喷淋,氮氧化物从吸收器底部通入(如图-1所示)。 的吸收率与吸收器内碎瓷片填料的高度关系如图-2所示。
的吸收率与吸收器内碎瓷片填料的高度关系如图-2所示。
① 和
和 反应的离子方程式为
反应的离子方程式为___________ 。
②随着吸收器内填料高度增加, 去除率增高的原因是
去除率增高的原因是___________ 。
(3)通过加入盐酸或NaOH调节 溶液的pH,测得不同pH的
溶液的pH,测得不同pH的 溶液对
溶液对 吸收率的影响如图-3所示。
吸收率的影响如图-3所示。
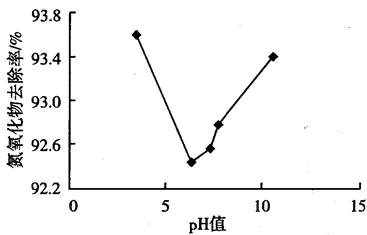
①当pH小于7时, 吸收率随pH增大而减小的原因是
吸收率随pH增大而减小的原因是___________ 。
②当pH大于7时, 吸收率随pH增大而增大的原因是
吸收率随pH增大而增大的原因是___________ 。
 溶液对氮氧化物(
溶液对氮氧化物( )的处理效果,实验过程如下:
)的处理效果,实验过程如下:
已知:
 具有强氧化性,且氧化性随着溶液的酸性增强而增强。
具有强氧化性,且氧化性随着溶液的酸性增强而增强。 和NaOH反应的化学方程式为:
和NaOH反应的化学方程式为: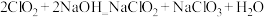 。
。 对氮氧化物具有强吸收效果。
对氮氧化物具有强吸收效果。(1)“制气”阶段生成
 、NO和
、NO和 。“制气”反应的化学方程式为
。“制气”反应的化学方程式为(2)
 可以将NO氧化为
可以将NO氧化为 ,并进一步将
,并进一步将 氧化为
氧化为 ,
, 则被还原为
则被还原为 。吸收时,
。吸收时, 溶液从吸收器顶部喷淋,氮氧化物从吸收器底部通入(如图-1所示)。
溶液从吸收器顶部喷淋,氮氧化物从吸收器底部通入(如图-1所示)。 的吸收率与吸收器内碎瓷片填料的高度关系如图-2所示。
的吸收率与吸收器内碎瓷片填料的高度关系如图-2所示。
①
 和
和 反应的离子方程式为
反应的离子方程式为②随着吸收器内填料高度增加,
 去除率增高的原因是
去除率增高的原因是(3)通过加入盐酸或NaOH调节
 溶液的pH,测得不同pH的
溶液的pH,测得不同pH的 溶液对
溶液对 吸收率的影响如图-3所示。
吸收率的影响如图-3所示。
①当pH小于7时,
 吸收率随pH增大而减小的原因是
吸收率随pH增大而减小的原因是②当pH大于7时,
 吸收率随pH增大而增大的原因是
吸收率随pH增大而增大的原因是
您最近一年使用:0次
2021-06-27更新
|
471次组卷
|
2卷引用:辽宁省葫芦岛市普通高中2021-2022学年高一下学期期末学业质量监测化学试题
名校
解题方法
3 . 亚硝酸钠(NaNO2)可用作建筑钢材的缓蚀剂;也可用作食品添加剂,抑制微生物,保持肉制品的结构和营养价值,但是过量摄入会导致中毒。
I.某工厂以浓HNO3、SO2、Na2CO3溶液等为原料生产NaNO2, 其流程如图:
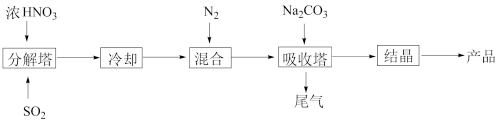
(1)在“分解塔”中,按一定比通入SO2和喷入浓HNO3,产生NO和NO2。操作时将SO2从塔底通入,浓HNO3从塔顶向下喷淋,这种加料操作的目的是_______ 。
(2)“分解塔”中的温度不宜过高,其主要原因是_______ 。
(3)“吸收塔”中主要发生NO、NO2与Na2CO3溶液反应生成NaNO2。写出NO、NO2按物质的量之比1: 1与Na2CO3反应生成NaNO2的化学方程式:_______ 。
II.某化学研究小组在实验室用稀HNO3、Cu、 Na2O2 为原料制备NaNO2,实验装置如图(夹持装置已省略)。
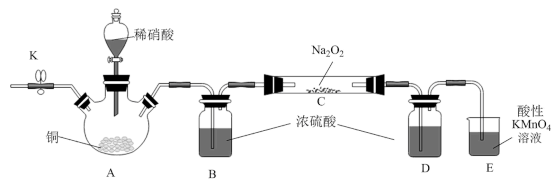
已知:①2NO+Na2O2 = 2NaNO2, 2NO2+Na2O2 =2NaNO3
②酸性条件下,NO、NO2或NO 都能与MnO
都能与MnO 反应生成NO
反应生成NO 和Mn2+
和Mn2+
(4)实验开始加入稀HNO3前,需要先打开止水夹K,向装置中通入一段时间N2,目的是_______ 。
(5)装置A中发生反应的离子方程式为_______ 。
(6)装置B、D不可省去,否则会导致产品中混有_______ 杂质(填化学式)。
III. NaNO2含量测定
工业亚硝酸钠产品中往往混有少量NaNO3等杂质,可以采用KMnO4测定含量。称取5.000g该亚硝酸钠产品溶于水配制成250mL的样品溶液。取25.00mL该样品溶液于锥形瓶中,用稀H2SO4酸化后,再向锥形瓶中滴加0.1000 mol·L-1KMnO4溶液,至恰好完全反应时,消耗28.00 mL KMnO4溶液。计算该产品中NaNO2的质量分数____ 。(写出计算过程)
I.某工厂以浓HNO3、SO2、Na2CO3溶液等为原料生产NaNO2, 其流程如图:

(1)在“分解塔”中,按一定比通入SO2和喷入浓HNO3,产生NO和NO2。操作时将SO2从塔底通入,浓HNO3从塔顶向下喷淋,这种加料操作的目的是
(2)“分解塔”中的温度不宜过高,其主要原因是
(3)“吸收塔”中主要发生NO、NO2与Na2CO3溶液反应生成NaNO2。写出NO、NO2按物质的量之比1: 1与Na2CO3反应生成NaNO2的化学方程式:
II.某化学研究小组在实验室用稀HNO3、Cu、 Na2O2 为原料制备NaNO2,实验装置如图(夹持装置已省略)。

已知:①2NO+Na2O2 = 2NaNO2, 2NO2+Na2O2 =2NaNO3
②酸性条件下,NO、NO2或NO
 都能与MnO
都能与MnO 反应生成NO
反应生成NO 和Mn2+
和Mn2+(4)实验开始加入稀HNO3前,需要先打开止水夹K,向装置中通入一段时间N2,目的是
(5)装置A中发生反应的离子方程式为
(6)装置B、D不可省去,否则会导致产品中混有
III. NaNO2含量测定
工业亚硝酸钠产品中往往混有少量NaNO3等杂质,可以采用KMnO4测定含量。称取5.000g该亚硝酸钠产品溶于水配制成250mL的样品溶液。取25.00mL该样品溶液于锥形瓶中,用稀H2SO4酸化后,再向锥形瓶中滴加0.1000 mol·L-1KMnO4溶液,至恰好完全反应时,消耗28.00 mL KMnO4溶液。计算该产品中NaNO2的质量分数
您最近一年使用:0次
2021-04-29更新
|
343次组卷
|
2卷引用:辽宁省辽阳市2022-2023学年高一下学期期末考试化学试题
名校
解题方法
4 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
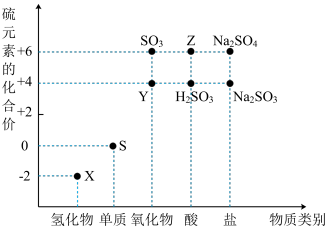
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______ (填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______ 。
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_______ (填字母)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为_______ 。

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为
您最近一年使用:0次
2021-04-25更新
|
422次组卷
|
14卷引用:辽宁省大连市辽宁师范大学附属中学2019-2020学年高一下学期期末考试化学试题
辽宁省大连市辽宁师范大学附属中学2019-2020学年高一下学期期末考试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期期末考试化学试题贵州省岑巩县第四中学2019-2020学年高一上学期期末考试化学试题贵州省施秉县一中2019-2020学年高一上学期期末考试化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高一下学期第一次月考化学试题鲁科版(2019)高一必修第一册第三章第2节 硫的转化 课时4 不同价态硫元素之间的转化酸雨及其防治高一必修第一册(苏教2019版)专题4 第二单元 硫及其化合物的相互转化 课时2 含硫物质之间的转化 氧化还原反应方程式的配平河北省安平中学2020-2021学年高一上学期12月月考化学试题山西省长治市第二中学校2020-2021学年高一下学期期中考试化学试题河北省张家口市第一中学2020-2021学年高一下学期4月月考化学试题江苏省盱眙中学2022-2023学年高一下学期6月阶段测试化学试题沪科版高中化学拓展课程第4章《离子互换反应和氧化还原反应》检测题2湖南省衡阳县四中2022-2023学年高二上学期开学摸底考试化学试题(A卷)黑龙江省双鸭山市第一中学2023-2024学年高二上学期开学考试化学试题
11-12高一下·河北衡水·阶段练习
名校
5 . 已知2MO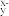 +5S2-+16H+=2M2++5S↓+8H2O,则MO
+5S2-+16H+=2M2++5S↓+8H2O,则MO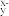 中x的值为
中x的值为
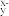 +5S2-+16H+=2M2++5S↓+8H2O,则MO
+5S2-+16H+=2M2++5S↓+8H2O,则MO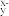 中x的值为
中x的值为| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
2021-03-21更新
|
273次组卷
|
16卷引用:辽宁省锦州市滨海实验中学2019-2020学年高一上学期期末考试化学试题(2019新人教版)
辽宁省锦州市滨海实验中学2019-2020学年高一上学期期末考试化学试题(2019新人教版)2015-2016学年吉林省实验中学高一上期末(理)化学试卷2015-2016学年吉林省实验中学高一上期末文化学试卷安徽省合肥市六校2019-2020学年高一上学期期末考试化学试题辽宁省六校协作体2023-2024学年高一上学期联考化学试题(已下线)2011-2012学年河北省衡水中学高一下学期一调考试化学试卷江西省宜春九中(外国语学校)2019-2020学年高一上学期第二次月考化学试题河北省石家庄市第一中学2020~2021学年高一上学期期中试题化学试题河北省石家庄市第二中学西校区2020-2021学年高一上学期10月月考化学试题湖北省宜昌市长阳土家族自治县第一高级中学2021-2022学年高一上学期10月月考化学试卷河北省石家庄市第一中学2021-2022学年高一上学期期中考试化学试卷河北省保定定州市2022-2023学年高一上学期期中考试化学试题河北省石家庄市第二中学2023-2024高一上学期第一次诊断测评化学试题贵州省贵阳市清镇市第一中学2022-2023学年高一上学期期中考试化学试题河北省石家庄市第九中学2023-2024学年高一上学期第二次月考化学试题海南省定安县定安中学2020届高三上学期第二次月考化学试题
6 . Ⅰ、下表为元素周期表的一部分,请回答有关问题
(1)①和②的简单气态氢化物的稳定性较弱的是___________ (填化学式)。②和③形成的一种化合物为淡黄色固体,该化合物的电子式为___________ 。
(2)元素③、④、⑤的离子半径由大到小的顺序为___________ (填离子符号)。
(3)写出实验室制取⑤单质的化学方程式___________ 。
Ⅱ、现有部分短周期元素的性质与原子(或分子)结构如下表
(4)元素X在周期表中的位置是___________ 。
(5)工业上,将YTO3与Na2SO3溶液混合后,再加入H2SO4制备自来水的消毒剂TO2,Na2SO3被氧化为Na2SO4,该反应的离子方程式___________ 。
(6)Z单质与Y的最高价氧化物对应水化物的溶液发生反应的化学方程式___________ 。
(7)下列说法能够证明Y的金属性比Z强的是___________ 。
A.Z离子的氧化性比Y离子的氧化性弱
B.Y的最高价氧化物的水化物的碱性比Z的最高价氧化物的水化物碱性强
C.1 mol Y从足量的稀硫酸中置换出的氢气比1 mol Z置换出的氢气多
D.Y在常温下能与水反应,而Z不能
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ |
(2)元素③、④、⑤的离子半径由大到小的顺序为
(3)写出实验室制取⑤单质的化学方程式
Ⅱ、现有部分短周期元素的性质与原子(或分子)结构如下表
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 元素的最高正价与最低负价的代数和为6 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
(5)工业上,将YTO3与Na2SO3溶液混合后,再加入H2SO4制备自来水的消毒剂TO2,Na2SO3被氧化为Na2SO4,该反应的离子方程式
(6)Z单质与Y的最高价氧化物对应水化物的溶液发生反应的化学方程式
(7)下列说法能够证明Y的金属性比Z强的是
A.Z离子的氧化性比Y离子的氧化性弱
B.Y的最高价氧化物的水化物的碱性比Z的最高价氧化物的水化物碱性强
C.1 mol Y从足量的稀硫酸中置换出的氢气比1 mol Z置换出的氢气多
D.Y在常温下能与水反应,而Z不能
您最近一年使用:0次
7 . 次磷酸钙[Ca(H2PO2)2,该化合物中H是+1价,O是-2价]可用作阻燃剂,食品添加剂和动物营养剂,制备次磷酸钙的反应化学方程式为:Ca(OH)2+P4+H2O→Ca(H2PO2)2+PH3↑(未配平),下列说法错误的是
| A.Ca(H2PO2)2为氧化产物 |
| B.氧化剂与还原剂物质的量之比为1:3 |
| C.生成1molPH3消耗31gP4 |
| D.次磷酸钙具有还原性 |
您最近一年使用:0次
2021-01-15更新
|
261次组卷
|
2卷引用:辽宁省丹东市2020-2021学年高一上学期期末考试化学试题
8 . 二氧化氯(ClO2)是一种优良的消毒剂,可用氯酸钠和双氧水在酸性条件下制备,反应方程式为NaClO3H2O2H2SO4ClO2Na2SO4H2OO2(未配平)。下列说法不正确的是
| A.NaClO3做氧化剂,发生还原反应 |
| B.将该方程式配平后H2O的化学计量数应为2 |
| C.NaClO3与H2O2的化学计量系数之比为2:1 |
| D.反应过程中每生成2.24LO2转移0.2mol电子 |
您最近一年使用:0次
2020-11-10更新
|
833次组卷
|
7卷引用:辽宁省东北师范大学连山实验高中2022-2023学年高一上学期1月期末化学试题
辽宁省东北师范大学连山实验高中2022-2023学年高一上学期1月期末化学试题黑龙江省富锦市第一中学2022-2023学年高一上学期期末考试化学试题黑龙江省鹤岗市第一中学2022-2023学年高一上学期期末考试化学试题 湖南省长沙市长郡教育集团2020-2021学年高一上学期期中考试化学试题湖南省长沙市长郡中学2020-2021学年高一上学期期中考试化学试题(已下线)第二章 海水中的重要元素——钠和氯(A卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)黑龙江省鹤岗市第一中学2022-2023学年高一下学期开学考试化学试题
9 . 氮的氧化物和硫的氧化物是主要的大气污染物,烟气脱硫脱硝是环境治理的热点问题。回答下列问题:
(1)目前柴油汽车都用尿素水解液消除汽车尾气中的NO,水解液中的NH3将NO还原为无害的物质。该反应中氧化剂与还原剂物质的量之比为___ 。
(2)KMnO4/CaCO3浆液可协同脱硫,在反应中MnO4-被还原为MnO 。
。
①KMnO4脱硫(SO2)的离子方程式为___ 。
②KMnO4/CaCO3浆液中KMnO4与CaCO3最合适的物质的量之比为___ 。
(3)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液pH对脱硫脱硝的影响如图所示:

图a和图b中可知脱硫脱硝最佳条件是___ 。
(1)目前柴油汽车都用尿素水解液消除汽车尾气中的NO,水解液中的NH3将NO还原为无害的物质。该反应中氧化剂与还原剂物质的量之比为
(2)KMnO4/CaCO3浆液可协同脱硫,在反应中MnO4-被还原为MnO
 。
。①KMnO4脱硫(SO2)的离子方程式为
②KMnO4/CaCO3浆液中KMnO4与CaCO3最合适的物质的量之比为
(3)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液pH对脱硫脱硝的影响如图所示:

图a和图b中可知脱硫脱硝最佳条件是
您最近一年使用:0次
解题方法
10 . 酸性或碱性溶液中铝均可与NO 发生氧化还原反应,转化关系如图:
发生氧化还原反应,转化关系如图:
已知:气体D和A溶液反应生成白色沉淀,气体D和F反应可生成盐。

请回答下列问题:
(1)写出铝在碱性条件下与NO 反应的离子方程式
反应的离子方程式_________ 。
(2)在酸性条件下,被还原的NO 与Al的物质的量之比是
与Al的物质的量之比是_______ 。
(3)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C和E都转化为无毒的气态单质,请写出D和C反应的化学方程式:____________ 。
 发生氧化还原反应,转化关系如图:
发生氧化还原反应,转化关系如图:已知:气体D和A溶液反应生成白色沉淀,气体D和F反应可生成盐。

请回答下列问题:
(1)写出铝在碱性条件下与NO
 反应的离子方程式
反应的离子方程式(2)在酸性条件下,被还原的NO
 与Al的物质的量之比是
与Al的物质的量之比是(3)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C和E都转化为无毒的气态单质,请写出D和C反应的化学方程式:
您最近一年使用:0次



