解题方法
1 . 某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。已知:铜与稀硝酸反应,金和稀硝酸不反应。回答下列问题:
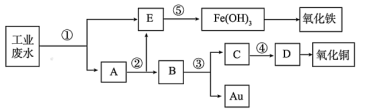
(1)图中标号处需加入的相应物质分别是①___________ 、②___________ (均写物质名称)。
(2)③处加入的物质为稀硝酸,化学反应为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,请用单线桥标明电子转移方向及数目___________ 。
(3)在浓度相等的条件下,Fe3+、Cu2+、Au3+氧化性由强到弱的顺序为___________ 。
(4)⑤处的总离子方程式为: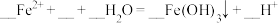 ,请补全缺项并配平
,请补全缺项并配平___________ ;该反应的现象为___________ 。

(1)图中标号处需加入的相应物质分别是①
(2)③处加入的物质为稀硝酸,化学反应为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,请用单线桥标明电子转移方向及数目
(3)在浓度相等的条件下,Fe3+、Cu2+、Au3+氧化性由强到弱的顺序为
(4)⑤处的总离子方程式为:
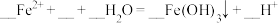 ,请补全缺项并配平
,请补全缺项并配平
您最近一年使用:0次
2 . 从酸性含铬废水(主要阴离子为 )中回收铬元素(
)中回收铬元素( )的部分工艺流程如图所示。
)的部分工艺流程如图所示。
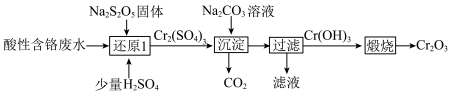
下列有关说法正确的是
 )中回收铬元素(
)中回收铬元素( )的部分工艺流程如图所示。
)的部分工艺流程如图所示。
下列有关说法正确的是
| A.“过滤”时需用玻璃棒搅拌 |
| B.“煅烧”过程中发生了氧化还原反应 |
C.若分别用 、 、 还原等量的 还原等量的 ,消耗 ,消耗 与 与 的物质的量之比为1∶3 的物质的量之比为1∶3 |
D.“还原1”时反应的离子方程式为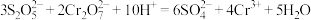 |
您最近一年使用:0次
2024-01-08更新
|
266次组卷
|
6卷引用:辽宁省朝阳市建平县第二高级中学2023-2024学年高一上学期1月期末化学试题
解题方法
3 . 高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,已知K2FeO4在Fe3+催化下会分解,在强碱性条件下稳定。高铁酸钾(K2FeO4)生产流程如图:
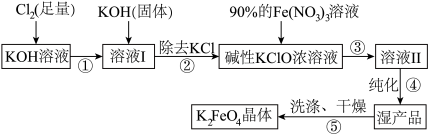
(1)在溶液Ⅰ中加入KOH固体的目的是 。
(2)写出③反应的离子方程式_______ 。
(3)制备K2FeO4时,将90%的Fe(NO3)3溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是_______ 。
(4)K2FeO4在酸性或弱碱性条件下能与水反应生成一种胶体和一种氧化性气体单质,该气体单质为_______ (写出化学式)。
(5)K2FeO4净水时能吸附悬浮物的原因是_______ 。

(1)在溶液Ⅰ中加入KOH固体的目的是 。
| A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高KClO产率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为KClO |
(2)写出③反应的离子方程式
(3)制备K2FeO4时,将90%的Fe(NO3)3溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是
(4)K2FeO4在酸性或弱碱性条件下能与水反应生成一种胶体和一种氧化性气体单质,该气体单质为
(5)K2FeO4净水时能吸附悬浮物的原因是
您最近一年使用:0次
名校
4 . 不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示,
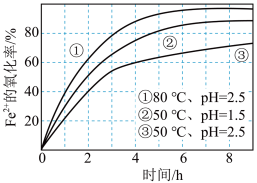
| A.Fe2+的氧化率随时间延长而逐渐增大 |
| B.由②和③可知,pH越大,Fe2+氧化速率不一定越快 |
| C.由①和③可知,温度越高,Fe2+氧化速率越快 |
| D.氧化过程的离子方程式为:4Fe2++O2+2H2O=4Fe3++4OH- |
您最近一年使用:0次
5 . 高铁酸钾(K2FeO4)是一种既能杀菌 消毒、又能絮凝净水的水处理剂,工业制备高铁酸钾的离子方程式为Fe(OH)3+ClO-+OH-
 +Cl-+H2O (未配平)。下列有关说法不正确的是
+Cl-+H2O (未配平)。下列有关说法不正确的是

 +Cl-+H2O (未配平)。下列有关说法不正确的是
+Cl-+H2O (未配平)。下列有关说法不正确的是A.由上述反应可知,FeO 的氧化性强于ClO- 的氧化性强于ClO- |
| B.生成0.4molCl-时转移电子数0.8NA |
| C.上述反应中氧化剂和还原剂的物质的量之比为3∶2 |
D.K2FeO4处理水的原理可为:  |
您最近一年使用:0次
2023-11-17更新
|
316次组卷
|
3卷引用:辽宁省沈阳市重点高中五校协作体2023-2024学年高一上学期1月期末化学试题
名校
解题方法
6 . 硫代硫酸钠( )常用作分析试剂及还原剂,易溶于水,某实验小组用如图装置(夹持、加热仪器己略去)制备硫代硫酸钠并测定其纯度。
)常用作分析试剂及还原剂,易溶于水,某实验小组用如图装置(夹持、加热仪器己略去)制备硫代硫酸钠并测定其纯度。
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若__________ ,则整个装置气密性良好。
(2)仪器C的名称是__________ ;装置D的作用是__________ 。
(3)装置A中发生反应的化学方程式为__________ 。
(4)装置C中的反应分两步:第一步通入 后溶液中
后溶液中 浓度明显增大,则第一步反应的离子方程式为
浓度明显增大,则第一步反应的离子方程式为__________ ;第二步反应为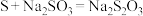 ,已知第二步反应相对较慢,则装置C中反应达到终点的现象是
,已知第二步反应相对较慢,则装置C中反应达到终点的现象是__________ 。
(5)将制得的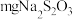 样品溶于水,加入
样品溶于水,加入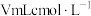 碘水溶液时,二者恰好完全反应(
碘水溶液时,二者恰好完全反应( ),则样品的纯度为
),则样品的纯度为__________ 。
 )常用作分析试剂及还原剂,易溶于水,某实验小组用如图装置(夹持、加热仪器己略去)制备硫代硫酸钠并测定其纯度。
)常用作分析试剂及还原剂,易溶于水,某实验小组用如图装置(夹持、加热仪器己略去)制备硫代硫酸钠并测定其纯度。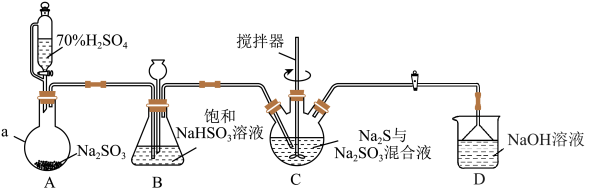
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若
(2)仪器C的名称是
(3)装置A中发生反应的化学方程式为
(4)装置C中的反应分两步:第一步通入
 后溶液中
后溶液中 浓度明显增大,则第一步反应的离子方程式为
浓度明显增大,则第一步反应的离子方程式为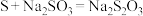 ,已知第二步反应相对较慢,则装置C中反应达到终点的现象是
,已知第二步反应相对较慢,则装置C中反应达到终点的现象是(5)将制得的
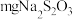 样品溶于水,加入
样品溶于水,加入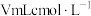 碘水溶液时,二者恰好完全反应(
碘水溶液时,二者恰好完全反应( ),则样品的纯度为
),则样品的纯度为
您最近一年使用:0次
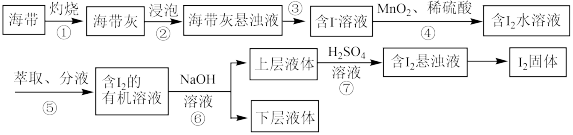
7 . 溴、碘主要存在于海水里,有“海洋元素”的美称。我国海带产量位居世界第一,海带除供食用外,还可大量用于制碘。从海带中提取碘单质的工艺流程如图。请回答下列问题:_____ (填氢化物的化学式),位于元素周期表前五周期的第ⅦA族元素对应的单质的氧化性由强到弱的顺序为_____ (填化学式), 的空间结构为
的空间结构为_____ 。
(2)步骤④发生反应的离子方程式为_____ (已知: 转化为
转化为 ),此步骤中“
),此步骤中“ 、稀硫酸”可用
、稀硫酸”可用_____ (填标号)代替。
A. B.
B. 、稀硫酸 C.
、稀硫酸 C.
(3)步骤⑤所用的仪器主要是分液漏斗(如图所示)。
a.把20mL碘水与5mL萃取剂加入分液漏斗中,并盖好玻璃塞;
b.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
c.把盛有溶液的分液漏斗放在铁架台的铁圈中,静置、分层。
d.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
e.旋开活塞,用烧杯接收下层溶液,从分液漏斗上口倒出上层溶液。
步骤⑥使用的是反萃取法,目的是富集碘元素,利用空气吹出法从海水中提取溴时若采用酸液吸收法,可选用_____ 吸收含溴单质的空气来达到富集溴元素的目的。
 的空间结构为
的空间结构为(2)步骤④发生反应的离子方程式为
 转化为
转化为 ),此步骤中“
),此步骤中“ 、稀硫酸”可用
、稀硫酸”可用A.
 B.
B. 、稀硫酸 C.
、稀硫酸 C.
(3)步骤⑤所用的仪器主要是分液漏斗(如图所示)。

a.把20mL碘水与5mL萃取剂加入分液漏斗中,并盖好玻璃塞;
b.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
c.把盛有溶液的分液漏斗放在铁架台的铁圈中,静置、分层。
d.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
e.旋开活塞,用烧杯接收下层溶液,从分液漏斗上口倒出上层溶液。
步骤⑥使用的是反萃取法,目的是富集碘元素,利用空气吹出法从海水中提取溴时若采用酸液吸收法,可选用
您最近一年使用:0次
名校
8 . 工业上用含三价钒( )为主的某石煤为原料(含有
)为主的某石煤为原料(含有 、
、 等杂质),钙化法焙烧制备
等杂质),钙化法焙烧制备 ,其流程如下:
,其流程如下: 价钒在溶液中的主要存在形式与溶液pH的关系:
价钒在溶液中的主要存在形式与溶液pH的关系:
(1)焙烧:向石煤中加生石灰焙烧,利用空气中的氧气将 转化为
转化为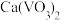 。在该过程中,
。在该过程中, 与
与 的物质量之比为
的物质量之比为_______ 。
(2)酸浸:已知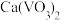 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的
难溶于水,可溶于盐酸。若焙砂酸浸时溶液的 ,此时
,此时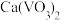 溶于盐酸的离子方程式是
溶于盐酸的离子方程式是_______ 。
(3)转沉:将浸出液中的钒转化为 固体,其流程如下:
固体,其流程如下:_______ 。
②向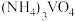 溶液中加入
溶液中加入 溶液,控制溶液的
溶液,控制溶液的 。当
。当 时,
时, 的产量明显降低,原因是
的产量明显降低,原因是_______ 。
(4)煅烧:煅烧时生成 的化学方程式是
的化学方程式是_______ 。
(5)测定产品中 的纯度:称取
的纯度:称取 产品,先用硫酸溶解,得到
产品,先用硫酸溶解,得到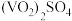 溶液。再加入
溶液。再加入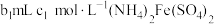 溶液。过量的
溶液。过量的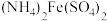 恰好能与
恰好能与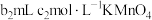 溶液完全反应。
溶液完全反应。
已知:ⅰ.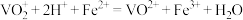 ;
;
ⅱ.测定过程中 被
被 还原为
还原为 。
。
假设杂质不参与反应,则产品中 的质量分数是
的质量分数是_______ 。
 )为主的某石煤为原料(含有
)为主的某石煤为原料(含有 、
、 等杂质),钙化法焙烧制备
等杂质),钙化法焙烧制备 ,其流程如下:
,其流程如下:
 价钒在溶液中的主要存在形式与溶液pH的关系:
价钒在溶液中的主要存在形式与溶液pH的关系:| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 |  |  |  |  |
 转化为
转化为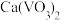 。在该过程中,
。在该过程中, 与
与 的物质量之比为
的物质量之比为(2)酸浸:已知
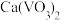 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的
难溶于水,可溶于盐酸。若焙砂酸浸时溶液的 ,此时
,此时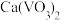 溶于盐酸的离子方程式是
溶于盐酸的离子方程式是(3)转沉:将浸出液中的钒转化为
 固体,其流程如下:
固体,其流程如下:
②向
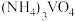 溶液中加入
溶液中加入 溶液,控制溶液的
溶液,控制溶液的 。当
。当 时,
时, 的产量明显降低,原因是
的产量明显降低,原因是(4)煅烧:煅烧时生成
 的化学方程式是
的化学方程式是(5)测定产品中
 的纯度:称取
的纯度:称取 产品,先用硫酸溶解,得到
产品,先用硫酸溶解,得到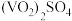 溶液。再加入
溶液。再加入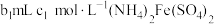 溶液。过量的
溶液。过量的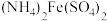 恰好能与
恰好能与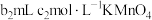 溶液完全反应。
溶液完全反应。已知:ⅰ.
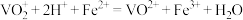 ;
;ⅱ.测定过程中
 被
被 还原为
还原为 。
。假设杂质不参与反应,则产品中
 的质量分数是
的质量分数是
您最近一年使用:0次
9 . 化石燃料的综合利用既能减少污染,又能提高资源利用率。回答下列问题:
(1)煤的气化是将煤转化为气体燃料,其中重要的一步反应是高温下焦炭与水蒸气反应制备水煤气(CO、H2),该反应的化学方程式为___________ 。
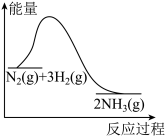
(2)合成氨工业是煤化工产业链中非常重要的一步。合成氨反应过程中的能量变化如图所示,则该反应为___________ (填“吸热”或“放热”)反应。
(3)实验室模拟工业合成氨,向2L恒容密闭容器内充入1molN2反应过程和3molH2,在一定条件下发生反应。若经过5min后,测得容器内NH3的物质的量为1mol,则这段时间内,v(N2)=___________ ,此时容器内H2的物质的量浓度为___________ 。
(4)天然气的主要成分是CH4.在酸性介质中,利用反应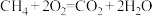 可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示(其中质子交换膜只允许H+通过):
可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示(其中质子交换膜只允许H+通过):
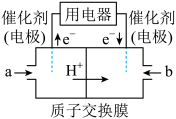
通入b气体的电极名称为___________ ,通入a气体的电极上反应式为___________ 。
(1)煤的气化是将煤转化为气体燃料,其中重要的一步反应是高温下焦炭与水蒸气反应制备水煤气(CO、H2),该反应的化学方程式为
(2)合成氨工业是煤化工产业链中非常重要的一步。合成氨反应过程中的能量变化如图所示,则该反应为

(3)实验室模拟工业合成氨,向2L恒容密闭容器内充入1molN2反应过程和3molH2,在一定条件下发生反应。若经过5min后,测得容器内NH3的物质的量为1mol,则这段时间内,v(N2)=
(4)天然气的主要成分是CH4.在酸性介质中,利用反应
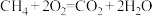 可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示(其中质子交换膜只允许H+通过):
可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示(其中质子交换膜只允许H+通过):
通入b气体的电极名称为
您最近一年使用:0次
2023-07-16更新
|
114次组卷
|
2卷引用:辽宁省鞍山市台安县高级中学2022-2023学年高一下学期期末考试化学试题
解题方法
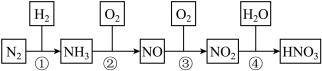
10 . 硝酸是一种具有强氧化性、腐蚀性的一元无机强酸,它也是一种重要的化工原料。氨氧化法生产硝酸是世界上生产硝酸的主要方法,其制备过程如图所示,回答下列问题:
(2)将装有50mLNO2、NO混合气体的量筒倒立在水槽中,反应后气体体积缩小为30mL,则原混合气体中NO2和NO的体积比是_______ 。
(3)热电厂通常用NH3消除燃煤烟气中的NO2,生成两种无污染的产物,写出该反应的化学方程式:_______ 。
(4)制备过程中②是氨的催化氧化反应,化学研究小组将经加热的铂丝插入锥形瓶内(如图所示),此时锥形瓶相当于氧化炉,可观察到铂丝保持红热,瓶口有红棕色气体生成,写出氨的催化氧化反应的化学方程式:_______ ,该反应_______ (填“吸热”或“放热”)。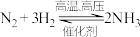 ,恒温下,在2L恒容密闭容器中,通入1molN2和3molH2的混合气体模拟工业上合成氨。
,恒温下,在2L恒容密闭容器中,通入1molN2和3molH2的混合气体模拟工业上合成氨。
①下列情况不能 说明N2与H2反应一定达到化学平衡状态的是_______ (填标号)。
A.NH3的质量不再变化 B.单位时间内消耗1molN2同时生成3molH2
C.容器内的压强不再变化 D.容器内N2、H2和NH3的分子数之比为1:3:2
②若2min末测得容器内NH3的物质的量为0.6mol,则
_______ mol·L-1·min-1。
(6)足量的铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、NO2的混合气体,这些气体与1.12LO2(标准状况下)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是_______  。
。
| A. NO2易溶于水生成HNO3,故NO2是酸性氧化物 |
| B.N2与O2反应时,不论O2是否足量,其一步反应都只能得到NO,不能生成NO2 |
| C.常温常压下,无色的NO能与空气中的O2直接化合生成红棕色的NO2 |
| D.在NO2与水的反应中,氧化剂与还原剂的质量之比为2:1 |
(3)热电厂通常用NH3消除燃煤烟气中的NO2,生成两种无污染的产物,写出该反应的化学方程式:
(4)制备过程中②是氨的催化氧化反应,化学研究小组将经加热的铂丝插入锥形瓶内(如图所示),此时锥形瓶相当于氧化炉,可观察到铂丝保持红热,瓶口有红棕色气体生成,写出氨的催化氧化反应的化学方程式:

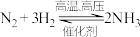 ,恒温下,在2L恒容密闭容器中,通入1molN2和3molH2的混合气体模拟工业上合成氨。
,恒温下,在2L恒容密闭容器中,通入1molN2和3molH2的混合气体模拟工业上合成氨。①下列情况
A.NH3的质量不再变化 B.单位时间内消耗1molN2同时生成3molH2
C.容器内的压强不再变化 D.容器内N2、H2和NH3的分子数之比为1:3:2
②若2min末测得容器内NH3的物质的量为0.6mol,则
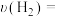
(6)足量的铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、NO2的混合气体,这些气体与1.12LO2(标准状况下)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
 。
。
您最近一年使用:0次



