名校
解题方法
1 . 下列化学反应表示正确的是
| A.向碘化钾中通入过量氯气:2I- + Cl2 = 2Cl- + I2 |
| B.向稀硝酸中加入过量铁粉:3Fe + 8HNO3=3Fe(NO3)2 + 2NO↑ +4H2O |
| C.氯化亚铁溶液中加入少量过氧化钠:4Fe2+ + 4Na2O2 + 6H2O =4Fe(OH)3↓ + 8Na+ + O2↑ |
D.硫酸铵溶液和氢氧化钡溶液反应:NH + SO + SO + Ba2+ + OH−= BaSO4↓+NH3·H2O + Ba2+ + OH−= BaSO4↓+NH3·H2O |
您最近一年使用:0次
名校
解题方法
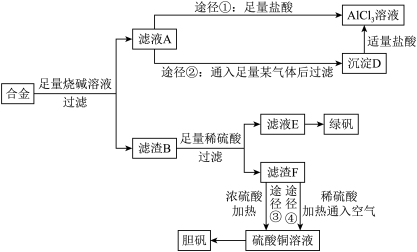
2 . 某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体[ ]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式_______ 。
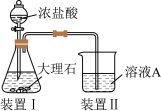
(2)进行途径②时,该小组用下图所示装置及试剂,将制得的 气体通入滤液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是
气体通入滤液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是_______ (用离子方程式表示);为了避免沉淀D减少,应该在装置Ⅰ和装置Ⅱ之间增加一个盛有_______ 的洗气瓶。
(3)通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、蒸发浓缩、冷却结晶、过滤、自然干燥。其中“加热通氧气”所起的作用为_______ (用离子方程式表示)。
(4)白磷有剧毒,不慎沾到皮肤上,可取少量胆矾配制成 溶液冲洗解毒。白磷可与热的
溶液冲洗解毒。白磷可与热的 溶液反应生成
溶液反应生成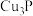 ,与冷溶液则析出Cu,反应方程式分别(均未配平)为:
,与冷溶液则析出Cu,反应方程式分别(均未配平)为:
①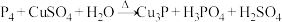
②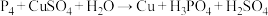
若上述两反应中被氧化的 的物质的量相等,则消耗的
的物质的量相等,则消耗的 的物质的量之比为
的物质的量之比为_______ 。
(5)将绿矾加热失去结晶水后的产物 ,进行如下转化(无关物质已略去)
,进行如下转化(无关物质已略去)
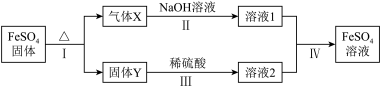
已知:X由两种化合物组成,将X通入氯水,溶液褪色;通入 溶液,产生白色沉淀。Y是红棕色的化合物。
溶液,产生白色沉淀。Y是红棕色的化合物。
①请写出X使氯水褪色所发生的反应的化学方程式_______ 。
②若经反应Ⅰ得到16g固体Y,产生的气体X恰好被0.4L1mol/L NaOH溶液完全吸收,则反应Ⅳ中生成 的离子方程式是
的离子方程式是_______ 。
 ]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式
(2)进行途径②时,该小组用下图所示装置及试剂,将制得的
 气体通入滤液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是
气体通入滤液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是
(3)通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、蒸发浓缩、冷却结晶、过滤、自然干燥。其中“加热通氧气”所起的作用为
(4)白磷有剧毒,不慎沾到皮肤上,可取少量胆矾配制成
 溶液冲洗解毒。白磷可与热的
溶液冲洗解毒。白磷可与热的 溶液反应生成
溶液反应生成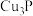 ,与冷溶液则析出Cu,反应方程式分别(均未配平)为:
,与冷溶液则析出Cu,反应方程式分别(均未配平)为:①
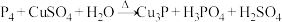
②
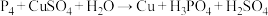
若上述两反应中被氧化的
 的物质的量相等,则消耗的
的物质的量相等,则消耗的 的物质的量之比为
的物质的量之比为(5)将绿矾加热失去结晶水后的产物
 ,进行如下转化(无关物质已略去)
,进行如下转化(无关物质已略去)
已知:X由两种化合物组成,将X通入氯水,溶液褪色;通入
 溶液,产生白色沉淀。Y是红棕色的化合物。
溶液,产生白色沉淀。Y是红棕色的化合物。①请写出X使氯水褪色所发生的反应的化学方程式
②若经反应Ⅰ得到16g固体Y,产生的气体X恰好被0.4L1mol/L NaOH溶液完全吸收,则反应Ⅳ中生成
 的离子方程式是
的离子方程式是
您最近一年使用:0次
名校
解题方法
3 . 某溶液仅含 、
、 、
、 、
、 、
、 、
、 、
、 中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
 、
、 、
、 、
、 、
、 、
、 、
、 中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是| A.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
B.加入稀硫酸发生反应的离子方程式为: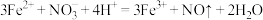 |
C.该溶液中一定有 |
| D.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
您最近一年使用:0次
2023-01-04更新
|
599次组卷
|
3卷引用:辽宁省沈阳市第一二0中学2022-2023学年高一上学期期末考试化学试题
辽宁省沈阳市第一二0中学2022-2023学年高一上学期期末考试化学试题(已下线)重难点01 浓硫酸、浓硝酸的性质与反应计算-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)浙江省金华市2023-2024学年高一上学期1月期末化学试题
解题方法
4 . 羟基氧化铁 是一种重要的化工原料,一种以工厂废料(含
是一种重要的化工原料,一种以工厂废料(含 、
、 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
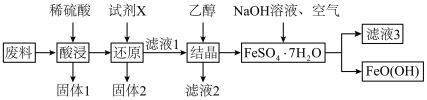
已知: 为酸性氧化物,不与硫酸等强酸反应;
为酸性氧化物,不与硫酸等强酸反应; 易溶于水,难溶于乙醇。
易溶于水,难溶于乙醇。
(1)羟基氧化铁中铁元素的化合价是_______ ,“固体1”的主要成分是_______ 。
(2)“酸浸”时 与硫酸发生反应的离子方程式为
与硫酸发生反应的离子方程式为_______ 。“试剂X”宜选择的是_______ 。
A.双氧水 B.铁粉 C.铜粉 D.钠块
(3)“结晶”时加入乙醇即可析出 晶体,乙醇的作用是
晶体,乙醇的作用是_______ 。
(4)将 配制成一定浓度的溶液,恒温条件下边搅拌边按一定比例加入
配制成一定浓度的溶液,恒温条件下边搅拌边按一定比例加入 溶液,同时鼓入空气进行氧化,至反应液全部变为棕黄色悬浊液,即可得到
溶液,同时鼓入空气进行氧化,至反应液全部变为棕黄色悬浊液,即可得到 。该反应的离子方程式为
。该反应的离子方程式为_______ 。
(5)“滤液3”中,溶质的主要成分是_______ (写化学式)。
 是一种重要的化工原料,一种以工厂废料(含
是一种重要的化工原料,一种以工厂废料(含 、
、 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
已知:
 为酸性氧化物,不与硫酸等强酸反应;
为酸性氧化物,不与硫酸等强酸反应; 易溶于水,难溶于乙醇。
易溶于水,难溶于乙醇。(1)羟基氧化铁中铁元素的化合价是
(2)“酸浸”时
 与硫酸发生反应的离子方程式为
与硫酸发生反应的离子方程式为A.双氧水 B.铁粉 C.铜粉 D.钠块
(3)“结晶”时加入乙醇即可析出
 晶体,乙醇的作用是
晶体,乙醇的作用是(4)将
 配制成一定浓度的溶液,恒温条件下边搅拌边按一定比例加入
配制成一定浓度的溶液,恒温条件下边搅拌边按一定比例加入 溶液,同时鼓入空气进行氧化,至反应液全部变为棕黄色悬浊液,即可得到
溶液,同时鼓入空气进行氧化,至反应液全部变为棕黄色悬浊液,即可得到 。该反应的离子方程式为
。该反应的离子方程式为(5)“滤液3”中,溶质的主要成分是
您最近一年使用:0次
解题方法
5 . 探究化学反应速率的影响因素,对工农业生产有着非常重要的意义。为探究反应速率与 溶液浓度的关系,利用下列装置(夹持仪器略去)进行实验。
溶液浓度的关系,利用下列装置(夹持仪器略去)进行实验。
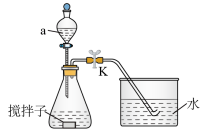
实验步骤:往锥形瓶中加入一定体积的
 溶液、
溶液、
 溶液和水,充分搅拌。控制体系温度,通过
溶液和水,充分搅拌。控制体系温度,通过 往锥形瓶中加入一定浓度的醋酸,发生反应:
往锥形瓶中加入一定浓度的醋酸,发生反应: 。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集
。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集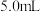
 所需时间。回答下列问题:
所需时间。回答下列问题:
(1)仪器a的名称为_______ 。
(2)若需控制体系的温度为36℃,采取的合理加热方式为_______ 。
(3)每组实验过程的实验数据如下表所示:
i.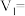
_______ ,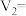
_______ 。
ii.该反应的速率方程为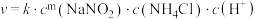 ,k为反应速率常数。利用实验数据计算得m=
,k为反应速率常数。利用实验数据计算得m=_______ (填整数)。
iii.醋酸的作用是_______ 。
(4)如果用同浓度的盐酸代替醋酸进行实验1, 与盐酸反应生成
与盐酸反应生成 ,
, 分解产生等物质的量的两种气体。反应结束后,锥形瓶中红棕色气体逐渐变浅。
分解产生等物质的量的两种气体。反应结束后,锥形瓶中红棕色气体逐渐变浅。 分解的化学方程式为
分解的化学方程式为_______ 。
 溶液浓度的关系,利用下列装置(夹持仪器略去)进行实验。
溶液浓度的关系,利用下列装置(夹持仪器略去)进行实验。
实验步骤:往锥形瓶中加入一定体积的

 溶液、
溶液、
 溶液和水,充分搅拌。控制体系温度,通过
溶液和水,充分搅拌。控制体系温度,通过 往锥形瓶中加入一定浓度的醋酸,发生反应:
往锥形瓶中加入一定浓度的醋酸,发生反应: 。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集
。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集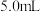
 所需时间。回答下列问题:
所需时间。回答下列问题:(1)仪器a的名称为
(2)若需控制体系的温度为36℃,采取的合理加热方式为
(3)每组实验过程的实验数据如下表所示:
| 实验编号 | 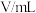 | 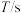 | |||
 溶液 溶液 |  溶液 溶液 | 醋酸 | 水 | ||
| 1 | 4.0 |  | 4.0 | 8.0 | 340 |
| 2 | 6.0 | 4.0 | 4.0 |  | 151 |
| 3 | 8.0 | 4.0 | 4.0 | 4.0 | 85 |
| 4 | 12.0 | 4.0 | 4.0 | 0.0 | 38 |
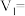
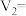
ii.该反应的速率方程为
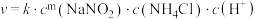 ,k为反应速率常数。利用实验数据计算得m=
,k为反应速率常数。利用实验数据计算得m=iii.醋酸的作用是
(4)如果用同浓度的盐酸代替醋酸进行实验1,
 与盐酸反应生成
与盐酸反应生成 ,
, 分解产生等物质的量的两种气体。反应结束后,锥形瓶中红棕色气体逐渐变浅。
分解产生等物质的量的两种气体。反应结束后,锥形瓶中红棕色气体逐渐变浅。 分解的化学方程式为
分解的化学方程式为
您最近一年使用:0次
2022-12-17更新
|
268次组卷
|
2卷引用:辽宁省鞍山市一般高中协作校2022-2023学年高一下学期期末考试化学试题
名校
6 . V(钒)能形成多种不同颜色的离子,其转化关系如图所示(注:图中所加试剂均足量),下列说法正确的是
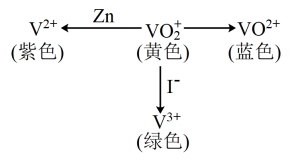

| A.图中转化关系只有部分存在电子转移 |
| B.由图中转化可知,I-比Zn还原性强 |
C.可加入氧化剂实现 溶液由黄色转化为蓝色 溶液由黄色转化为蓝色 |
D.V(钒)有 、 、 、 、 、 、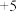 等多种化合价 等多种化合价 |
您最近一年使用:0次
2022-09-02更新
|
607次组卷
|
5卷引用:辽宁省鞍山市普通高中2021-2022学年高一上学期期末质量监测化学试题
解题方法
7 . 中国“奋斗者”号深潜器研制及海试的成功,标志着我国在钛合金材料制备方面实现了重大突破。工业上用钛矿石(主要成分: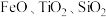 等)为原料制取钛并得到副产物绿矾(
等)为原料制取钛并得到副产物绿矾( ),工艺流程如下:
),工艺流程如下:
② 易水解,只能存在于强酸性溶液中
易水解,只能存在于强酸性溶液中
请回答以下问题:
(1)钛矿石在加入浓硫酸酸溶前要先粉碎,其目的是_______ 。
(2)加入适量铁粉的目的是_______ 。操作1名称为_______ 。
(3)固体2的主要成分是_______ 。
(4)在高温下, 和焦炭的混合物中通入
和焦炭的混合物中通入 得到
得到 和一种可燃性气体,请写出反应的化学方程式
和一种可燃性气体,请写出反应的化学方程式_______ 。
(5)用过量的钠在高温条件下与 反应可制得钛,写出此反应的化学方程式
反应可制得钛,写出此反应的化学方程式_______ 。该反应必须在高温下进行,你认为还应该控制的反应条件是_______ 。
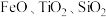 等)为原料制取钛并得到副产物绿矾(
等)为原料制取钛并得到副产物绿矾( ),工艺流程如下:
),工艺流程如下: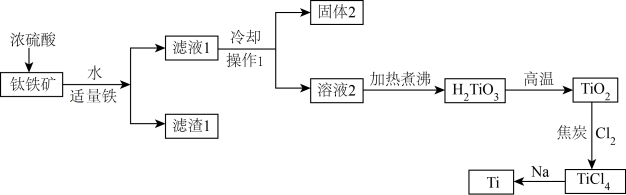

②
 易水解,只能存在于强酸性溶液中
易水解,只能存在于强酸性溶液中请回答以下问题:
(1)钛矿石在加入浓硫酸酸溶前要先粉碎,其目的是
(2)加入适量铁粉的目的是
(3)固体2的主要成分是
(4)在高温下,
 和焦炭的混合物中通入
和焦炭的混合物中通入 得到
得到 和一种可燃性气体,请写出反应的化学方程式
和一种可燃性气体,请写出反应的化学方程式(5)用过量的钠在高温条件下与
 反应可制得钛,写出此反应的化学方程式
反应可制得钛,写出此反应的化学方程式
您最近一年使用:0次
2022-07-20更新
|
521次组卷
|
4卷引用:辽宁省大连市2021-2022学年高一下学期期末考试化学试题
辽宁省大连市2021-2022学年高一下学期期末考试化学试题(已下线)综合突破02 期末压轴80题之非选择题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)河南省开封市杞县新世纪中学2022—2023学年高二上学期开学联考化学试题四川省青神中学校2022-2023学年高二下学期3月月考化学试题
8 . Ⅰ.已知下列物质均由短周期元素组成,X无论是盐酸还是氢氧化钠,转化均能进行,又已知C的相对分子质量比D少16,A、B、C、D、E中均含有同一元素。_______ 。
(2)当X是氢氧化钠溶液时,C的化学式_______ 。
(3)写出A和足量氢氧化钠在加热条件下反应的化学方程式_______ 。
Ⅱ.金属及其化合物用途广泛,研究金属的提取、冶炼意义重大。
(4)下列各组金属,冶炼方法一定不同的是_______ (填字母)。
a.Hg、Ag b.Na、Mg c.Al、Fe d.Na、Ca
(5)以铬铁矿(主要成分为FeO和 ,含有少量
,含有少量 、
、 等杂质)为主要原料生产化工原料重铬酸钠
等杂质)为主要原料生产化工原料重铬酸钠 并制取铬,其主要工艺流程如下:
并制取铬,其主要工艺流程如下: 氧化为
氧化为 。
。
①“操作②”是_______ 。
②工业上可用固体A制取粗硅,写出反应的化学方程式:_______ 。
③写出溶液D转化为溶液E过程中反应的离子方程式:_______ 。
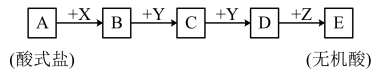
(2)当X是氢氧化钠溶液时,C的化学式
(3)写出A和足量氢氧化钠在加热条件下反应的化学方程式
Ⅱ.金属及其化合物用途广泛,研究金属的提取、冶炼意义重大。
(4)下列各组金属,冶炼方法一定不同的是
a.Hg、Ag b.Na、Mg c.Al、Fe d.Na、Ca
(5)以铬铁矿(主要成分为FeO和
 ,含有少量
,含有少量 、
、 等杂质)为主要原料生产化工原料重铬酸钠
等杂质)为主要原料生产化工原料重铬酸钠 并制取铬,其主要工艺流程如下:
并制取铬,其主要工艺流程如下: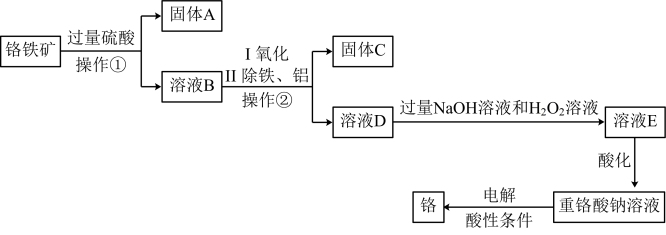
 氧化为
氧化为 。
。①“操作②”是
②工业上可用固体A制取粗硅,写出反应的化学方程式:
③写出溶液D转化为溶液E过程中反应的离子方程式:
您最近一年使用:0次
2022-07-19更新
|
483次组卷
|
4卷引用:辽宁省协作校2021-2022学年高一下学期期末考试化学试题
辽宁省协作校2021-2022学年高一下学期期末考试化学试题(已下线)专题06 化学与可持续发展-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)(已下线)暑假作业07 无机综合题、工艺流程题-【暑假分层作业】2024年高一化学暑假培优练(人教版2019必修第二册)河南省开封市杞县新世纪中学2022—2023学年高二上学期开学联考化学试题
解题方法
9 . 海洋资源的综合利用是21世纪海祥开发利用的重点发展领域之一、从海水中可以制取氯、溴、镁等多种化工产品。在元素周期表中,溴(Br)位于第四周期,与Cl同主族。氯气可用于海水提溴,其工艺流程如下:
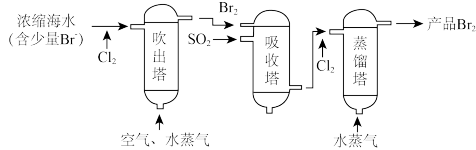
(1)进入吹出塔前海水中的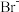 与
与 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(2)已知: 具有较强的氧化性,可氧化
具有较强的氧化性,可氧化 ,从吸收塔流出的溶液主要含
,从吸收塔流出的溶液主要含____ (写离子符号)。
(3)两次通入 的目的是富集浓缩溴,最终每获得
的目的是富集浓缩溴,最终每获得 ,理论上需消耗
,理论上需消耗_______ 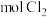 。
。
(4)某同学利用如图所示装置模拟吹出塔、吸收塔的实验,请回答下列问题:
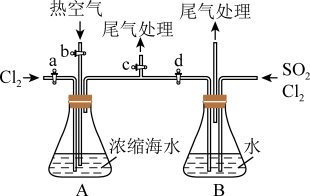
①进行吹出塔中实验时,应关闭活塞_______ ,打开活塞_______ 。
②可根据_______ (填现象),简单判断热空气的流速,通入热空气能吹出 的原因是
的原因是_______ 。
③装置B中要先通入 ,反应完全后再通入
,反应完全后再通入 ,简单判断通入的
,简单判断通入的 ,已反应完全的依据:
,已反应完全的依据:_______ 。

(1)进入吹出塔前海水中的
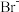 与
与 发生反应的离子方程式为
发生反应的离子方程式为(2)已知:
 具有较强的氧化性,可氧化
具有较强的氧化性,可氧化 ,从吸收塔流出的溶液主要含
,从吸收塔流出的溶液主要含(3)两次通入
 的目的是富集浓缩溴,最终每获得
的目的是富集浓缩溴,最终每获得 ,理论上需消耗
,理论上需消耗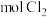 。
。(4)某同学利用如图所示装置模拟吹出塔、吸收塔的实验,请回答下列问题:

①进行吹出塔中实验时,应关闭活塞
②可根据
 的原因是
的原因是③装置B中要先通入
 ,反应完全后再通入
,反应完全后再通入 ,简单判断通入的
,简单判断通入的 ,已反应完全的依据:
,已反应完全的依据:
您最近一年使用:0次
2022-07-15更新
|
280次组卷
|
3卷引用:辽宁省辽阳市2021-2022学年高一下学期期末考试化学试题
解题方法
10 . 某校化学实验小组学生为了验证非金属元素氯的非金属性强于硫和氮,设计了一套实验装置如图(已知氯气能把氨气氧化生成氮气和氯化氢)。
(1)配平A中反应的化学方程式:_______ _______HCl(浓)+_______KMnO4=_______MnCl2+_______KCl+_______Cl2↑+_______ H2O。该反应中氧化剂与还原剂物质的量之比为_______ 。
(2)B中浸有NaOH溶液的棉花团的作用为_______ ;B中的现象为_______ ,由该现象得非金属性:Cl>>S。
(3)E中反应化学方程式为_______ 。
(4)D中出现白烟,涉及的反应化学方程式为_______ 、_______ 。
(5)有同学认为D中的现象并不能说明氯的非金属性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂为_______ (填名称)。
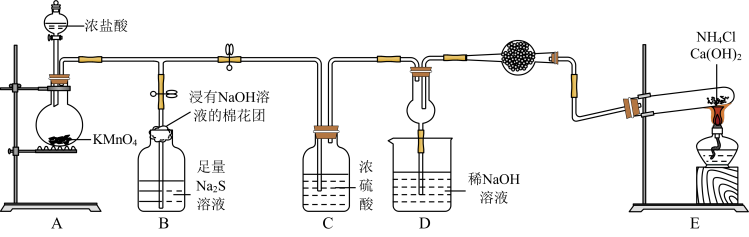
(1)配平A中反应的化学方程式:
(2)B中浸有NaOH溶液的棉花团的作用为
(3)E中反应化学方程式为
(4)D中出现白烟,涉及的反应化学方程式为
(5)有同学认为D中的现象并不能说明氯的非金属性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂为
您最近一年使用:0次
2022-07-14更新
|
419次组卷
|
4卷引用:辽宁省朝阳市建平县2021-2022学年高一下学期期末考试化学试题
辽宁省朝阳市建平县2021-2022学年高一下学期期末考试化学试题黑龙江省齐齐哈尔市八校联考2022-2023学年高一下学期期末考试化学试题(已下线)专题01 硫、氮、硅及其化合物-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)(已下线)暑假作业06 常见气体的制备-【暑假分层作业】2024年高一化学暑假培优练(人教版2019必修第二册)



