解题方法
1 . 纳米 是一种用途广泛的光电材料,工业上可以以氯化铁溶液腐蚀铜电路板废液(以下称“腐蚀液”,主要含
是一种用途广泛的光电材料,工业上可以以氯化铁溶液腐蚀铜电路板废液(以下称“腐蚀液”,主要含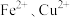 )为原料制备,实现变废为宝,路线如下:
)为原料制备,实现变废为宝,路线如下:
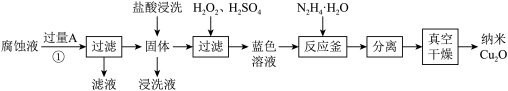
已知:a.当温度为60℃时,过氧化氢分解率为50%左右;
b. 中的
中的 元素为
元素为 价。
价。
请回答下列问题
(1)流程中的 为
为_______ (填化学式),①发生的反应的离子方程式为_______ ;
(2)“氧化”步骤为了加快反应速率可以适当升温,但不宜加热温度过高,原因是_______ ;
(3)为验证“反应釜”中反应已发生,可采用的实验操作是_______ ,从反应体系中分离出分散质_______ (填“能”或“不能”)选择过滤操作,理由是_______ ;
(4)发生反应时,“反应釜”中获得一种气体为空气主要成分,写出其中发生反应的离子方程式,并用单线桥法表示电子转移情况_______ ;
 是一种用途广泛的光电材料,工业上可以以氯化铁溶液腐蚀铜电路板废液(以下称“腐蚀液”,主要含
是一种用途广泛的光电材料,工业上可以以氯化铁溶液腐蚀铜电路板废液(以下称“腐蚀液”,主要含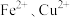 )为原料制备,实现变废为宝,路线如下:
)为原料制备,实现变废为宝,路线如下:
已知:a.当温度为60℃时,过氧化氢分解率为50%左右;
b.
 中的
中的 元素为
元素为 价。
价。请回答下列问题
(1)流程中的
 为
为(2)“氧化”步骤为了加快反应速率可以适当升温,但不宜加热温度过高,原因是
(3)为验证“反应釜”中反应已发生,可采用的实验操作是
(4)发生反应时,“反应釜”中获得一种气体为空气主要成分,写出其中发生反应的离子方程式,并用单线桥法表示电子转移情况
您最近一年使用:0次
名校
2 . 铁及其化合物在生产和生活中起到重要的作用。请回答下列问题:
(1)人体对 的吸收效果更好,但人体中时刻进行着
的吸收效果更好,但人体中时刻进行着 、
、 的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起
的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起_______ 剂。
(2)钢铁烤蓝是在钢铁表面形成一层一定厚度和强度的致密氧化膜,古代铁匠常用红热的铁浸入水中形成烤蓝,体现该反应原理的化学方程式为_______ 。
(3)实验室中储存 溶液时,为了防止其被空气中氧气氧化变质,会在溶液中加入一定量的
溶液时,为了防止其被空气中氧气氧化变质,会在溶液中加入一定量的_______ 。
(4)某小组同学欲用废铁屑(主要成分为Fe,还含有少量 )制备
)制备 。操作过程如下:
。操作过程如下:
i.用稀盐酸溶解废铁屑。
ii.在所得溶液中先加入过量氧化剂 ,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得
,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得 。
。
①步骤ii中加入过量氧化剂 的目的是
的目的是_______ 。离子方程式为_______ 。
②设计实验验证操作i所得溶液中不含 ,简述实验操作及现象:
,简述实验操作及现象:_______ 。
③该小组同学认为即使操作i所得溶液中不含 ,也不需要加入
,也不需要加入 ,若直接加入NaOH溶液可观察到的实验现象为
,若直接加入NaOH溶液可观察到的实验现象为_______ 。
(5)羟基氧化铁 是一种重要的化工原料,一种以工厂废料(含FeO、
是一种重要的化工原料,一种以工厂废料(含FeO、 、
、 、CuO)为原料生产
、CuO)为原料生产 的工艺流程如下:
的工艺流程如下:
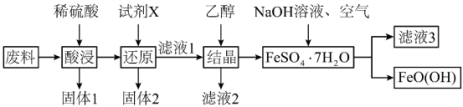
已知: 为酸性氧化物,不与硫酸等强酸反应;
为酸性氧化物,不与硫酸等强酸反应; 易溶于水,难溶于乙醇。
易溶于水,难溶于乙醇。
①“固体1”的主要成分是_______ 。
②“酸浸”时CuO与硫酸发生反应的离子方程式为_______ 。“试剂X”宜选择的是_______ 。
A.双氧水 B.铜粉 C.铁粉 D.钠块
(1)人体对
 的吸收效果更好,但人体中时刻进行着
的吸收效果更好,但人体中时刻进行着 、
、 的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起
的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起(2)钢铁烤蓝是在钢铁表面形成一层一定厚度和强度的致密氧化膜,古代铁匠常用红热的铁浸入水中形成烤蓝,体现该反应原理的化学方程式为
(3)实验室中储存
 溶液时,为了防止其被空气中氧气氧化变质,会在溶液中加入一定量的
溶液时,为了防止其被空气中氧气氧化变质,会在溶液中加入一定量的(4)某小组同学欲用废铁屑(主要成分为Fe,还含有少量
 )制备
)制备 。操作过程如下:
。操作过程如下:i.用稀盐酸溶解废铁屑。
ii.在所得溶液中先加入过量氧化剂
 ,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得
,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得 。
。①步骤ii中加入过量氧化剂
 的目的是
的目的是②设计实验验证操作i所得溶液中不含
 ,简述实验操作及现象:
,简述实验操作及现象:③该小组同学认为即使操作i所得溶液中不含
 ,也不需要加入
,也不需要加入 ,若直接加入NaOH溶液可观察到的实验现象为
,若直接加入NaOH溶液可观察到的实验现象为(5)羟基氧化铁
 是一种重要的化工原料,一种以工厂废料(含FeO、
是一种重要的化工原料,一种以工厂废料(含FeO、 、
、 、CuO)为原料生产
、CuO)为原料生产 的工艺流程如下:
的工艺流程如下:
已知:
 为酸性氧化物,不与硫酸等强酸反应;
为酸性氧化物,不与硫酸等强酸反应; 易溶于水,难溶于乙醇。
易溶于水,难溶于乙醇。①“固体1”的主要成分是
②“酸浸”时CuO与硫酸发生反应的离子方程式为
A.双氧水 B.铜粉 C.铁粉 D.钠块
您最近一年使用:0次
名校
3 . 从物质类别和元素化合价两个维度研究物质的性质及转化是重要的化学学习方法。氯及其化合物有重要用途,下图为氯元素的“价类二维图”的部分信息。请回答下列问题:
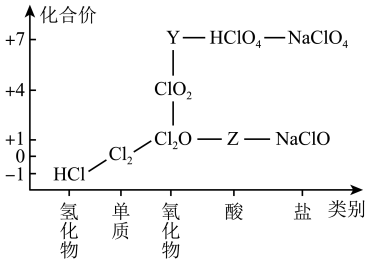
(1)根据图中信息写出Y、Z的化学式_______ 、_______ 。(每空1分)
(2)84消毒液能有效杀灭新冠病毒。某品牌84消毒液瓶体的部分标签如图所示。

①某使用说明中特别提醒84消毒液不可与洁厕灵(主要成分盐酸)混合使用,否则会产生 ,请用离子方程式表示其原因
,请用离子方程式表示其原因_______ 。
②如图所示,该品牌84消毒液的物质的量浓度为_______ ,84消毒液使用时需要稀释,某化学实验小组用上述84消毒液配制500mL 的稀溶液,需要用量筒量取该84消毒液
的稀溶液,需要用量筒量取该84消毒液_______ mL。
③配制过程中,下列操作会造成新配制的稀溶液浓度偏低的是_______ 。
A.量取浓84消毒液的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
B.容量瓶使用时未干燥
C.定容时俯视刻度线
D.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线

(1)根据图中信息写出Y、Z的化学式
(2)84消毒液能有效杀灭新冠病毒。某品牌84消毒液瓶体的部分标签如图所示。

①某使用说明中特别提醒84消毒液不可与洁厕灵(主要成分盐酸)混合使用,否则会产生
 ,请用离子方程式表示其原因
,请用离子方程式表示其原因②如图所示,该品牌84消毒液的物质的量浓度为
 的稀溶液,需要用量筒量取该84消毒液
的稀溶液,需要用量筒量取该84消毒液③配制过程中,下列操作会造成新配制的稀溶液浓度偏低的是
A.量取浓84消毒液的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
B.容量瓶使用时未干燥
C.定容时俯视刻度线
D.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
您最近一年使用:0次
4 . 面对新冠病毒,VB空气防护卡也成了“网红”,成为人们讨论的话题。商品介绍卡片中含有的主要活性成分——亚氯酸钠,在接触空气时可以释放安全可靠的低浓度二氧化氯( ),从而达到消除病毒、细菌活性的防护效果。
),从而达到消除病毒、细菌活性的防护效果。 的一种生产工艺如下:
的一种生产工艺如下:
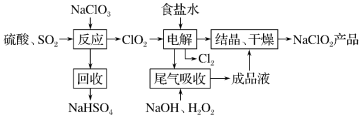
回答下列问题:
(1)写出“反应”步骤中生成 的化学反应方程式:
的化学反应方程式:_______ 。
(2)“电解”产生的 可用于工业制漂白液,写出制备漂白液的离子反应方程式:
可用于工业制漂白液,写出制备漂白液的离子反应方程式:_______ 。
(3)“尾气吸收”是吸收“电解”过程排出的少量 ,此吸收反应中,氧化剂与还原剂的物质的量之比为
,此吸收反应中,氧化剂与还原剂的物质的量之比为_______ ,该反应中还原产物是_______ 。
(4)有同学推测VB空气防护卡原理是因为 与空气中的
与空气中的 发生反应得到
发生反应得到 ,同时得到钠的两种正盐,试写出相应的化学反应方程式:
,同时得到钠的两种正盐,试写出相应的化学反应方程式:_______ 。
 ),从而达到消除病毒、细菌活性的防护效果。
),从而达到消除病毒、细菌活性的防护效果。 的一种生产工艺如下:
的一种生产工艺如下:
回答下列问题:
(1)写出“反应”步骤中生成
 的化学反应方程式:
的化学反应方程式:(2)“电解”产生的
 可用于工业制漂白液,写出制备漂白液的离子反应方程式:
可用于工业制漂白液,写出制备漂白液的离子反应方程式:(3)“尾气吸收”是吸收“电解”过程排出的少量
 ,此吸收反应中,氧化剂与还原剂的物质的量之比为
,此吸收反应中,氧化剂与还原剂的物质的量之比为(4)有同学推测VB空气防护卡原理是因为
 与空气中的
与空气中的 发生反应得到
发生反应得到 ,同时得到钠的两种正盐,试写出相应的化学反应方程式:
,同时得到钠的两种正盐,试写出相应的化学反应方程式:
您最近一年使用:0次
名校
5 . 实验室用浓盐酸和 制
制 ,并以干燥的
,并以干燥的 为原料制备
为原料制备 ,装置如下图所示。回答下列问题:
,装置如下图所示。回答下列问题:
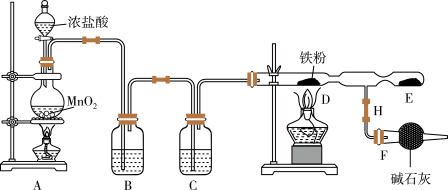
已知: 固体易升华,易吸收水分而潮解变质。请回答下列问题:
固体易升华,易吸收水分而潮解变质。请回答下列问题:
(1)连接好仪器后首先应进行的操作是_______ ;图中盛放碱石灰的仪器是_______ 。
(2)写出装置A中发生的离子方程式_______ 。
(3)装置B中盛放的试剂是_______ 。F装置所起的作用是_______ 。
(4)实验时,先点燃_______ 处的酒精灯,再点燃_______ 处酒精灯,D处发生的现象是_______ 。
(5)已知 与浓盐酸在常温下反应就可制取氯气:_______
与浓盐酸在常温下反应就可制取氯气:_______ _______
_______ (浓)= _______
(浓)= _______ _______
_______ _______
_______ _______
_______
①配平上述化学方程式,并用单线桥标出电子转移的情况。_________
②当生成标准状况下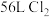 时对应转移的电子数为
时对应转移的电子数为_______ 。
 制
制 ,并以干燥的
,并以干燥的 为原料制备
为原料制备 ,装置如下图所示。回答下列问题:
,装置如下图所示。回答下列问题:
已知:
 固体易升华,易吸收水分而潮解变质。请回答下列问题:
固体易升华,易吸收水分而潮解变质。请回答下列问题:(1)连接好仪器后首先应进行的操作是
(2)写出装置A中发生的离子方程式
(3)装置B中盛放的试剂是
(4)实验时,先点燃
(5)已知
 与浓盐酸在常温下反应就可制取氯气:_______
与浓盐酸在常温下反应就可制取氯气:_______ _______
_______ (浓)= _______
(浓)= _______ _______
_______ _______
_______ _______
_______
①配平上述化学方程式,并用单线桥标出电子转移的情况。
②当生成标准状况下
 时对应转移的电子数为
时对应转移的电子数为
您最近一年使用:0次
2023-01-09更新
|
344次组卷
|
2卷引用:辽宁省沈阳市第十中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
6 . 下列化学反应表示正确的是
| A.向碘化钾中通入过量氯气:2I- + Cl2 = 2Cl- + I2 |
| B.向稀硝酸中加入过量铁粉:3Fe + 8HNO3=3Fe(NO3)2 + 2NO↑ +4H2O |
| C.氯化亚铁溶液中加入少量过氧化钠:4Fe2+ + 4Na2O2 + 6H2O =4Fe(OH)3↓ + 8Na+ + O2↑ |
D.硫酸铵溶液和氢氧化钡溶液反应:NH + SO + SO + Ba2+ + OH−= BaSO4↓+NH3·H2O + Ba2+ + OH−= BaSO4↓+NH3·H2O |
您最近一年使用:0次
名校
解题方法
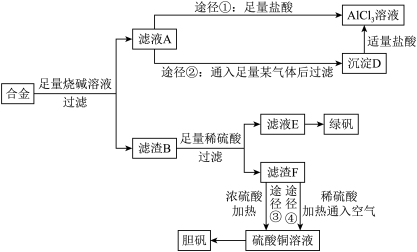
7 . 某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体[ ]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式_______ 。
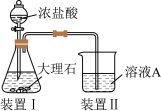
(2)进行途径②时,该小组用下图所示装置及试剂,将制得的 气体通入滤液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是
气体通入滤液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是_______ (用离子方程式表示);为了避免沉淀D减少,应该在装置Ⅰ和装置Ⅱ之间增加一个盛有_______ 的洗气瓶。
(3)通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、蒸发浓缩、冷却结晶、过滤、自然干燥。其中“加热通氧气”所起的作用为_______ (用离子方程式表示)。
(4)白磷有剧毒,不慎沾到皮肤上,可取少量胆矾配制成 溶液冲洗解毒。白磷可与热的
溶液冲洗解毒。白磷可与热的 溶液反应生成
溶液反应生成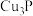 ,与冷溶液则析出Cu,反应方程式分别(均未配平)为:
,与冷溶液则析出Cu,反应方程式分别(均未配平)为:
①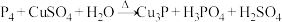
②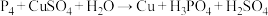
若上述两反应中被氧化的 的物质的量相等,则消耗的
的物质的量相等,则消耗的 的物质的量之比为
的物质的量之比为_______ 。
(5)将绿矾加热失去结晶水后的产物 ,进行如下转化(无关物质已略去)
,进行如下转化(无关物质已略去)
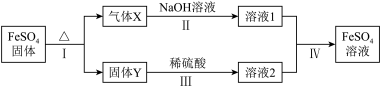
已知:X由两种化合物组成,将X通入氯水,溶液褪色;通入 溶液,产生白色沉淀。Y是红棕色的化合物。
溶液,产生白色沉淀。Y是红棕色的化合物。
①请写出X使氯水褪色所发生的反应的化学方程式_______ 。
②若经反应Ⅰ得到16g固体Y,产生的气体X恰好被0.4L1mol/L NaOH溶液完全吸收,则反应Ⅳ中生成 的离子方程式是
的离子方程式是_______ 。
 ]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式
(2)进行途径②时,该小组用下图所示装置及试剂,将制得的
 气体通入滤液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是
气体通入滤液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是
(3)通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、蒸发浓缩、冷却结晶、过滤、自然干燥。其中“加热通氧气”所起的作用为
(4)白磷有剧毒,不慎沾到皮肤上,可取少量胆矾配制成
 溶液冲洗解毒。白磷可与热的
溶液冲洗解毒。白磷可与热的 溶液反应生成
溶液反应生成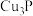 ,与冷溶液则析出Cu,反应方程式分别(均未配平)为:
,与冷溶液则析出Cu,反应方程式分别(均未配平)为:①
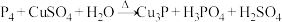
②
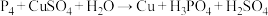
若上述两反应中被氧化的
 的物质的量相等,则消耗的
的物质的量相等,则消耗的 的物质的量之比为
的物质的量之比为(5)将绿矾加热失去结晶水后的产物
 ,进行如下转化(无关物质已略去)
,进行如下转化(无关物质已略去)
已知:X由两种化合物组成,将X通入氯水,溶液褪色;通入
 溶液,产生白色沉淀。Y是红棕色的化合物。
溶液,产生白色沉淀。Y是红棕色的化合物。①请写出X使氯水褪色所发生的反应的化学方程式
②若经反应Ⅰ得到16g固体Y,产生的气体X恰好被0.4L1mol/L NaOH溶液完全吸收,则反应Ⅳ中生成
 的离子方程式是
的离子方程式是
您最近一年使用:0次
名校
解题方法
8 . 某溶液仅含 、
、 、
、 、
、 、
、 、
、 、
、 中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
 、
、 、
、 、
、 、
、 、
、 、
、 中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是| A.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
B.加入稀硫酸发生反应的离子方程式为: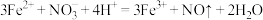 |
C.该溶液中一定有 |
| D.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
您最近一年使用:0次
解题方法
9 . 羟基氧化铁 是一种重要的化工原料,一种以工厂废料(含
是一种重要的化工原料,一种以工厂废料(含 、
、 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
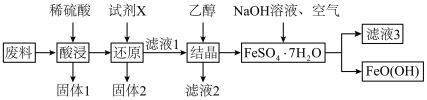
已知: 为酸性氧化物,不与硫酸等强酸反应;
为酸性氧化物,不与硫酸等强酸反应; 易溶于水,难溶于乙醇。
易溶于水,难溶于乙醇。
(1)羟基氧化铁中铁元素的化合价是_______ ,“固体1”的主要成分是_______ 。
(2)“酸浸”时 与硫酸发生反应的离子方程式为
与硫酸发生反应的离子方程式为_______ 。“试剂X”宜选择的是_______ 。
A.双氧水 B.铁粉 C.铜粉 D.钠块
(3)“结晶”时加入乙醇即可析出 晶体,乙醇的作用是
晶体,乙醇的作用是_______ 。
(4)将 配制成一定浓度的溶液,恒温条件下边搅拌边按一定比例加入
配制成一定浓度的溶液,恒温条件下边搅拌边按一定比例加入 溶液,同时鼓入空气进行氧化,至反应液全部变为棕黄色悬浊液,即可得到
溶液,同时鼓入空气进行氧化,至反应液全部变为棕黄色悬浊液,即可得到 。该反应的离子方程式为
。该反应的离子方程式为_______ 。
(5)“滤液3”中,溶质的主要成分是_______ (写化学式)。
 是一种重要的化工原料,一种以工厂废料(含
是一种重要的化工原料,一种以工厂废料(含 、
、 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
已知:
 为酸性氧化物,不与硫酸等强酸反应;
为酸性氧化物,不与硫酸等强酸反应; 易溶于水,难溶于乙醇。
易溶于水,难溶于乙醇。(1)羟基氧化铁中铁元素的化合价是
(2)“酸浸”时
 与硫酸发生反应的离子方程式为
与硫酸发生反应的离子方程式为A.双氧水 B.铁粉 C.铜粉 D.钠块
(3)“结晶”时加入乙醇即可析出
 晶体,乙醇的作用是
晶体,乙醇的作用是(4)将
 配制成一定浓度的溶液,恒温条件下边搅拌边按一定比例加入
配制成一定浓度的溶液,恒温条件下边搅拌边按一定比例加入 溶液,同时鼓入空气进行氧化,至反应液全部变为棕黄色悬浊液,即可得到
溶液,同时鼓入空气进行氧化,至反应液全部变为棕黄色悬浊液,即可得到 。该反应的离子方程式为
。该反应的离子方程式为(5)“滤液3”中,溶质的主要成分是
您最近一年使用:0次
解题方法
10 . 探究化学反应速率的影响因素,对工农业生产有着非常重要的意义。为探究反应速率与 溶液浓度的关系,利用下列装置(夹持仪器略去)进行实验。
溶液浓度的关系,利用下列装置(夹持仪器略去)进行实验。
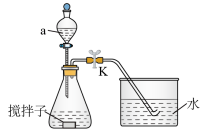
实验步骤:往锥形瓶中加入一定体积的
 溶液、
溶液、
 溶液和水,充分搅拌。控制体系温度,通过
溶液和水,充分搅拌。控制体系温度,通过 往锥形瓶中加入一定浓度的醋酸,发生反应:
往锥形瓶中加入一定浓度的醋酸,发生反应: 。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集
。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集
 所需时间。回答下列问题:
所需时间。回答下列问题:
(1)仪器a的名称为_______ 。
(2)若需控制体系的温度为36℃,采取的合理加热方式为_______ 。
(3)每组实验过程的实验数据如下表所示:
i.
_______ ,
_______ 。
ii.该反应的速率方程为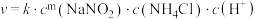 ,k为反应速率常数。利用实验数据计算得m=
,k为反应速率常数。利用实验数据计算得m=_______ (填整数)。
iii.醋酸的作用是_______ 。
(4)如果用同浓度的盐酸代替醋酸进行实验1, 与盐酸反应生成
与盐酸反应生成 ,
, 分解产生等物质的量的两种气体。反应结束后,锥形瓶中红棕色气体逐渐变浅。
分解产生等物质的量的两种气体。反应结束后,锥形瓶中红棕色气体逐渐变浅。 分解的化学方程式为
分解的化学方程式为_______ 。
 溶液浓度的关系,利用下列装置(夹持仪器略去)进行实验。
溶液浓度的关系,利用下列装置(夹持仪器略去)进行实验。
实验步骤:往锥形瓶中加入一定体积的

 溶液、
溶液、
 溶液和水,充分搅拌。控制体系温度,通过
溶液和水,充分搅拌。控制体系温度,通过 往锥形瓶中加入一定浓度的醋酸,发生反应:
往锥形瓶中加入一定浓度的醋酸,发生反应: 。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集
。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集
 所需时间。回答下列问题:
所需时间。回答下列问题:(1)仪器a的名称为
(2)若需控制体系的温度为36℃,采取的合理加热方式为
(3)每组实验过程的实验数据如下表所示:
| 实验编号 |  | 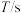 | |||
 溶液 溶液 |  溶液 溶液 | 醋酸 | 水 | ||
| 1 | 4.0 |  | 4.0 | 8.0 | 340 |
| 2 | 6.0 | 4.0 | 4.0 |  | 151 |
| 3 | 8.0 | 4.0 | 4.0 | 4.0 | 85 |
| 4 | 12.0 | 4.0 | 4.0 | 0.0 | 38 |


ii.该反应的速率方程为
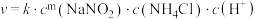 ,k为反应速率常数。利用实验数据计算得m=
,k为反应速率常数。利用实验数据计算得m=iii.醋酸的作用是
(4)如果用同浓度的盐酸代替醋酸进行实验1,
 与盐酸反应生成
与盐酸反应生成 ,
, 分解产生等物质的量的两种气体。反应结束后,锥形瓶中红棕色气体逐渐变浅。
分解产生等物质的量的两种气体。反应结束后,锥形瓶中红棕色气体逐渐变浅。 分解的化学方程式为
分解的化学方程式为
您最近一年使用:0次
2022-12-17更新
|
228次组卷
|
2卷引用:辽宁省鞍山市一般高中协作校2022-2023学年高一下学期期末考试化学试题



