名校
解题方法
1 . 二氧化氯(ClO2)是世界卫生组织(WHO)公认的新时代绿色消毒剂,其特点是:无三致(致癌、致畸、致突变),有三效(广谱、高效、快速)。经大量实验研究表明,ClO2对细胞壁有较强的吸附和穿透能力,反应释放出的原子氧将细胞内的酶氧化,从而起到杀菌作用,研究表明,ClO2在浓度低于100mg·L−1时不会对人体产生任何的影响。在“新冠”疫情防控中ClO2也被广泛的用于公共场所的消杀。下列关于ClO2的说法正确的是
| A.ClO2能用于消毒是因为它是氯的最高价氧化物 |
| B.在进行消毒作业时使用的ClO2溶液浓度越大越好 |
| C.ClO2杀菌力强,是一种比“84”性能更优越的消毒剂 |
| D.ClO2可与NaOH在一条件下发生反应,产物只有NaClO3和H2O |
您最近一年使用:0次
2020-06-06更新
|
491次组卷
|
6卷引用:辽宁省铁岭市调兵山市第二高级中学2019~2020学年高一下学期期末考试化学试题
辽宁省铁岭市调兵山市第二高级中学2019~2020学年高一下学期期末考试化学试题湖北省黄冈市罗田县第一中学2019-2020学年高一下学期期中考试化学试题荆、荆、襄、宜四地七校考试联盟2019-2020学年高一下学期期中联考化学试题(已下线)1.3.4 氧化还原反应方程式的配平-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)(已下线)专题39 氯的氧化物、含氧酸及含氧酸盐-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)第12讲 富集在海水中的元素——卤素(讲)-2023年高考化学一轮复习讲练测(全国通用)
名校
2 . 铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)向沸水中逐滴滴加1mol·L-1FeCl3溶液至液体呈透明的红褐色,所得分散系中微粒直径的范围是______________ ,区别该液体和FeCl3溶液的方法是______________ 。
(2)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 Fe3O4+6SO2,氧化产物为
Fe3O4+6SO2,氧化产物为________ ,若有3mol FeS2参加反应,转移________ mol电子。
(3)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有气体逸出,请配平该化学方程式:
___ FeSO4+____ KNO3+___ H2SO4═____ K2SO4+_____ Fe2(SO4)3+__ NO↑+_____ H2O。
(4)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160mL 5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L(标准状况)H2,经检测,溶液中无Fe3+,则参加反应的铁粉的质量为________ g。
(1)向沸水中逐滴滴加1mol·L-1FeCl3溶液至液体呈透明的红褐色,所得分散系中微粒直径的范围是
(2)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2
 Fe3O4+6SO2,氧化产物为
Fe3O4+6SO2,氧化产物为(3)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有气体逸出,请配平该化学方程式:
(4)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160mL 5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L(标准状况)H2,经检测,溶液中无Fe3+,则参加反应的铁粉的质量为
您最近一年使用:0次
2020-04-27更新
|
279次组卷
|
2卷引用:辽宁省丹东市2017-2018学年高一上学期期末质量监测化学试题
3 . 黄铁矿(FeS2)中-1价硫元素在酸性条件下可以与ClO3-发生反应,其离子方程式如下
_____ ClO3-+_____ FeS2+_____H+=_____ClO2↑+_____Fe3++_____ SO42-+_____H2O(未配平):下列说法正确的是
_____ ClO3-+_____ FeS2+_____H+=_____ClO2↑+_____Fe3++_____ SO42-+_____H2O(未配平):下列说法正确的是
| A. ClO3-是氧化剂,Fe3+是还原产物 |
| B. ClO3-的氧化性强于Fe3+ |
| C.生成l mol SO42-时,转移7mol 电子 |
| D.取反应后的溶液加KSCN溶液,可观察到有红色沉淀产生 |
您最近一年使用:0次
2020-02-20更新
|
470次组卷
|
3卷引用:辽宁师范大学附属中学2017-2018学年高一上学期期末考试化学试题
辽宁师范大学附属中学2017-2018学年高一上学期期末考试化学试题2020届高三化学化学二轮复习——高考常考题:氧化还原反应的规律:先后律、强弱律【精编选择25题】(已下线)考点05 氧化还原反应方程式的配平与计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
解题方法
4 . 从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)实验室在配制 FeSO4溶液时为了防止 FeSO4溶液变质,经常向其中加入铁粉,其原因是______________ (用离子方程式表示)。
(2)向FeSO4溶液中滴加氨水的现象为______________________ ,请用化学用语解释出现此现象的原因___________________ ;_____________________
(3)现有配制所得的 100mL 6mol/L FeSO4溶液,往其中滴入一定量稀硝酸,请回答下列问题:
①配平该反应的离子方程式:____ Fe2+____ NO3-+____ H+ = ___ Fe3++____ NO↑+_____ H2O(在横线上写上化学计量数)
②要检验该反应后的溶液中是否还含有 Fe2+,可选用下列的一种试剂为_______
A.酸性 KMnO4 溶液 B.KSCN 溶液 C. Cl2
③写出上述②的具体实验方案(含操作、现象、结论):____________________ 。
④经检验,上述反应后的溶液中不存在 Fe2+,则该反应过程中产生的 NO 体积为(标准状况下)____________________ L。
(1)实验室在配制 FeSO4溶液时为了防止 FeSO4溶液变质,经常向其中加入铁粉,其原因是
(2)向FeSO4溶液中滴加氨水的现象为
(3)现有配制所得的 100mL 6mol/L FeSO4溶液,往其中滴入一定量稀硝酸,请回答下列问题:
①配平该反应的离子方程式:
②要检验该反应后的溶液中是否还含有 Fe2+,可选用下列的一种试剂为
A.酸性 KMnO4 溶液 B.KSCN 溶液 C. Cl2
③写出上述②的具体实验方案(含操作、现象、结论):
④经检验,上述反应后的溶液中不存在 Fe2+,则该反应过程中产生的 NO 体积为(标准状况下)
您最近一年使用:0次
2020-01-08更新
|
186次组卷
|
2卷引用:辽宁省锦州市滨海实验中学2019-2020学年高一上学期期末考试化学试题(2019新人教版)
5 . 现有部分元素的性质与原子(或分子)结构如下表:
请根据表中信息回答下列问题
(1)元素T在周期表中位于第_____ 周期第_____ 族
(2)元素T与X相比,原子半径较大的是________ (用元素符号表示);
(3)T、X、Y、Z中有两种元素能形成既有离子键又有共价键的化合物,
该化合物的电子式为_________ 该化合物与水反应方程式:_____________________
(4)元素Y与元素Z相比,金属性较强的是________ (用元素符号表示);
下列表述中能证明这一事实的是________ (填序号)。
a.Y单质的熔点比Z单质低 b.Y单质与水反应比Z单质剧烈
c.Y的化合价比Z低 d.Y最高价氧化物的水化物的碱性比Z强
(5)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:____________________________________________ 。
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的简单离子中半径最小 |
(1)元素T在周期表中位于第
(2)元素T与X相比,原子半径较大的是
(3)T、X、Y、Z中有两种元素能形成既有离子键又有共价键的化合物,
该化合物的电子式为
(4)元素Y与元素Z相比,金属性较强的是
下列表述中能证明这一事实的是
a.Y单质的熔点比Z单质低 b.Y单质与水反应比Z单质剧烈
c.Y的化合价比Z低 d.Y最高价氧化物的水化物的碱性比Z强
(5)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:
您最近一年使用:0次
6 . 用湿法制磷酸的副产品氟硅酸(H2SiF6)生成无水氟化氢的工艺如图所示:
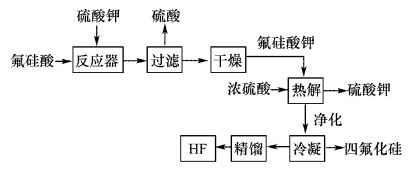
已知氟硅酸钾(K2SiF6)微酸性,有吸湿性,微溶于水,不溶于酒精。
(1)写出反应器中的化学方程式:________________ 。
(2)在实验室过滤操作中所用的玻璃仪器有_____________ ,在洗涤氟硅酸钾(K2SiF6)时常用酒精洗涤,其目的是:____________ 。
(3)该流程中哪些物质可以循环使用:_____________ 。(用化学式表达)
(4)氟化氢可以腐蚀刻画玻璃,在刻蚀玻璃过程中也会生成H2SiF6,试写出该反应的化学方程式:__________________ 。

已知氟硅酸钾(K2SiF6)微酸性,有吸湿性,微溶于水,不溶于酒精。
(1)写出反应器中的化学方程式:
(2)在实验室过滤操作中所用的玻璃仪器有
(3)该流程中哪些物质可以循环使用:
(4)氟化氢可以腐蚀刻画玻璃,在刻蚀玻璃过程中也会生成H2SiF6,试写出该反应的化学方程式:
您最近一年使用:0次
2018-01-20更新
|
184次组卷
|
2卷引用:辽宁省大连市2017-2018学年高一上学期期末考试化学试题
7 . 某废水中含有CN-和Cr2O72- 等离子,需经污水处理达标后小能排放,污水处理拟采用下列流程进行处理:

回答下列问题:
(1)步骤②中,CN- 被ClO-氧化为CNO-的离子方程式为____________ 。
(2)步骤③的反应的离子方程式为S2O32-+Cr2O72-+H+→SO42-+Cr3++H2O(未配平),每消耗0.4mol Cr2O72-时,反应中S2O32-失去_________ mol电子。
(3)含Cr 3+废水可以加入熟石灰进一步处理,目的是___________________ 。

回答下列问题:
(1)步骤②中,CN- 被ClO-氧化为CNO-的离子方程式为
(2)步骤③的反应的离子方程式为S2O32-+Cr2O72-+H+→SO42-+Cr3++H2O(未配平),每消耗0.4mol Cr2O72-时,反应中S2O32-失去
(3)含Cr 3+废水可以加入熟石灰进一步处理,目的是
您最近一年使用:0次
2018-01-20更新
|
212次组卷
|
2卷引用:辽宁省大连市2017-2018学年高一上学期期末考试化学试题
8 . 实验室利用以下反应制取少量氨气:NaNO2 +NH4Cl=NaCl+N2 ↑+2H2O,关于该反应的下列说法正确的是
| A.NaNO2发生氧化反应 |
| B.每生成1molN2转移的电子的物质的量为3 mol |
| C.NH4 Cl 中的氯元素被还原 |
| D.N2既是氧化剂,又是还原剂 |
您最近一年使用:0次
2018-01-20更新
|
172次组卷
|
2卷引用:辽宁省大连市2017-2018学年高一上学期期末考试化学试题
9 . 根据《本草纲目》有关记载:“水银乃至阴之毒物,因火煅丹砂而出,加以盐、(明)矾而为轻粉(Hg2Cl2),加以硫磺升而为银朱(HgS)”。发生的主要化学反应方程式如下:
①HgS+O2 === Hg+SO2
② Hg+ NaCl+ KAl(SO4)2+ O2 === Hg2Cl2+ Na2SO4+ Al2O3+ K2SO4
③ Hg+S === HgS
请回答下列问题:
(1)在①的方程式中,HgS是做_______
a.氧化剂 b.还原剂 c.既做氧化剂又做还原剂 d.既不做氧化剂又不做还原剂
(2)配平②的化学方程式___________________________________________
(3)实验室制备SO2一般选用浓硫酸与Na2SO3反应。实验室制取SO2并检验其性质的装置与过程如下图:

a. 实验开始前检验气体发生装置气密 性的方法为____________________ (说明操作方法、现象和结论)
b. 分析下列装置中的现象分别为
①_________ ②__________
③_________ ④__________
c. ⑤的作用为_______________ ,所涉及的化学反应方程式为:____________________
d. 若在制备SO2时改为用稀盐酸与Na2SO3反应,则可能产生的影响为______________
①HgS+O2 === Hg+SO2
② Hg+ NaCl+ KAl(SO4)2+ O2 === Hg2Cl2+ Na2SO4+ Al2O3+ K2SO4
③ Hg+S === HgS
请回答下列问题:
(1)在①的方程式中,HgS是做
a.氧化剂 b.还原剂 c.既做氧化剂又做还原剂 d.既不做氧化剂又不做还原剂
(2)配平②的化学方程式
(3)实验室制备SO2一般选用浓硫酸与Na2SO3反应。实验室制取SO2并检验其性质的装置与过程如下图:

a. 实验开始前检验气体发生装置气密 性的方法为
b. 分析下列装置中的现象分别为
①
③
c. ⑤的作用为
d. 若在制备SO2时改为用稀盐酸与Na2SO3反应,则可能产生的影响为
您最近一年使用:0次
名校
解题方法
10 . Ⅰ.某工厂的工业废水中含有大量的FeSO4 和较多的Fe3+和Cu2+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。实验室模拟该工业流程如图:
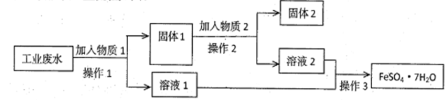
(1)检验废水中的Fe2+,实验室中用酸性KMnO4溶液检验,发生反应的离子方程式为________ 。
(2)加入过量物质1后,发生反应的离子方程式为___________________________ 。
(3)固体2是__________ ,实验室为长期保存硫酸亚铁溶液往往向其溶液中加入__________ 。
Ⅱ.工业上冶炼铝的原料是铝土矿( 主要成分是Al2O3,杂质为Fe2O3、FeO、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:

(1)加入过量的NaOH溶液,过滤后的滤液中含有的溶质有________ (填化学式)。
(2)加入过量NaOH溶液过滤后,若滤渣中Fe(OH)2也被氧化,写出其被氧化的化学方程式______________ 。
(3)写出通入过量CO2生成沉淀A时反应的离子方程式为_________________________ 。

(1)检验废水中的Fe2+,实验室中用酸性KMnO4溶液检验,发生反应的离子方程式为
(2)加入过量物质1后,发生反应的离子方程式为
(3)固体2是
Ⅱ.工业上冶炼铝的原料是铝土矿( 主要成分是Al2O3,杂质为Fe2O3、FeO、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:

(1)加入过量的NaOH溶液,过滤后的滤液中含有的溶质有
(2)加入过量NaOH溶液过滤后,若滤渣中Fe(OH)2也被氧化,写出其被氧化的化学方程式
(3)写出通入过量CO2生成沉淀A时反应的离子方程式为
您最近一年使用:0次
2018-01-17更新
|
670次组卷
|
5卷引用:辽宁省清原中学2017-2018学年高一上学期期末考试化学试题



