名校
1 . 从物质类别和元素化合价两个维度研究物质的性质及转化是重要的化学学习方法。氯及其化合物有重要用途,下图为氯元素的“价类二维图”的部分信息。请回答下列问题:
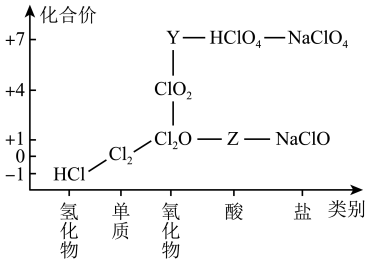
(1)根据图中信息写出Y、Z的化学式_______ 、_______ 。(每空1分)
(2)84消毒液能有效杀灭新冠病毒。某品牌84消毒液瓶体的部分标签如图所示。

①某使用说明中特别提醒84消毒液不可与洁厕灵(主要成分盐酸)混合使用,否则会产生 ,请用离子方程式表示其原因
,请用离子方程式表示其原因_______ 。
②如图所示,该品牌84消毒液的物质的量浓度为_______ ,84消毒液使用时需要稀释,某化学实验小组用上述84消毒液配制500mL 的稀溶液,需要用量筒量取该84消毒液
的稀溶液,需要用量筒量取该84消毒液_______ mL。
③配制过程中,下列操作会造成新配制的稀溶液浓度偏低的是_______ 。
A.量取浓84消毒液的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
B.容量瓶使用时未干燥
C.定容时俯视刻度线
D.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线

(1)根据图中信息写出Y、Z的化学式
(2)84消毒液能有效杀灭新冠病毒。某品牌84消毒液瓶体的部分标签如图所示。

①某使用说明中特别提醒84消毒液不可与洁厕灵(主要成分盐酸)混合使用,否则会产生
 ,请用离子方程式表示其原因
,请用离子方程式表示其原因②如图所示,该品牌84消毒液的物质的量浓度为
 的稀溶液,需要用量筒量取该84消毒液
的稀溶液,需要用量筒量取该84消毒液③配制过程中,下列操作会造成新配制的稀溶液浓度偏低的是
A.量取浓84消毒液的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
B.容量瓶使用时未干燥
C.定容时俯视刻度线
D.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
您最近一年使用:0次
2 . 氮、磷都是第ⅤA族元素,一些含氮、磷的化合物在生产生活中均有重要应用。
(1)磷化铝、磷化锌、磷化钙是我国目前最常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦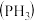 ,写出磷化铝与水反应的化学方程式:
,写出磷化铝与水反应的化学方程式:___________ 。
(2)羟基磷灰石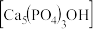 是一种重要的生物无机材料,也是我们牙齿表面的一层坚硬物质,可用磷酸和氢氧化钙悬浊液反应制得。已知3种钙盐的溶解度(以钙离子浓度的对数表示)随溶液pH的变化如图所示。
是一种重要的生物无机材料,也是我们牙齿表面的一层坚硬物质,可用磷酸和氢氧化钙悬浊液反应制得。已知3种钙盐的溶解度(以钙离子浓度的对数表示)随溶液pH的变化如图所示。
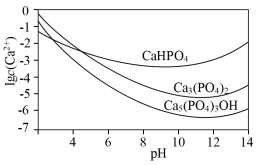
①图中所示3种钙盐,其中在人体中最稳定的存在形式是___________ (填化学式)。
②实验室制备羟基磷灰石时,应将___________ (填“磷酸”或“氢氧化钙悬浊液”,下同)滴加到___________ 中。
(3)氮的氧化物对大气污染比较严重,一定条件下可用 消除污染,请写出
消除污染,请写出 与
与 反应的化学方程式:
反应的化学方程式:___________ ,该反应中,被氧化的氮原子和被还原的氮原子的物质的量之比为___________ ,每消耗1mol ,同时转移
,同时转移___________ mol电子。
(1)磷化铝、磷化锌、磷化钙是我国目前最常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦
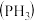 ,写出磷化铝与水反应的化学方程式:
,写出磷化铝与水反应的化学方程式:(2)羟基磷灰石
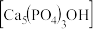 是一种重要的生物无机材料,也是我们牙齿表面的一层坚硬物质,可用磷酸和氢氧化钙悬浊液反应制得。已知3种钙盐的溶解度(以钙离子浓度的对数表示)随溶液pH的变化如图所示。
是一种重要的生物无机材料,也是我们牙齿表面的一层坚硬物质,可用磷酸和氢氧化钙悬浊液反应制得。已知3种钙盐的溶解度(以钙离子浓度的对数表示)随溶液pH的变化如图所示。
①图中所示3种钙盐,其中在人体中最稳定的存在形式是
②实验室制备羟基磷灰石时,应将
(3)氮的氧化物对大气污染比较严重,一定条件下可用
 消除污染,请写出
消除污染,请写出 与
与 反应的化学方程式:
反应的化学方程式: ,同时转移
,同时转移
您最近一年使用:0次
解题方法
3 . 已知氢碘酸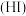 是一种具有强还原性的强酸,
是一种具有强还原性的强酸, 可以与多种物质【如:
可以与多种物质【如: 、
、 、
、 、
、 、
、 、
、 等】发生不同类型的化学反应.请回答下列问题:
等】发生不同类型的化学反应.请回答下列问题:
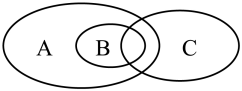
(1)下图可表示离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是_________ (填标号).
(2) 在水溶液中的电离方程式为
在水溶液中的电离方程式为_________________ .
(3)常温下 溶液与
溶液与 反应的化学方程式为
反应的化学方程式为 ,说明还原性
,说明还原性
______  (填“>”、“<”或“=).
(填“>”、“<”或“=).
(4)在反应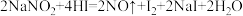 ,氧化剂与还原剂的物质的量之比为
,氧化剂与还原剂的物质的量之比为________ .
(5)下列三种氧化剂均可以将 氧化生成
氧化生成 ,自身对应的还原产物情况如下:
,自身对应的还原产物情况如下:
请判断等物质的量的三种氧化剂分别与足量HI作用,得到I2质量最多的是________ (填选项标号).
(6)向 胶体中逐滴加入HI稀溶液,会出现如下一系列变化:先出现红褐色沉淀;随后沉淀溶解,溶液呈黄色:最后溶液颜色加深.
胶体中逐滴加入HI稀溶液,会出现如下一系列变化:先出现红褐色沉淀;随后沉淀溶解,溶液呈黄色:最后溶液颜色加深.
①红褐色沉淀溶解,反应的离子方程式为___________________________ .
②最后溶液颜色加深,反应的离子方程式为______________________________ .
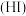 是一种具有强还原性的强酸,
是一种具有强还原性的强酸, 可以与多种物质【如:
可以与多种物质【如: 、
、 、
、 、
、 、
、 、
、 等】发生不同类型的化学反应.请回答下列问题:
等】发生不同类型的化学反应.请回答下列问题:(1)下图可表示离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是

(2)
 在水溶液中的电离方程式为
在水溶液中的电离方程式为(3)常温下
 溶液与
溶液与 反应的化学方程式为
反应的化学方程式为 ,说明还原性
,说明还原性
 (填“>”、“<”或“=).
(填“>”、“<”或“=).(4)在反应
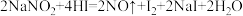 ,氧化剂与还原剂的物质的量之比为
,氧化剂与还原剂的物质的量之比为(5)下列三种氧化剂均可以将
 氧化生成
氧化生成 ,自身对应的还原产物情况如下:
,自身对应的还原产物情况如下:选项 | A | B | C |
氧化剂 |
|
|
|
还原产物 |
|
|
|
(6)向
 胶体中逐滴加入HI稀溶液,会出现如下一系列变化:先出现红褐色沉淀;随后沉淀溶解,溶液呈黄色:最后溶液颜色加深.
胶体中逐滴加入HI稀溶液,会出现如下一系列变化:先出现红褐色沉淀;随后沉淀溶解,溶液呈黄色:最后溶液颜色加深.①红褐色沉淀溶解,反应的离子方程式为
②最后溶液颜色加深,反应的离子方程式为
您最近一年使用:0次
4 . Ⅰ、含氮废水是造成水体污染的重要原因之一、研究含氮废水的处理对水体净化有重要意义。利用 O2 和 H2 可高效去除水体中同时存在的 NH 和 NO
和 NO 。
。
具体方法是:①先利用氧气将 NH 氧化成 NO
氧化成 NO ,
,
②再利用 H2 将 NO 还原为N2 (2NO
还原为N2 (2NO +5H2
+5H2 N2+2OH-+4H2O)。
N2+2OH-+4H2O)。
(1)反应①中氧化剂与还原剂物质的量之比为___________ 。
(2)若完全处理 100g 含 NH4NO3 4%的废水,至少需要标准状况下的 H2___________ L。
(3)该污水处理的好处是___________ (列举一条即可)
Ⅱ、焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是___________ (写化学式)。
(2)写出并配平该反应的化学方程式:___________ ;
(3)发生还原反应的物质是___________ ,反应中2mol氧化剂能___________ (填“失去”或“得到”)___________ mol电子。
(4)反应中产生5.6L(标准状况)的气体时,被还原的物质的质量为___________ 。
 和 NO
和 NO 。
。具体方法是:①先利用氧气将 NH
 氧化成 NO
氧化成 NO ,
,②再利用 H2 将 NO
 还原为N2 (2NO
还原为N2 (2NO +5H2
+5H2 N2+2OH-+4H2O)。
N2+2OH-+4H2O)。(1)反应①中氧化剂与还原剂物质的量之比为
(2)若完全处理 100g 含 NH4NO3 4%的废水,至少需要标准状况下的 H2
(3)该污水处理的好处是
Ⅱ、焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是
(2)写出并配平该反应的化学方程式:
(3)发生还原反应的物质是
(4)反应中产生5.6L(标准状况)的气体时,被还原的物质的质量为
您最近一年使用:0次
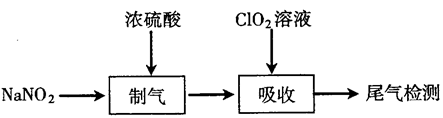
5 . 为探索稳定性 溶液对氮氧化物(
溶液对氮氧化物( )的处理效果,实验过程如下:
)的处理效果,实验过程如下:
已知: 具有强氧化性,且氧化性随着溶液的酸性增强而增强。
具有强氧化性,且氧化性随着溶液的酸性增强而增强。 和NaOH反应的化学方程式为:
和NaOH反应的化学方程式为: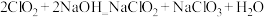 。
。 对氮氧化物具有强吸收效果。
对氮氧化物具有强吸收效果。
(1)“制气”阶段生成 、NO和
、NO和 。“制气”反应的化学方程式为
。“制气”反应的化学方程式为___________ 。
(2) 可以将NO氧化为
可以将NO氧化为 ,并进一步将
,并进一步将 氧化为
氧化为 ,
, 则被还原为
则被还原为 。吸收时,
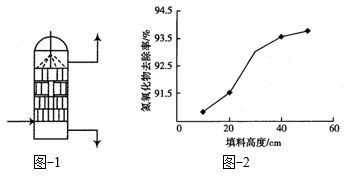
。吸收时, 溶液从吸收器顶部喷淋,氮氧化物从吸收器底部通入(如图-1所示)。
溶液从吸收器顶部喷淋,氮氧化物从吸收器底部通入(如图-1所示)。 的吸收率与吸收器内碎瓷片填料的高度关系如图-2所示。
的吸收率与吸收器内碎瓷片填料的高度关系如图-2所示。
① 和
和 反应的离子方程式为
反应的离子方程式为___________ 。
②随着吸收器内填料高度增加, 去除率增高的原因是
去除率增高的原因是___________ 。
(3)通过加入盐酸或NaOH调节 溶液的pH,测得不同pH的
溶液的pH,测得不同pH的 溶液对
溶液对 吸收率的影响如图-3所示。
吸收率的影响如图-3所示。
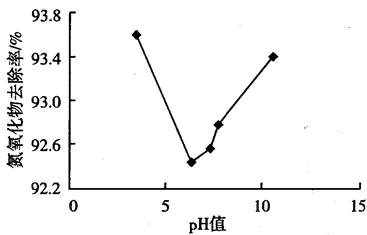
①当pH小于7时, 吸收率随pH增大而减小的原因是
吸收率随pH增大而减小的原因是___________ 。
②当pH大于7时, 吸收率随pH增大而增大的原因是
吸收率随pH增大而增大的原因是___________ 。
 溶液对氮氧化物(
溶液对氮氧化物( )的处理效果,实验过程如下:
)的处理效果,实验过程如下:
已知:
 具有强氧化性,且氧化性随着溶液的酸性增强而增强。
具有强氧化性,且氧化性随着溶液的酸性增强而增强。 和NaOH反应的化学方程式为:
和NaOH反应的化学方程式为: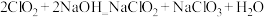 。
。 对氮氧化物具有强吸收效果。
对氮氧化物具有强吸收效果。(1)“制气”阶段生成
 、NO和
、NO和 。“制气”反应的化学方程式为
。“制气”反应的化学方程式为(2)
 可以将NO氧化为
可以将NO氧化为 ,并进一步将
,并进一步将 氧化为
氧化为 ,
, 则被还原为
则被还原为 。吸收时,
。吸收时, 溶液从吸收器顶部喷淋,氮氧化物从吸收器底部通入(如图-1所示)。
溶液从吸收器顶部喷淋,氮氧化物从吸收器底部通入(如图-1所示)。 的吸收率与吸收器内碎瓷片填料的高度关系如图-2所示。
的吸收率与吸收器内碎瓷片填料的高度关系如图-2所示。
①
 和
和 反应的离子方程式为
反应的离子方程式为②随着吸收器内填料高度增加,
 去除率增高的原因是
去除率增高的原因是(3)通过加入盐酸或NaOH调节
 溶液的pH,测得不同pH的
溶液的pH,测得不同pH的 溶液对
溶液对 吸收率的影响如图-3所示。
吸收率的影响如图-3所示。
①当pH小于7时,
 吸收率随pH增大而减小的原因是
吸收率随pH增大而减小的原因是②当pH大于7时,
 吸收率随pH增大而增大的原因是
吸收率随pH增大而增大的原因是
您最近一年使用:0次
2021-06-27更新
|
471次组卷
|
2卷引用:辽宁省葫芦岛市普通高中2021-2022学年高一下学期期末学业质量监测化学试题
6 . 过氧化氢的水溶液俗称双氧水,它的用途很广泛,常用于消毒、杀菌、漂白等。回答下列问题:
(1)过氧化氢的性质
①酸性条件下H2O2可将Fe2+转化成Fe3+,说明H2O2具有__ 性。
②常温下,H2O2显弱酸性(Ka1=2.40×10-12、Ka2=1.05×10-25),不能使甲基橙指示剂褪色,则向4.0mol•L-1的H2O2溶液中滴加甲基橙,溶液显__ 色。(甲基橙在pH小于3.1时显红色,3.1~4.4时显橙色,大于4.4时显黄色)
(2)过氧化氢含量的测定实验
某兴趣小组同学用0.1mol•L-1的酸性高锰酸钾标准溶液滴定试样中的过氧化氢,反应原理为2MnO +5H2O2+6H+=2Mn2++8H2O+5O2↑。
+5H2O2+6H+=2Mn2++8H2O+5O2↑。
①滴定达到终点的现象是__ 。
②用移液管移取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗酸性高锰酸钾标准溶液的体积如下表:
试样中过氧化氢的浓度为__ mol•L-1。
(3)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上。实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛(HCHO)溶液依次加入质量分数为30%~70%的过氧化氢溶液中。该反应的化学方程式为__ 。
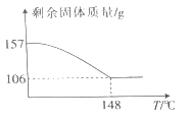
(4)过氧化氢与碳酸钠的加合物Na2CO3•xH2O2比较稳定,方便储存,可用于消毒、漂白。现称取157gNa2CO3•xH2O2晶体加热,实验结果如图所示,则该晶体的组成为__ (x精确到0.1)
(1)过氧化氢的性质
①酸性条件下H2O2可将Fe2+转化成Fe3+,说明H2O2具有
②常温下,H2O2显弱酸性(Ka1=2.40×10-12、Ka2=1.05×10-25),不能使甲基橙指示剂褪色,则向4.0mol•L-1的H2O2溶液中滴加甲基橙,溶液显
(2)过氧化氢含量的测定实验
某兴趣小组同学用0.1mol•L-1的酸性高锰酸钾标准溶液滴定试样中的过氧化氢,反应原理为2MnO
 +5H2O2+6H+=2Mn2++8H2O+5O2↑。
+5H2O2+6H+=2Mn2++8H2O+5O2↑。①滴定达到终点的现象是
②用移液管移取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗酸性高锰酸钾标准溶液的体积如下表:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| V(酸性KMnO4标准溶液)/mL | 17.10 | 18.10 | 18.00 | 17.90 |
试样中过氧化氢的浓度为
(3)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上。实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛(HCHO)溶液依次加入质量分数为30%~70%的过氧化氢溶液中。该反应的化学方程式为
(4)过氧化氢与碳酸钠的加合物Na2CO3•xH2O2比较稳定,方便储存,可用于消毒、漂白。现称取157gNa2CO3•xH2O2晶体加热,实验结果如图所示,则该晶体的组成为

您最近一年使用:0次
7 . 水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
I.取样、氧的固定将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成 MnO(OH)2,实现氧的固定。
II.酸化将固氧后的水样酸化,MnO(OH)2 被 I- 还原为Mn2+
III.用标准 Na2S2O3溶液滴定生成的 I2(2S2O +I2=2I- + S4O
+I2=2I- + S4O )。
)。
回答下列问题:
(1)写出步骤 II 的离子反应方程式___________
(2)取 100 .00mL 水样经固氧、酸化后,用 a mol•L-1Na2S2O3溶液滴定,以淀粉溶液作指示剂,滴定终点的现象是___________ ,且半分钟内不变色。若消耗 Na2S2O3 溶液的体积为 b mL, 则水样中溶解氧的含量为__________ mg•L-1
I.取样、氧的固定将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成 MnO(OH)2,实现氧的固定。
II.酸化将固氧后的水样酸化,MnO(OH)2 被 I- 还原为Mn2+
III.用标准 Na2S2O3溶液滴定生成的 I2(2S2O
 +I2=2I- + S4O
+I2=2I- + S4O )。
)。回答下列问题:
(1)写出步骤 II 的离子反应方程式
(2)取 100 .00mL 水样经固氧、酸化后,用 a mol•L-1Na2S2O3溶液滴定,以淀粉溶液作指示剂,滴定终点的现象是
您最近一年使用:0次
解题方法
8 . 酸性或碱性溶液中铝均可与NO 发生氧化还原反应,转化关系如图:
发生氧化还原反应,转化关系如图:
已知:气体D和A溶液反应生成白色沉淀,气体D和F反应可生成盐。

请回答下列问题:
(1)写出铝在碱性条件下与NO 反应的离子方程式
反应的离子方程式_________ 。
(2)在酸性条件下,被还原的NO 与Al的物质的量之比是
与Al的物质的量之比是_______ 。
(3)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C和E都转化为无毒的气态单质,请写出D和C反应的化学方程式:____________ 。
 发生氧化还原反应,转化关系如图:
发生氧化还原反应,转化关系如图:已知:气体D和A溶液反应生成白色沉淀,气体D和F反应可生成盐。

请回答下列问题:
(1)写出铝在碱性条件下与NO
 反应的离子方程式
反应的离子方程式(2)在酸性条件下,被还原的NO
 与Al的物质的量之比是
与Al的物质的量之比是(3)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C和E都转化为无毒的气态单质,请写出D和C反应的化学方程式:
您最近一年使用:0次
9 . 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,发生_____ (填“氧化”或“还原”)反应,则该反应的还原剂是________ 。
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为____ 。
(3)根据上述反应可推知________ (填序号)。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>HBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。_____________
 +
+
(1)已知KBrO3在反应中得到电子,发生
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为
(3)根据上述反应可推知
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>HBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。
 +
+
您最近一年使用:0次
名校
10 . 铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)向沸水中逐滴滴加1mol·L-1FeCl3溶液至液体呈透明的红褐色,所得分散系中微粒直径的范围是______________ ,区别该液体和FeCl3溶液的方法是______________ 。
(2)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 Fe3O4+6SO2,氧化产物为
Fe3O4+6SO2,氧化产物为________ ,若有3mol FeS2参加反应,转移________ mol电子。
(3)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有气体逸出,请配平该化学方程式:
___ FeSO4+____ KNO3+___ H2SO4═____ K2SO4+_____ Fe2(SO4)3+__ NO↑+_____ H2O。
(4)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160mL 5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L(标准状况)H2,经检测,溶液中无Fe3+,则参加反应的铁粉的质量为________ g。
(1)向沸水中逐滴滴加1mol·L-1FeCl3溶液至液体呈透明的红褐色,所得分散系中微粒直径的范围是
(2)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2
 Fe3O4+6SO2,氧化产物为
Fe3O4+6SO2,氧化产物为(3)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有气体逸出,请配平该化学方程式:
(4)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160mL 5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L(标准状况)H2,经检测,溶液中无Fe3+,则参加反应的铁粉的质量为
您最近一年使用:0次
2020-04-27更新
|
279次组卷
|
2卷引用:辽宁省丹东市2017-2018学年高一上学期期末质量监测化学试题





