名校
解题方法
1 . 某兴趣小组利用经过初步处理的含有Fe2+的废液制备硫酸亚铁晶体的流程如图:____ ,若NaHCO3溶液浓度偏低可能会形成胶体,验证的方法为____ 。
(2)加入铁粉的作用是____ 。
(3)测定废液中Fe2+的浓度可使用已知浓度的酸性高锰酸钾溶液。配平下面方程式,并用双线桥法表示电子转移过程:____ 。
KMnO4+___FeSO4+___H2SO4=___MnSO4+___K2SO4+___Fe2(SO4)3+___H2O。
(4)已知Fe2+与NaHCO3按物质的量1:2的比例恰好完全反应,该反应的离子方程式为____ 。
(5)硫酸亚铁在空气中煅烧生成Fe2O3和一种酸性氧化物,该反应的化学方程式为____ ,该反应中每产生1molFe2O3,转移的电子数为____ NA。

(2)加入铁粉的作用是
(3)测定废液中Fe2+的浓度可使用已知浓度的酸性高锰酸钾溶液。配平下面方程式,并用双线桥法表示电子转移过程:
KMnO4+___FeSO4+___H2SO4=___MnSO4+___K2SO4+___Fe2(SO4)3+___H2O。
(4)已知Fe2+与NaHCO3按物质的量1:2的比例恰好完全反应,该反应的离子方程式为
(5)硫酸亚铁在空气中煅烧生成Fe2O3和一种酸性氧化物,该反应的化学方程式为
您最近一年使用:0次
2022-03-16更新
|
246次组卷
|
2卷引用:辽宁省渤海大学附属高级中学2021-2022学年高一上学期期末质量检测化学试题
名校
解题方法
2 . 纳米级四氧化三铁是应用最为广泛的软磁性材料之一。 共沉淀法是目前制备纳米四氧化三铁的重要方法,其流程如图所示:
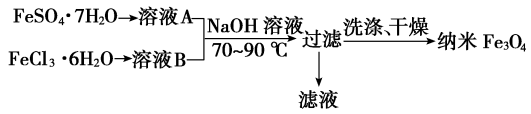
下列说法错误的是

下列说法错误的是
| A.该制备反应类型不属于氧化还原反应 |
| B.共沉淀法中FeSO4·7H2O和FeCl3·6H2O的物质的量之比最好应为1:2 |
| C.若滤液进行焰色反应,火焰为黄色则说明氢氧化钠过量了 |
D.另一种水热法制备Fe3O4纳米颗粒的反应3Fe2++2S2O +O2+xOH-=Fe3O4↓+S4O +O2+xOH-=Fe3O4↓+S4O +2H2O每消耗3 molOH-,则有1.5 mol Fe2+被氧化 +2H2O每消耗3 molOH-,则有1.5 mol Fe2+被氧化 |
您最近一年使用:0次
2022-01-23更新
|
1035次组卷
|
6卷引用:辽宁省辽南协作体2022-2023学年高一上学期期末考试化学试题
3 . 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
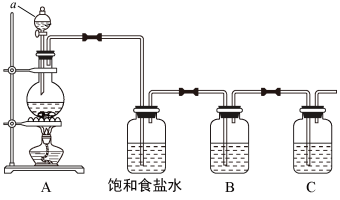
(1)仪器a的名称为___________
(2)请写出A装置中发生反应的化学方程式___________ 。
(3)饱和食盐水的作用是___________ 。
(4)装置B中盛放的试剂是___________ (选填下列所给试剂的编号),反应离子方程式是___________ 。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液
溶液
(5)还有哪些事实能够说明氯元素的非金属性比疏元素的非金属性强___________ (填编号)
① 比
比 稳定
稳定
② 氧化性比
氧化性比 强
强
③ 酸性比
酸性比 强
强
④ 酸性比
酸性比 强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子
强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子
⑥ 与铁反应生成
与铁反应生成 ,而S与铁反应生成
,而S与铁反应生成

(1)仪器a的名称为
(2)请写出A装置中发生反应的化学方程式
(3)饱和食盐水的作用是
(4)装置B中盛放的试剂是
A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液
溶液(5)还有哪些事实能够说明氯元素的非金属性比疏元素的非金属性强
①
 比
比 稳定
稳定 ②
 氧化性比
氧化性比 强
强 ③
 酸性比
酸性比 强
强④
 酸性比
酸性比 强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子
强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子⑥
 与铁反应生成
与铁反应生成 ,而S与铁反应生成
,而S与铁反应生成
您最近一年使用:0次
解题方法
4 . 某钴矿石的主要成分有 、
、 、
、 、
、 、
、 和
和 等。由该矿石粉制备
等。由该矿石粉制备 固体的方法如图(部分催化剂已略)。
固体的方法如图(部分催化剂已略)。
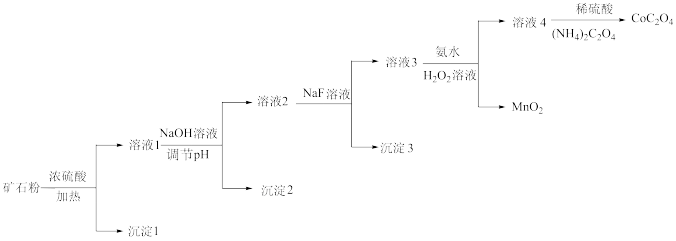
已知:金属离子沉淀的 :
:
(1) 原子的核外电子排布式为
原子的核外电子排布式为_______ 。
(2)向溶液1中加入 溶液,将
溶液,将 转化为
转化为 沉淀,应调节
沉淀,应调节 至少大于
至少大于_______ 。
(3)向溶液2中加入 溶液,去除的离子是
溶液,去除的离子是_______ 。
(4)向溶液3中加入氨水和过氧化氢溶液,将 转化为
转化为 。该反应的离子方程式为:
。该反应的离子方程式为:_______ 。
(5)溶液4中,若将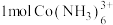 全部转化为
全部转化为 沉淀,需要消耗
沉淀,需要消耗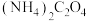
_______  。
。
(6)关于上述流程,下列说法正确的是_______ (填序号)。
a.若矿石粉中存在少量 ,经上述流程也可制得纯度相同的
,经上述流程也可制得纯度相同的
b.向溶液3中加入氨水,作用仅是调节溶液的pH
c.流程中,仅通过调节溶液的pH无法将金属元素完全分离
 、
、 、
、 、
、 、
、 和
和 等。由该矿石粉制备
等。由该矿石粉制备 固体的方法如图(部分催化剂已略)。
固体的方法如图(部分催化剂已略)。
已知:金属离子沉淀的
 :
: |  |  |  |  | |
| 开始沉淀时 | 1.5 | 6.3 | 8.9 | 8.2 | 7.4 |
| 完全沉淀时 | 2.8 | 8.3 | 10.9 | 10.2 | 9.4 |
 原子的核外电子排布式为
原子的核外电子排布式为(2)向溶液1中加入
 溶液,将
溶液,将 转化为
转化为 沉淀,应调节
沉淀,应调节 至少大于
至少大于(3)向溶液2中加入
 溶液,去除的离子是
溶液,去除的离子是(4)向溶液3中加入氨水和过氧化氢溶液,将
 转化为
转化为 。该反应的离子方程式为:
。该反应的离子方程式为:(5)溶液4中,若将
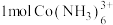 全部转化为
全部转化为 沉淀,需要消耗
沉淀,需要消耗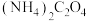
 。
。(6)关于上述流程,下列说法正确的是
a.若矿石粉中存在少量
 ,经上述流程也可制得纯度相同的
,经上述流程也可制得纯度相同的
b.向溶液3中加入氨水,作用仅是调节溶液的pH
c.流程中,仅通过调节溶液的pH无法将金属元素完全分离
您最近一年使用:0次
名校
解题方法
5 . 从废旧铅蓄电池铅膏(含 和
和 等)中回收铅的工艺流程如下:
等)中回收铅的工艺流程如下:

下列说法错误的是
 和
和 等)中回收铅的工艺流程如下:
等)中回收铅的工艺流程如下:
下列说法错误的是
A.流程中 作氧化剂 作氧化剂 |
B.向废铅膏中加入 和 和 后,溶液温度不宜过高 后,溶液温度不宜过高 |
C.“滤液”中溶质主要是 |
| D.电解时,阳极、阴极材料可分别用石墨、铅 |
您最近一年使用:0次
解题方法
6 . 面对新冠病毒,VB空气防护卡也成了“网红”,成为人们讨论的话题。商品介绍卡片中含有的主要活性成分——亚氯酸钠,在接触空气时可以释放安全可靠的低浓度二氧化氯( ),从而达到消除病毒、细菌活性的防护效果。
),从而达到消除病毒、细菌活性的防护效果。 的一种生产工艺如下:
的一种生产工艺如下:
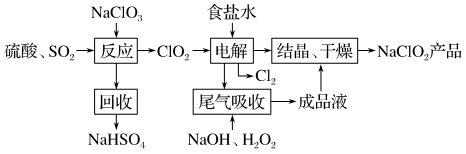
回答下列问题:
(1)写出“反应”步骤中生成 的化学反应方程式:
的化学反应方程式:_______ 。
(2)“电解”所用食盐水由粗盐水精制而成,精制时,为除去 、
、 、
、 ,要加入的试剂分别为
,要加入的试剂分别为_______ 、_______ 、_______ ,为得到纯净的NaCl溶液还需加入_______ (以上填写相应物质的化学式)。
(3)“电解”产生的 可用于工业制漂白液,写出离子反应方程式:
可用于工业制漂白液,写出离子反应方程式:_______ 。
(4)“尾气吸收”是吸收“电解”过程排出的少量 ,此吸收反应中,氧化剂与还原剂的物质的量之比为
,此吸收反应中,氧化剂与还原剂的物质的量之比为_______ ,该反应中还原产物是_______ 。
(5)有同学推测VB空气防护卡原理是因为 与空气中的
与空气中的 发生反应得到
发生反应得到 ,同时得到钠的两种正盐,试写出相应的化学反应方程式:
,同时得到钠的两种正盐,试写出相应的化学反应方程式:_______ 。
 ),从而达到消除病毒、细菌活性的防护效果。
),从而达到消除病毒、细菌活性的防护效果。 的一种生产工艺如下:
的一种生产工艺如下:
回答下列问题:
(1)写出“反应”步骤中生成
 的化学反应方程式:
的化学反应方程式:(2)“电解”所用食盐水由粗盐水精制而成,精制时,为除去
 、
、 、
、 ,要加入的试剂分别为
,要加入的试剂分别为(3)“电解”产生的
 可用于工业制漂白液,写出离子反应方程式:
可用于工业制漂白液,写出离子反应方程式:(4)“尾气吸收”是吸收“电解”过程排出的少量
 ,此吸收反应中,氧化剂与还原剂的物质的量之比为
,此吸收反应中,氧化剂与还原剂的物质的量之比为(5)有同学推测VB空气防护卡原理是因为
 与空气中的
与空气中的 发生反应得到
发生反应得到 ,同时得到钠的两种正盐,试写出相应的化学反应方程式:
,同时得到钠的两种正盐,试写出相应的化学反应方程式:
您最近一年使用:0次
2022-01-19更新
|
519次组卷
|
2卷引用:辽宁省五校2021-2022学年高一上学期期末联考化学试题
解题方法
7 . 采用 双催化剂,可实现用
双催化剂,可实现用 消除酸性废水中的致癌阴离子
消除酸性废水中的致癌阴离子 、
、 ,
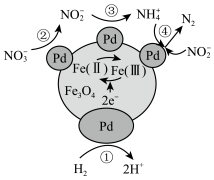
, 中Fe元素的两种价态分别表示为Fe(Ⅱ)、Fe(Ⅲ),其反应历程如图所示。下列说法错误的是
中Fe元素的两种价态分别表示为Fe(Ⅱ)、Fe(Ⅲ),其反应历程如图所示。下列说法错误的是
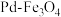 双催化剂,可实现用
双催化剂,可实现用 消除酸性废水中的致癌阴离子
消除酸性废水中的致癌阴离子 、
、 ,
, 中Fe元素的两种价态分别表示为Fe(Ⅱ)、Fe(Ⅲ),其反应历程如图所示。下列说法错误的是
中Fe元素的两种价态分别表示为Fe(Ⅱ)、Fe(Ⅲ),其反应历程如图所示。下列说法错误的是
| A.反应历程中Fe(Ⅱ)与Fe(Ⅲ)总物质的量不变 |
B.过程②发生的反应为: |
C.过程①中产生0.5mol 则消除46g 则消除46g |
| D.用该法处理后废水的酸性也会变弱 |
您最近一年使用:0次
名校
8 . 磁性纳米四氧化三铁在催化剂、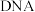 检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米
检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米 的流程如下:
的流程如下:
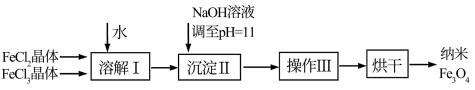
(1)Ⅱ中的反应温度需控制在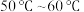 之间,生成
之间,生成 的离子方程式是
的离子方程式是_______ 。
(2)操作Ⅲ分离 的方法为过滤,所需的玻璃仪器为烧杯、
的方法为过滤,所需的玻璃仪器为烧杯、_______ 、_______ 。
(3)某同学依据上述“共沉淀法”的思路在实验室模拟制备纳米 ;为得到较纯净的纳米
;为得到较纯净的纳米 ,
, 与
与 的物质的量之比最好为
的物质的量之比最好为_______ 。但实际操作时,却很难控制这一比例,原因是_______ 。
(4)经过多次实验发现,当混合溶液中 时,容易得到理想的纳米
时,容易得到理想的纳米 。在此条件下,如何检验
。在此条件下,如何检验 是否沉淀完全
是否沉淀完全_______ 。
(5)以太阳能为热源分解 ,铁氧化合物循环分解水制
,铁氧化合物循环分解水制 的过程如图所示。
的过程如图所示。
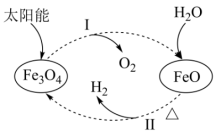
①下列叙述正确的是_______ (填字母)。
A.过程Ⅰ的能量转化为太阳能→化学能
B.过程Ⅰ中 为氧化剂
为氧化剂
C.过程中的 为碱性氧化物
为碱性氧化物
D.铁氧化合物循环制 与电解水制
与电解水制 相比,具有节约能源的优点
相比,具有节约能源的优点
②请写出反应Ⅱ对应的化学方程式_______ 。
(6)为了防止枪支生锈,常采用化学处理使钢铁零件表面生成 的致密保护层——“发蓝”。化学处理过程中其中一步的反应为:
的致密保护层——“发蓝”。化学处理过程中其中一步的反应为: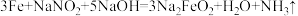 。下列有关的叙述不正确的是_______(填字母)。
。下列有关的叙述不正确的是_______(填字母)。
 检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米
检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米 的流程如下:
的流程如下:
(1)Ⅱ中的反应温度需控制在
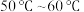 之间,生成
之间,生成 的离子方程式是
的离子方程式是(2)操作Ⅲ分离
 的方法为过滤,所需的玻璃仪器为烧杯、
的方法为过滤,所需的玻璃仪器为烧杯、(3)某同学依据上述“共沉淀法”的思路在实验室模拟制备纳米
 ;为得到较纯净的纳米
;为得到较纯净的纳米 ,
, 与
与 的物质的量之比最好为
的物质的量之比最好为(4)经过多次实验发现,当混合溶液中
 时,容易得到理想的纳米
时,容易得到理想的纳米 。在此条件下,如何检验
。在此条件下,如何检验 是否沉淀完全
是否沉淀完全(5)以太阳能为热源分解
 ,铁氧化合物循环分解水制
,铁氧化合物循环分解水制 的过程如图所示。
的过程如图所示。
①下列叙述正确的是
A.过程Ⅰ的能量转化为太阳能→化学能
B.过程Ⅰ中
 为氧化剂
为氧化剂C.过程中的
 为碱性氧化物
为碱性氧化物D.铁氧化合物循环制
 与电解水制
与电解水制 相比,具有节约能源的优点
相比,具有节约能源的优点②请写出反应Ⅱ对应的化学方程式
(6)为了防止枪支生锈,常采用化学处理使钢铁零件表面生成
 的致密保护层——“发蓝”。化学处理过程中其中一步的反应为:
的致密保护层——“发蓝”。化学处理过程中其中一步的反应为: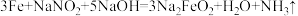 。下列有关的叙述不正确的是_______(填字母)。
。下列有关的叙述不正确的是_______(填字母)。A. 的氧化性大于 的氧化性大于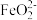 的氧化性 的氧化性 |
B.反应中转移电子 ,则生成还原产物 ,则生成还原产物 |
| C.枪支“发蓝”实质上是使铁表面钝化生成致密保护层导致难以生锈 |
D.上述反应中,若有 单质铁被氧化,生成的氨气在标准状况下的体积为1.12升(假设氨气完全逸出) 单质铁被氧化,生成的氨气在标准状况下的体积为1.12升(假设氨气完全逸出) |
您最近一年使用:0次
2022-01-19更新
|
309次组卷
|
2卷引用:辽宁省抚顺市六校协作体2021-2022学年高一上学期期末考试化学试题
解题方法
9 . 已知氢碘酸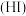 是一种具有强还原性的强酸,
是一种具有强还原性的强酸, 可以与多种物质【如:
可以与多种物质【如: 、
、 、
、 、
、 、
、 、
、 等】发生不同类型的化学反应.请回答下列问题:
等】发生不同类型的化学反应.请回答下列问题:
(1)下图可表示离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是_________ (填标号).
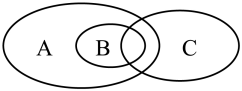
(2) 在水溶液中的电离方程式为
在水溶液中的电离方程式为_________________ .
(3)常温下 溶液与
溶液与 反应的化学方程式为
反应的化学方程式为 ,说明还原性
,说明还原性
______  (填“>”、“<”或“=).
(填“>”、“<”或“=).
(4)在反应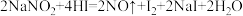 ,氧化剂与还原剂的物质的量之比为
,氧化剂与还原剂的物质的量之比为________ .
(5)下列三种氧化剂均可以将 氧化生成
氧化生成 ,自身对应的还原产物情况如下:
,自身对应的还原产物情况如下:
请判断等物质的量的三种氧化剂分别与足量HI作用,得到I2质量最多的是________ (填选项标号).
(6)向 胶体中逐滴加入HI稀溶液,会出现如下一系列变化:先出现红褐色沉淀;随后沉淀溶解,溶液呈黄色:最后溶液颜色加深.
胶体中逐滴加入HI稀溶液,会出现如下一系列变化:先出现红褐色沉淀;随后沉淀溶解,溶液呈黄色:最后溶液颜色加深.
①红褐色沉淀溶解,反应的离子方程式为___________________________ .
②最后溶液颜色加深,反应的离子方程式为______________________________ .
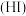 是一种具有强还原性的强酸,
是一种具有强还原性的强酸, 可以与多种物质【如:
可以与多种物质【如: 、
、 、
、 、
、 、
、 、
、 等】发生不同类型的化学反应.请回答下列问题:
等】发生不同类型的化学反应.请回答下列问题:(1)下图可表示离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是

(2)
 在水溶液中的电离方程式为
在水溶液中的电离方程式为(3)常温下
 溶液与
溶液与 反应的化学方程式为
反应的化学方程式为 ,说明还原性
,说明还原性
 (填“>”、“<”或“=).
(填“>”、“<”或“=).(4)在反应
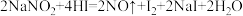 ,氧化剂与还原剂的物质的量之比为
,氧化剂与还原剂的物质的量之比为(5)下列三种氧化剂均可以将
 氧化生成
氧化生成 ,自身对应的还原产物情况如下:
,自身对应的还原产物情况如下:选项 | A | B | C |
氧化剂 |
|
|
|
还原产物 |
|
|
|
(6)向
 胶体中逐滴加入HI稀溶液,会出现如下一系列变化:先出现红褐色沉淀;随后沉淀溶解,溶液呈黄色:最后溶液颜色加深.
胶体中逐滴加入HI稀溶液,会出现如下一系列变化:先出现红褐色沉淀;随后沉淀溶解,溶液呈黄色:最后溶液颜色加深.①红褐色沉淀溶解,反应的离子方程式为
②最后溶液颜色加深,反应的离子方程式为
您最近一年使用:0次
10 . 某离子反应中涉及 、
、 、
、 、H+、N2、Cl-六种粒子,其中
、H+、N2、Cl-六种粒子,其中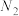 的物质的量随时间变化的曲线如图所示.下列判断正确的是
的物质的量随时间变化的曲线如图所示.下列判断正确的是

 、
、 、
、 、H+、N2、Cl-六种粒子,其中
、H+、N2、Cl-六种粒子,其中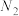 的物质的量随时间变化的曲线如图所示.下列判断正确的是
的物质的量随时间变化的曲线如图所示.下列判断正确的是
| A.反应后溶液的酸性增强 | B.标准状况下,生成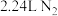 时,反应中转移 时,反应中转移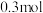 电子 电子 |
| C.氧化产物与还原产物的物质的量之比为2∶1 | D. 被还原,是还原剂 被还原,是还原剂 |
您最近一年使用:0次
2022-01-18更新
|
320次组卷
|
2卷引用:辽宁省锦州市2021-2022学年高一上学期期末考试化学试题



